Budowa atomu a położenie pierwiastka w układzie okresowym
Układ okresowy nazywany jest często „legalną ściągą chemika”. Czy wiesz skąd wzięło się to sformułowanie? Co takiego może nam podpowiedzieć układ okresowy? Czy możemy z niego odczytać informacje na temat budowy atomów poszczególnych pierwiastków chemicznych?
budowę układu okresowego pierwiastków chemicznych oraz sposób rozmieszczenia w nim pierwiastków chemicznych;
budowę atomu;
definicję konfiguracji elektronowej i sposoby jej zapisywania;
definicję elektronów walencyjnych.
określać liczbę elektronów walencyjnych w atomach poszczególnych pierwiastków chemicznych na podstawie położenia tych pierwiastków w układzie okresowym;
wyznaczać liczbę powłok elektronowych w atomach pierwiastków na podstawie położenia tych pierwiastków w układzie okresowym;
przewidywać podobieństwa we właściwościach pierwiastków chemicznych na podstawie ich położenia w układzie okresowym;
omawiać zmiany aktywności metali i niemetali na tle układu okresowego;
uzasadniać zmiany długości promieni atomowych na tle układu okresowego dla atomów pierwiastków należących do grup pierwszej i drugiej oraz od do
1. Co można powiedzieć na temat budowy atomu pierwiastka na podstawie numeru grupy, do której należy?
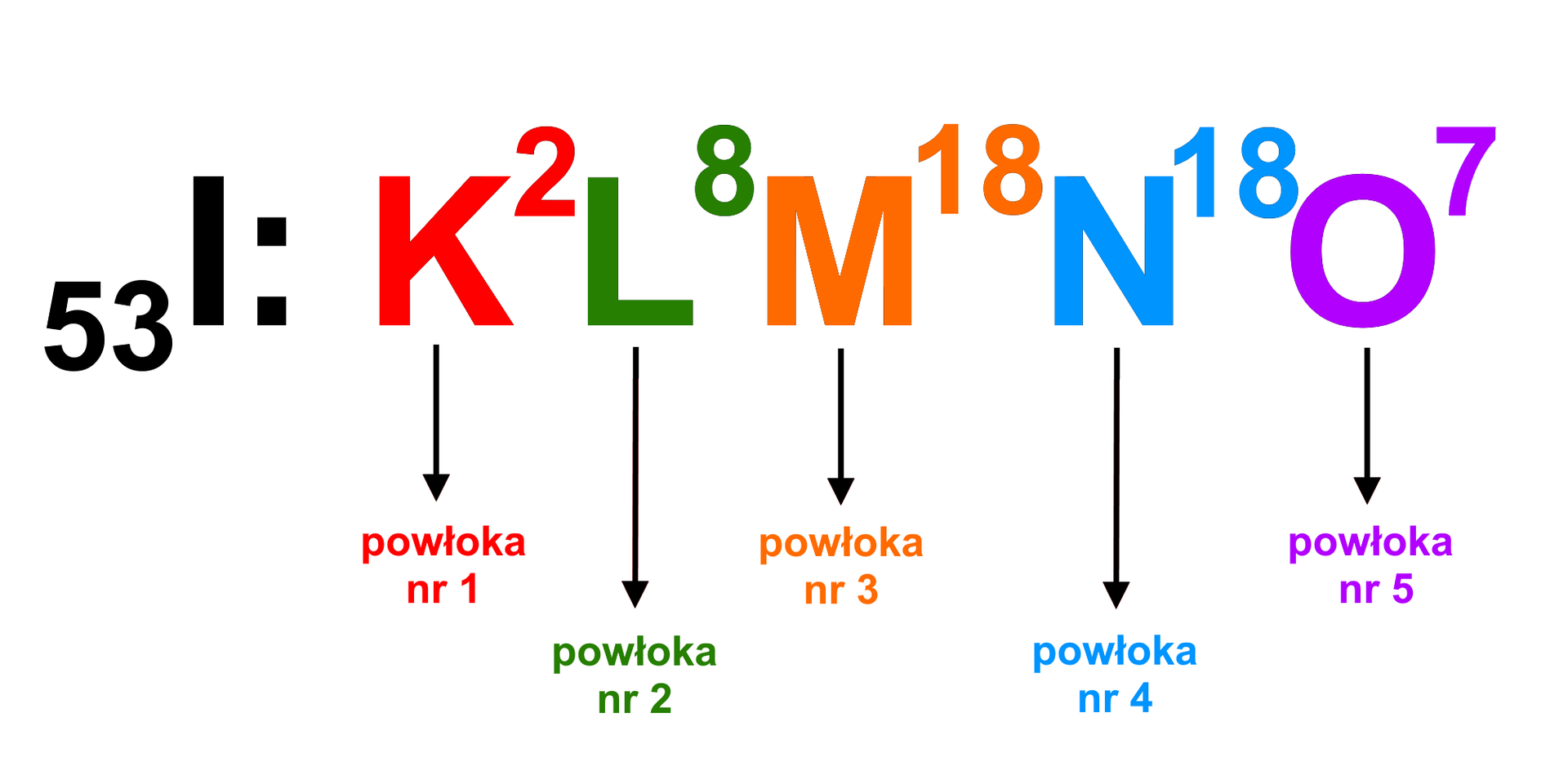
Układ okresowyUkład okresowy, obok niezbędnych informacji: liczb atomowych i symboli pierwiastków, może zawierać także inne dane. Przykładowo, na poniżej przedstawionym układzie okresowym uwzględniono konfiguracje elektronowekonfiguracje elektronowe atomów poszczególnych pierwiastków chemicznych.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DnUl6kmBC
Symbol i liczba atomowa pierwiastka: | Konfiguracja elektronowa | Konfiguracja elektronowa |
|---|---|---|
Symbol i liczba atomowa pierwiastka: | Przewidywana konfiguracja elektronowa zapis powłokowy: | Przewidywana konfiguracja elektronowa zapis podpowłokowy: |
Przeanalizuj konfiguracje elektronowe atomów pierwiastków chemicznych, które należą do grup pierwszej i drugiej oraz od do układu okresowego. Wskaż zbiory pierwiastków, których atomy mają jednakową liczbę elektronów walencyjnych.
Czy na podstawie analizy konfiguracji elektronowych atomów pierwiastków chemicznych, które należą do grup wskazanych w poleceniu , można znaleźć prawidłowość między liczbą elektronów walencyjnych a położeniem pierwiastka w układzie okresowym?
Po dokładnym zapoznaniu się z danymi zawartymi w układzie okresowym pierwiastków, można dostrzec, że w obrębie wskazanych grup atomy pierwiastków chemicznych mają jednakową liczbę elektronów, zlokalizowanych w obrębie ostatniej powłoki elektronowejpowłoki elektronowej. Wyjątek stanowi tutaj hel, którego atom ma dwa elektrony walencyjne, w przeciwieństwie do atomów pozostałych pierwiastków z grupy – ich atomy mają po osiem elektronów walencyjnych.
Numer grupy w układzie okresowym | ||||||||
|---|---|---|---|---|---|---|---|---|
Liczba elektronów walencyjnych w atomie pierwiastka chemicznego | (wyjątek – atom helu – dwa elektrony walencyjne) |
Wiedza na temat liczby elektronów walencyjnych jest przydatna, ponieważ pełnią one szczególną funkcję we wzajemnych oddziaływaniach atomów. Liczbę tę można odczytać w prosty sposób z układu okresowego. Zauważ, że przypadku grup pierwszej i drugiej, liczba elektronów walencyjnych w atomach pierwiastków chemicznych jest równa numerowi grupy. W grupach od do liczbę elektronów walencyjnych w atomach poszczególnych pierwiastków można natomiast otrzymać po odjęciu liczby od numeru grupy. W grupie powyższa zasada nie dotyczy helu – jego atom ma tylko dwa elektrony, które zarazem są elektronami walencyjnymi.
Określ liczbę elektronów walencyjnych w atomie bromu. Sprawdź poprawność wykonania zadania, analizując zamieszczoną w odpowiedzi animację.
Liczba elektronów walencyjnych w atomach pierwiastków chemicznych, które należą do grup od trzeciej do układu okresowego, równa jest numerowi grupy. Elektrony walencyjne w atomach wspomnianych pierwiastków chemicznych znajdują się co prawda najdalej od jądra atomowego, ale nie należą wyłącznie do ostatniej powłoki elektronowej atomu. Są to elektrony zlokalizowane w obrębie ostatniej powłoki elektronowej oraz (w uproszczeniu) w obrębie określonego fragmentu przedostatniej powłoki elektronowej atomu.
Uwaga: szczegóły dotyczące ustalania liczby elektronów walencyjnych w atomach pierwiastków grup od trzeciej do poznasz na dalszych etapach edukacji.
2. O czym świadczy numer okresu, w którym znajduje się pierwiastek?
Na podstawie zapisu konfiguracji elektronowej można określić liczbę powłok elektronowych, z których jest zbudowany jest atom danego pierwiastka chemicznego. Przykładowo: konfiguracja elektronowa atomu lantanu ma postać: (lub zapis ). Z przedstawionego zapisu konfiguracji możemy odczytać, że w atomie lantanu elektrony rozmieszczone są na sześciu powłokach elektronowych.
Wyszukaj w układzie okresowym przynajmniej cztery zbiory pierwiastków, których atomy mają jednakową liczbę powłok elektronowych.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/DnUl6kmBC
Wyszukaj przynajmniej cztery zbiory pierwiastków, których atomy mają jednakową liczbę powłok elektronowych.
Wyszukaj przynajmniej cztery zbiory pierwiastków, których atomy mają jednakową liczbę powłok elektronowych.
Symbol i liczba atomowa pierwiastka: | Konfiguracja elektronowa | Konfiguracja elektronowa |
|---|---|---|
Symbol i liczba atomowa pierwiastka: | Przewidywana konfiguracja elektronowa zapis powłokowy: | Przewidywana konfiguracja elektronowa zapis podpowłokowy: |
Czy można zatem znaleźć zależność między liczbą powłok elektronowych w atomie a położeniem pierwiastka chemicznego w układzie okresowym?
Analizując układ okresowy pierwiastków, który uwzględnia konfiguracje elektronowe atomów, wyraźnie widać, że pierwiastki o atomach złożonych z identycznej liczby powłok elektronowych znajdują się w tym samym okresie. Ponadto liczba tych powłok elektronowych jest równa liczbie określającej numer okresu. To spostrzeżenie pozwala wyciągnąć ogólny wniosek – liczba powłok elektronowych w atomie danego pierwiastka chemicznego równa jest numerowi okresu w układzie okresowym, w którym ten pierwiastek się znajduje.
Określ liczbę powłok elektronowych w atomie strontu. Sprawdź poprawność wykonania zadania, analizując zamieszczoną w odpowiedzi animację.
3. Co można powiedzieć na temat budowy atomów na podstawie położenia pierwiastka w układzie okresowym?
Istnieje związek pomiędzy budową atomu a położeniem pierwiastka w układzie okresowym. Numer okresu informuje o tym, z ilu powłok elektronowych składa się atom pierwiastka, a numery grup pomagają określić liczbę elektronów walencyjnych w atomach poszczególnych pierwiastków chemicznych.

Określ liczbę elektronów walencyjnych oraz liczbę powłok elektronowych w atomie ołowiu. Sprawdź poprawność wykonania zadania, analizując zamieszczoną w odpowiedzi animację.
4. Zmiany właściwości pierwiastków w grupie i okresie
Atomy pierwiastków, które należą do tej samej grupy układu okresowego, mają jednakową liczbę elektronów walencyjnych (wyjątek, jak już wspomniano, stanowi atom helu). Ponieważ liczba elektronów walencyjnych jest jednym z parametrów mających wpływ na właściwości chemiczne pierwiastka, możemy wnioskować, że pierwiastki z tej samej grupy wykazują podobne właściwości. Da się to zaobserwować szczególnie w przypadku litowców (pierwsza grupa układu okresowego z wyjątkiem wodoru), berylowców (druga grupa układu okresowego), fluorowców ( grupa układu okresowego) i helowców ( grupa układu okresowego).
Sprawdź, czy litowce wykazują podobne właściwości chemiczne w kontakcie z wodą.
W tym celu wykonaj doświadczenie 1. Wykonaj je w asyście osoby dorosłej. Pamiętaj o zachowaniu wszelkich środków ostrożności – doświadczenie wykonaj w okularach ochronnych, pod dygestorium, z dala od źródeł ognia. Zapisz obserwacje i sformułuj odpowiednie wnioski.
Problem badawczy:
Czy litowce wykazują podobne właściwości chemiczne w kontakcie z wodą?
Hipoteza:
Metale należące do pierwszej grupy układu okresowego reagują z wodą.
Co było potrzebne?
lit;
sód;
potas;
woda destylowana;
metalowe szczypce;
bibuła filtracyjna;
nóż;
trzy wysokie zlewki (o pojemności ).
Instrukcja:
Do trzech zlewek wlano po około wody destylowanej i ustawiono je w rzędzie obok siebie. Z pojemnika zawierającego metal wyjęto próbkę metalu i położono na suchej bibule. Suchym nożem odcięto kawałek metalu wielkości dwóch ziarenek ryżu. Niewykorzystany kawałek metalu odłożono ponownie do pojemnika, a pojemnik odsunięto od miejsca wykonywania doświadczenia. W ten sam sposób postąpiono z każdym z trzech metali. Każdy kawałek wrzucono do innej zlewki z wodą i obserwowano zachodzące zmiany.
Obserwacje:
Każdy z metali, po wprowadzeniu go do wody, unosił się na jej powierzchni. Potas zapalił się zaraz po wprowadzeniu go do wody. W każdej ze zlewek zaobserwowano roztwarzanie się (zanik) ciała stałego (metalu) oraz wydzielanie się bezbarwnego, bezwonnego gazu. Najbardziej intensywne wydzielanie się gazu zaobserwowano w zlewce z potasem, a najmniej intensywne – w zlewce z litem.
Wnioski:
Postawiona hipoteza jest prawdziwa – poczynione obserwacje świadczą o tym, że litowce reagują z wodą. Można również wnioskować, że lit, sód oraz potas wykazują różną aktywność wobec wody. Najbardziej aktywny z analizowanych metali w reakcji z wodą jest potas, a najmniej aktywny lit. Unoszenie się metali na powierzchni wody informuje, że każdy z użytych w doświadczeniu metali ma gęstość mniejszą od gęstości wody.
Napisz obserwacje odnotowane w trakcie wykonywania doświadczenia oraz wynikające z nich wnioski.
Podobieństwo we właściwościach chemicznychwłaściwościach chemicznych objawia się tym, że pierwiastki z tej samej grupy układu okresowego reagują z tymi samymi substancjami chemicznymi, a z innymi pierwiastkami tworzą podobny typ związków chemicznych. Każdy z wykorzystanych w doświadczeniu 1 metali ulega reakcji chemicznej z wodą (świadczy o tym m.in. wydzielanie się gazu – powstaje nowa substancja chemiczna).
Reakcja ta dla każdego z użytych metali zachodzi z różną intensywnością (zmiany obserwowane są z różną intensywnością). W przypadku potasu, reakcja z wodą zachodzi najszybciej (potas w kontakcie z wodą zapala się), nieco wolniej przebiega reakcja sodu z wodą, a najwolniej reakcja litu z wodą. Możemy zatem wnioskować, że litowce to metale aktywne – łatwo reagują z wodą, przy czym aktywność użytych w doświadczeniu metali rośnie w szeregu: lit, sód, potas.
W tym samym szeregu rośnie liczba atomowa wymienionych pierwiastków chemicznych. Pewne prawidłowości, związane ze zmianą aktywnościaktywności pierwiastków chemicznych tej samej grupy, możemy również określić dla pozostałych grup układu okresowego.
Berylowce, a więc pierwiastki należące do drugiej grupy układu okresowego, podobnie jak litowce, są aktywnymi metalami. Aktywność berylowców rośnie wraz ze wzrostem liczby atomowej. Znajdujące się po drugiej stronie układu okresowego fluorowce (grupa ) tworzą grupę aktywnych chemicznie niemetali, wśród których największą aktywnością odznacza się fluor. Ich aktywność rośnie więc wraz ze zmniejszaniem się liczby atomowej. Ostatnia grupa, helowce, to zbiór najmniej aktywnych pierwiastków w całym układzie okresowym. Z powodu małej aktywności chemicznej, nazwano je gazami szlachetnymi.
Pierwiastki chemiczne, które należą do jednego okresu układu okresowego, nie wykazują podobieństw we właściwościach chemicznych. W okresach następuje zmiana charakteru pierwiastków – od aktywnych metali (pierwszej i drugiej grupy z wyjątkiem berylu), poprzez metale o mniejszej aktywności i aktywne niemetale, aż do biernych chemicznie helowców (gazów szlachetnych).
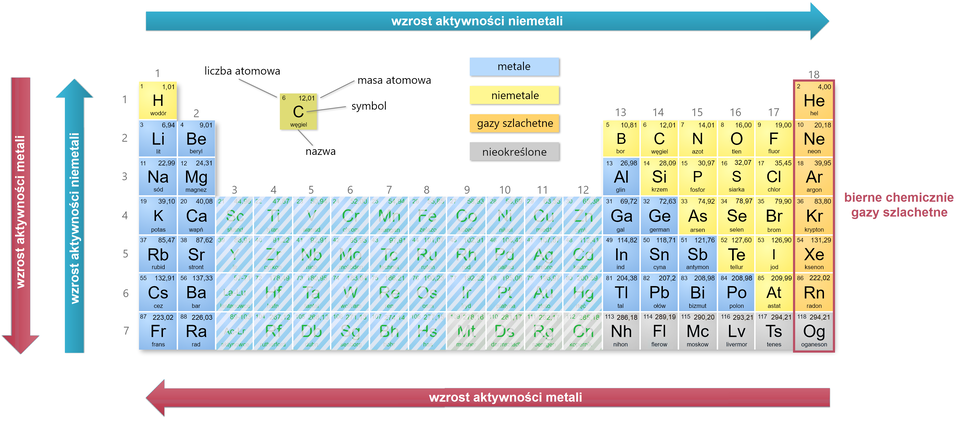
Tak jak pierwiastki z jednej grupy mają podobne właściwości, tak pierwiastki należące do jednego okresu już takich podobieństw nie wykazują. W okresach następuje zmiana charakteru pierwiastków – od aktywnych metali ( i grupy) poprzez aktywne niemetale do biernych chemicznie helowców (gazów szlachetnych).
Na poniższej grafice przedstawiono porównanie rozmiarów atomów wybranych pierwiastków chemicznych. Przeanalizuj załączony schemat i odpowiedz na pytanie, w jaki sposób zmieniają się rozmiary atomów w grupach i okresach wraz ze wzrostem liczby atomowej.

Poruszając się w dół, w obrębie tej samej grupy układu okresowego, a więc przechodząc do kolejnych okresów, liczba powłok elektronowych w atomach pierwiastków chemicznych rośnie. To z kolei rzutuje na coraz większe rozmiary atomów tych pierwiastków. Można więc stwierdzić, że dla analizowanych w poleceniu nr pierwiastków chemicznych, promień atomu rośnie w grupie wraz ze wzrostem liczby atomowej.
Poruszając się od lewej do prawej strony układu okresowego, w obrębie tego samego okresu, a więc przechodząc do kolejnych grup, liczba powłok elektronowych w atomach pierwiastków chemicznych nie ulaga zmianie. Zwiększa się jednak liczba atomowa, a więc ładunek jądra atomu (liczba zawartych w nim protonów), co skutkuje silniejszym przyciąganiem elektronów i zmniejszaniem się rozmiarów atomów. Można zatem stwierdzić, że dla analizowanych w poleceniu nr pierwiastków chemicznych, promień atomu maleje w okresie wraz ze wzrostem liczby atomowej.
Dokładny wpływ rozmiarów atomów (długości ich promieni atomowych) na aktywność pierwiastków chemicznych poznasz na dalszych etapach edukacji.
Podsumowanie
Numer okresu w układzie okresowym, do którego należy dany pierwiastek chemiczny, odpowiada liczbie powłok elektronowych w jego atomach.
Liczba elektronów walencyjnych w atomach pierwiastków, które należą do grup od pierwszego do układu okresowego, jest równa numerowi grupy.
Liczbę elektronów walencyjnych w atomach pierwiastków chemicznych grup otrzymuje się po odjęciu liczby od numeru grupy.
Pierwiastki chemiczne z tej samej grupy układu okresowego wykazują podobne właściwości (np. podobnie zachowują się wobec wody).
Pierwiastki chemiczne, przypisane do jednego okresu układu okresowego, nie mają jednakowych właściwości.
Dla grup pierwszej i drugiej oraz od do aktywność metali rośnie w grupach układu okresowego wraz ze wzrostem liczby atomowej, a z kolei w okresach maleje wraz ze wzrostem liczby atomowej.
Aktywność niemetali maleje w grupach układu okresowego wraz ze wzrostem liczby atomowej, z kolei w okresach rośnie wraz ze wzrostem liczby atomowej (z wyłączeniem niemetali należących do helowców).
Promień atomu pierwiastków chemicznych rośnie w danej grupie układu okresowego wraz ze wzrostem liczby atomowej, a w okresie maleje wraz ze wzrostem liczby atomowej.
W poniższej tabeli zestawiono wartości gęstości wybranych pierwiastków chemicznych, należących do pierwszej i grupy układu okresowego. Przeanalizuj zawarte dane i na ich podstawie podaj ogólną zależność pomiędzy gęstością a liczbą atomową dla pierwiastków chemicznych, które należą do tej samej grupy układu okresowego.
Lp. | Symbol pierwiastka | Gęstość |
|---|---|---|
1 | ||
2 | ||
3 | ||
4 | ||
5 | ||
6 | ||
7 | ||
9 |
Słownik
zestawienie w postaci tabeli wszystkich pierwiastków chemicznych, uporządkowanych wg ich rosnącej liczby atomowej (Z); pionowe kolumny w tabeli to grupy, a poziome wiersze to okresy
rozmieszczenie elektronów należących do atomu danego pierwiastka chemicznego na poszczególnych powłokach elektronowych (a także podpowłokach)
zbiór elektronów w atomie danego pierwiastka chemicznego, charakteryzujących się zbliżonymi wartościami energii
właściwości substancji, które objawiają się w zachowaniu wobec innych substancji; należą do nich m.in. aktywność chemiczna, palność
w tym materiale – zdolność pierwiastków chemicznych do wejścia w reakcję (przemianę) chemiczną z innymi substancjami (związkami chemicznymi lub pierwiastkami chemicznymi)
Ćwiczenia
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
jednakową liczbę elektronów walencyjnych w atomach, różne właściwości, elektronów walencyjnych, powłok elektronowych, podobne właściwości, neutronów, powłok elektronowych, różne właściwości, protonów, elektronów walencyjnych, masową, atomową, podobne właściwości, jednakową liczbę powłok w atomach
Na podstawie numeru grupy, do której należy pierwiastek, można określić liczbę ............................................................................................................ w jego atomach. Wszystkie pierwiastki znajdujące się w tym samym okresie mają w swoich atomach jednakową liczbę ............................................................................................................. Pierwiastki należące do tej samej grupy mają ............................................................................................................, zaś pierwiastki w jednym okresie mają .............................................................................................................
Określi liczbę powłok elektronowych w atomach następujących pierwiastków:
a. miedzi,
b. węgla,
c. magnezu.
Rozwiązując zadanie skorzystaj z układu okresowego pierwiastków.
7, 3, 5, 1, 4, 2, 2, 6, 4, 3
miedź – ............
węgiel – ............
magnez – ............
Podaj liczbę elektronów walencyjnych w atomach następujących pierwiastków:
a. wapnia,
b. fosforu,
c. kryptonu.
Rozwiązując zadanie skorzystaj z układu okresowego pierwiastków.
2, 6, 3, 8, 8, 5, 5, 1, 7, 2, 4
wapń – ............
fosfor – ............
krypton – ............
Pogrupuj podane pierwiastki według liczby powłok elektronowych w ich atomach.
złoto, cynk, chlor, sód, glin, brom, bar, potas, rtęć
| liczba powłok = 3 | |
|---|---|
| liczba powłok = 4 | |
| liczba powłok = 6 |
Wskaż grupy pierwiastków, które mają podobne właściwości (tworzą podobny typ związków chemicznych z innymi pierwiastkami).
- lit, sód, potas
- wodór i hel
- lit, beryl, azot
- azot i fosfor
- bor, węgiel, azot, tlen
W pewnym laboratorium chemicznym przeprowadzono doświadczenie chemiczne, zobrazowane na schemacie.

Poniżej zapisano odnotowane w trakcie wykonywania doświadczenia obserwacje. Do podanych obserwacji dopasuj numery zlewek, których dotyczą. Następnie sformułuj wniosek, w którym porównasz aktywność metali użytych w doświadczeniu.
Przeprowadzono doświadczenie chemiczne, w którym do trzech zlewek z wodą wprowadzono po próbce jednego z metali – magnezu, wapnia oraz strontu. Zanotowano następujące obserwacje.
Obserwacje w zlewce, do której wprowadzono magnez: Początkowo brak zmian świadczących o przebiegu reakcji chemicznej. Po ogrzaniu, metal roztwarza się i wydziela się bezbarwny, bezwonny gaz.
Obserwacje w zlewce, do której wprowadzono stront: Metal roztwarza się. Wydziela się bezbarwny, bezwonny gaz. Intensywność wydzielania się gazu jest większa niż w przypadku pozostałych dwóch metali.
Obserwacje w zlewce, do której wprowadzono wapń: Metal roztwarza się. Wydziela się bezbarwny, bezwonny gaz. Intensywność wydzielania się gazu można opisać jako „średnią”.
Porównaj długości promieni atomów pierwiastków chemicznych () w podanych poniżej parach. W puste miejsca wybierz odpowiedni znaki: , ; lub .
luka do uzupełnienia
luka do uzupełnienia
luka do uzupełnienia
Uzupełnij poniższy tekst tak, aby poprawnie opisywał budowę atomów magnezu oraz baru
Bibliografia
Encyklopedia PWN
Gulińska H., Smolińska J., Ciekawa chemia, cz. 1, Warszawa 2009.
Kaznowski K., Pazdro K. M., Chemia. Podręcznik do liceów i techników, cz. 1, Warszawa 2019.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1. Chemia ogólna i nieorganiczna. Zakres rozszerzony, Warszawa 2012.