Czy atomy mają masę?
Jak duże są atomy pierwiastków i jaka jest ich masa? Jak możemy wyrażać masę atomów pierwiastków?
Znane są rozmiary i masy atomów. Średnice atomów to wielkości rzędu miliardowej części metra (), a ich masy stanowią niewyobrażalnie małą część grama
(). Atomy, które należą do innych pierwiastków, różnią się pod względem masy i wielkości.
Najlżejszy z nich, atom wodoru, ma masę około
( ), a jego promień wynosi
( ).
Najcięższy z istniejących na Ziemi atomów – atom uranu – ma masę
( ), a jego promień równa się
( ).
W codziennej pracy chemik rzadko wykorzystuje wiedzę dotyczącą wielkości atomów, natomiast częściej bierze pod uwagę ich masę. W tym wypadku posługiwanie się wielkościami, które mają małe wartości, jest bardzo niewygodne. Dokonywanie operacji matematycznych na tak małych liczbach może prowadzić do pomyłki i otrzymania niewłaściwego wyniku. Dlatego chemicy w opisie masy atomów posługują się wielkością zwaną atomową jednostką masy lub unitem, co oznaczają symbolem u. Wartość tej jednostki wynosi
().
Masa atomu pierwiastka, którą wyrazimy za pomocą wspomnianej jednostki, nazywa się masą atomową.
Masa atomowa wodoru wynosi około , co oznacza, że rzeczywista masa atomu wodoru jest równa liczbowo jednemu unitowi, czyli
().

Film dostępny pod adresem /preview/resource/RLBOsyX3B8R1e
Film prezentuje proces obliczania masy atomowej helu, na podstawie masy podanej w gramach. Film nie posiada lektora oraz napisów. Slajd Napis - treść zadania: Wyraź masę atomu helu w atomowych jednostkach masy, jeśli masa atomu helu wyrażona w gramach wynosi:Slajd Po lewej stronie jest zielony kwadrat z symbolem helu na środku. W lewym dolnym rogu symbolu zapisana jest liczba atomowa . W prawym górnym rogu kwadratu jest zapisana liczba masowa wynosząca . W prawej części slajdu jest rozwiązanie zadania. Napis: To wiemy: <math aria‑label="jeden unit">
Oblicz, ile wynosi masa atomu kobaltu, wyrażona w atomowych jednostkach masy, jeżeli masa atomu kobaltu w gramach wynosi ?
w unitach) – zadanie

Film dostępny pod adresem /preview/resource/R1BABjP6rpArM
w unitach) – zadanie
Nagranie prezentujące proces obliczania masy atomów węgla w gramach, na podstawie masy atomowej. Film nie posiada lektora oraz napisów. Slajd Oblicz, jaka jest masa (jednego) atomu węgla wyrażona w gramach, jeśli jego masa atomowa wynosi 12 u. Slajd Po lewej stronie jest symbol węgla – . W lewym dolnym rogu jest liczba atomowa , natomiast w górnym rogu jest liczba masowa o wartości . Po prawej stronie zapis: To wiemy: 1 u równa się Slajd Masa atomowa węgla równa się 12 u. Slajd Aby obliczyć masę atomu węgla wyrażoną w gramach, należy jego masę atomową <math aria‑label="dwanaście unitów">
Oblicz, ile wynosi masa atomu wapnia, wyrażona w gramach, jeżeli masa atomu wapnia w atomowych jednostkach masy wynosi .
Masę cząstek subatomowych można także wyrazić w atomowych jednostkach masy. Okazuje się, że masy protonu i neutronu są równe około . Masa elektronu jest znacznie mniejsza od masy protonu i neutronu.
Nazwa | Symbol | Ładunek | Masa [u] |
|---|---|---|---|
elektron | () | -1 | |
proton | () | 1 | 1 |
neutron | () | 0 | 1 |
Należy wyraźnie podkreślić, że mimo bardzo małych rozmiarów jądra w stosunku do całego atomu, jest ono bardzo ciężkie. Skupia aż masy całego atomu.
Jakie masy mają izotopy?
Atomy poszczególnych pierwiastków chemicznych oraz wchodzące w ich skład cząstki mają niewyobrażalnie małe rozmiary. Aby podać w miarę dokładną masę atomu (lub budującej go cząstki) w gramach lub kilogramach, musielibyśmy użyć bardzo dużej ilości cyfr. Przykładowo, wyrażona w gramach masa protonu byłaby równa ok.: (lub w notacji wykładniczej: ). Przyznaj, że używanie takich liczb jest nieco kłopotliwe. Dlatego też do wyrażania mas indywiduów chemicznych (np. atomów, cząsteczek, jonów czy też cząstek, które wchodzą w ich skład) wykorzystujemy odpowiednio dobrane atomowe jednostki masyatomowe jednostki masy. Jednostki te oznaczane są w skrócie literą “u” (z ang. unit = jednostka).
W poniższej tabeli zamieszczono masy cząstek budujących atomy, wyrażone w atomowych jednostkach masy.
Nazwa cząstki | Symbol | Masa cząstki - wyrażona w atomowych jednostkach masy [u] |
|---|---|---|
elektron | e (eIndeks górny --) | |
proton | p (pIndeks górny ++) | ok. 1 |
neutron | n (nIndeks górny 00) | 1 |
Z uwagi na ogromne różnice między masą elektronu a masą nukleonów (protonu i neutronu), można stwierdzić, że o masie atomu decyduje przede wszystkim liczba obecnych w nim protonów i neutronów, a więc prawie cała masa atomu jest skupiona w jego jądrze.
Masy protonu i neutronu są w przybliżeniu takie same i wynoszą ok. 1 u (czyt. jeden unit lub jedną jednostkę masy atomowej). Z wystarczającą w naszych szkolnych obliczeniach dokładnością można zatem uznać, że masa danego izotopu, wyrażona w unitach (jednostkach masy atomowej), jest liczbowo równa sumie liczb protonów i neutronów w jądrze atomowym tego izotopu. Innymi słowy — liczba masowa danego izotopu jest liczbowo równa jego masie atomowej wyrażonej w atomowych jednostkach masy [u].
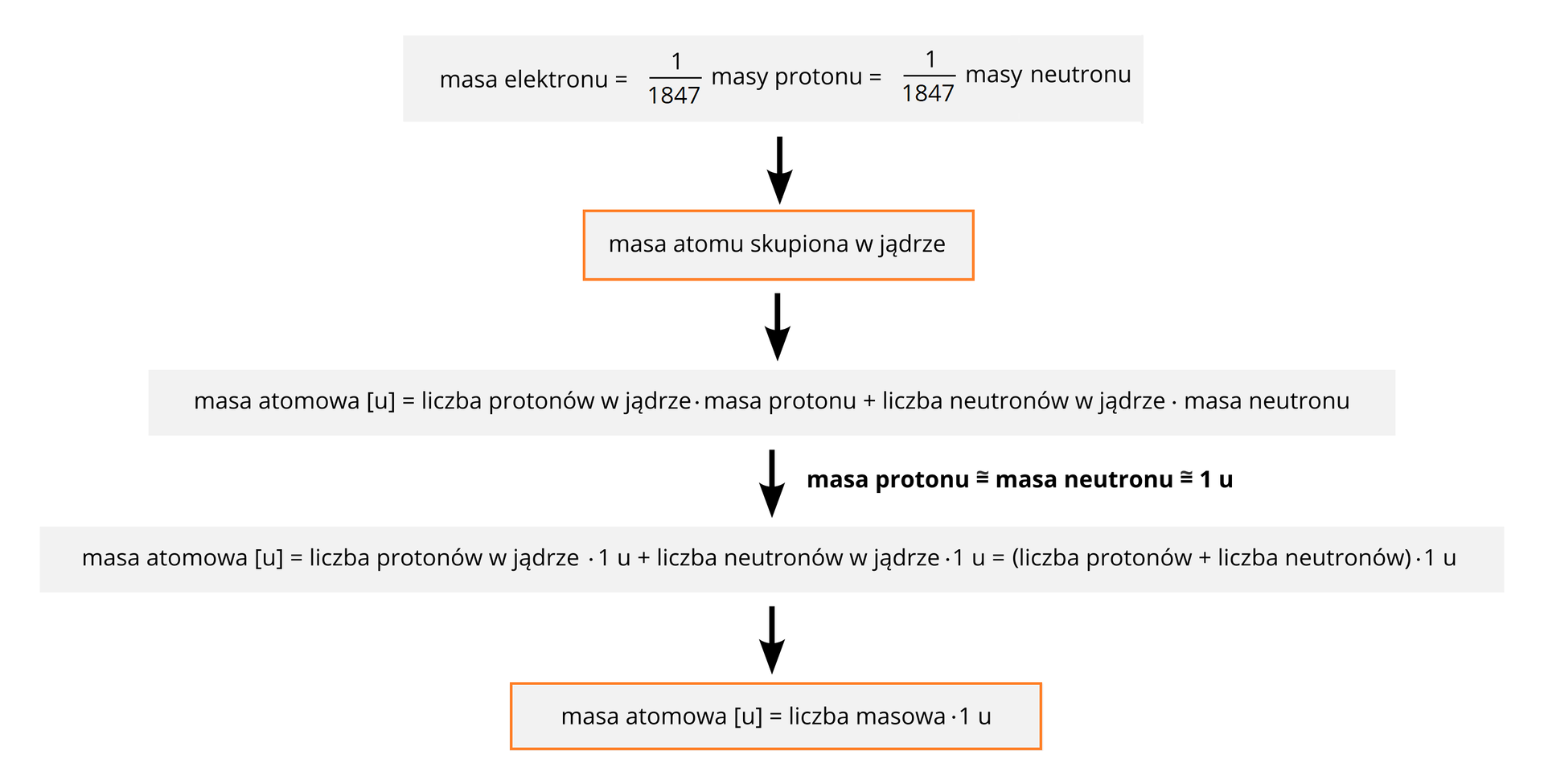
Korzystając z powyższych informacji, łatwo można obliczyć, że masa atomowa protu wynosi ok. 1 u, deuteru — ok. 2 u, natomiast trytu — ok. 3 u.
Średnia masa atomowa pierwiastków
Zwróć uwagę, że masa atomowa zapisana w układzie okresowym ma wartość ułamkową. Dla pierwiastków chemicznych, które występują w przyrodzie w postaci mieszaniny izotopów, masa atomowa podana w układzie okresowym jest bowiem średnią, obliczoną na podstawie mas i zawartości procentowych poszczególnych naturalnie występujących izotopów danego pierwiastka (tzw. abundancji). Jest to tzw. średnia ważona. Przy jej obliczaniu bierzemy pod uwagę fakt, że każdy izotop ma swój udział w masie atomowej danego pierwiastka.
Analogicznie jest w przypadku próby określenia średniej masy ciała uczniów w klasie na podstawie informacji, że 5% z nich waży 40 kg, następne 15% ma masę 60 kg, a pozostali, czyli 80% uczniów, ważą po 50 kg. Wówczas średnia masa wszystkich uczniów wynosiłaby 51 kg.
Wynik to 51 kg, mimo że nikt z uczniów nie ma takiej masy ciała.
Tak samo jest z pierwiastkami chemicznymi – do obliczania średnich mas atomowychśrednich mas atomowych pierwiastków można posłużyć się następującym wzorem:
lub używając skrótów:
gdzie:
– masy poszczególnych izotopów pierwiastka, [u];
– zawartości procentowe poszczególnych izotopów pierwiastka, [%].
Naturalnie występujący wodór jest mieszaniną dwóch izotopów – protu i deuteru – których zawartość procentowa wynosi kolejno 99,985% i 0,015%. Oblicz średnią masę atomową wodoru. Wynik podaj w jednostkach masy atomowej (unitach), z dokładnością do drugiego miejsca po przecinku.
Wyznacz średnią masę atomową potasu wiedząc, że jest mieszaniną trzech naturalnie występujących izotopów o liczbach masowych 39, 40 i 41. Zawartość procentowa tych izotopów wynosi kolejno: 93,2581%, 0,0117% i 6,7302%. Wynik podaj w jednostkach masy atomowej (unitach), z dokładnością do drugiego miejsca po przecinku.
Jeśli odszukasz (np. w tablicach chemicznych) dokładne masy poszczególnych izotopów danego pierwiastka chemicznego, to prawdopodobnie okaże się, że nie są one liczbami całkowitymi. Z naszych rozważań wynikałoby, że masa izotopu powinna być równa liczbowo sumie liczby zawartych w nim protonów i neutronów. Jest to jednak tylko pewne przybliżenie. Po pierwsze (jak już wspomnieliśmy) 1 u to przybliżona masa jednego protonu lub jednego neutronu. Poza tym faktyczna masa izotopu jest mniejsza niż suma mas zawartych w nich nukleonów. Deficyt (ubytek) masy związany jest z energią niezbędną do utworzenia jądra atomowego z cząstek. W myśl wzoru Alberta Einsteina masa i energia są równoważne. W uproszczeniu możemy powiedzieć, że podczas tworzenia się jądra atomowego, część masy nukleonów, które wchodzą w jego skład, zostaje przetworzona na energię, niezbędną do utrzymania tego jądra.
