Czym jest chmura elektronowa?
Czy elektrony w atomie mogą poruszać się w dowolnej przestrzeni wokół jądra? Czy natura dopuszcza możliwość zderzenia się elektronów w atomie?
Czy elektrony w atomie poruszają się w dowolnym miejscu w przestrzeni wokół jądra?
Elektrony poruszają się wokół jądra atomowego, niektóre elektrony znajdują się bliżej, a inne dalej od niego. Oznacza to, że zajmują określone pozycje – poziomy energetyczne. Jednak w porównaniu do planet, nie jesteśmy w stanie określić jednocześnie ich dokładnego położenia i pędu. Elektrony podlegają prawom mechaniki kwantowej (działu fizyki teoretycznej), podczas gdy my na co dzień obserwujemy następstwa fizyki klasycznej. W tym materiale dowiesz się, jakie poziomy energetyczne zajmują elektrony, krążąc wokół jądra atomowego, i w jaki sposób zapisujemy je dla różnych atomów pierwiastka chemicznego.
Przestrzeń w atomie zajmowana przez elektrony jest ogromna w stosunku do objętości, jaką zajmuje jądro atomowe. Co nie oznacza jednak, że każdy z elektronów porusza się swobodnie w każdym punkcie tej przestrzeni. Okazuje się, że elektrony poruszają się tylko w ograniczonych obszarach, które zostały nazwane powłokami elektronowymi. W ich obrębie elektrony poruszają się z dużą szybkością i we wszystkich kierunkach. Liczba powłok elektronowych w atomach jest różna i uzależniona od liczby elektronów. Największe znane nam atomy mają siedem powłok, a najmniejsze – jedną.
Elektrony, które poruszają się na różnych powłokach, mają inną energię. Im bliżej jądra atomowego znajduje się elektron, tym jest ona niższa. I przeciwnie – im dalej od jądra atomowego znajduje się elektron, tym jego energia jest wyższa.
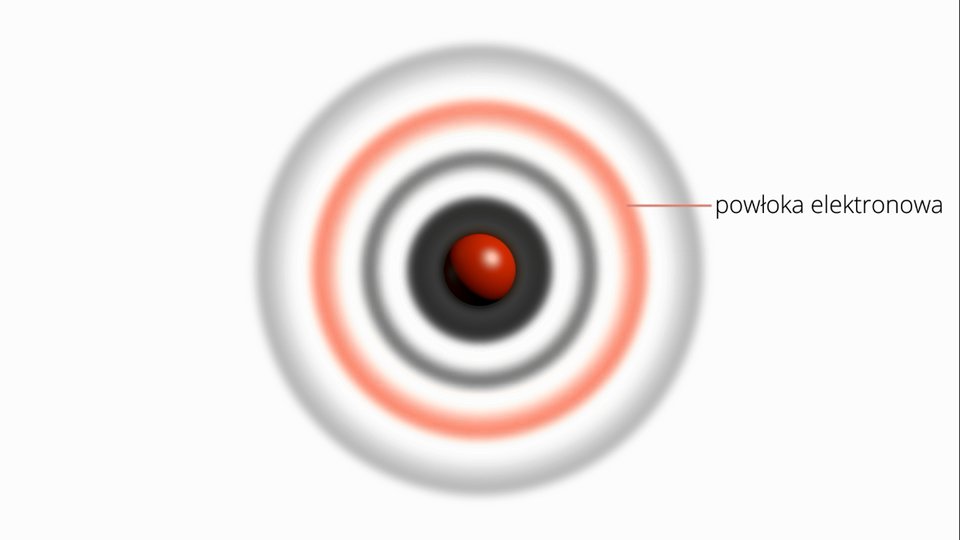
Film dostępny pod adresem /preview/resource/RT4TRyjEFok0m
Na filmie ukazano budowę atomu, rozmieszczenie powłok elektronowych w atomie oraz porównanie energii elektronów występujących na poszczególnych powłokach.
Powłoki elektronowe nie mają fizycznego odzwierciedlenia w budowie atomu. To przede wszystkim energia danego elektronu oraz obecność pozostałych elektronów decydują, w jakim obszarze wokół jądra będzie się on poruszał. W przestrzeni wokół jądra nie ma żadnych fizycznych barier, które utrzymywałyby elektron na określonej powłoce.
Ile elektronów może znajdować się na powłokach?
Powłokom elektronowym w atomie nadano symbole literowe, zgodnie z alfabetem, od K do Q. Powłoka najbliżej jądra (pierwsza) oznaczona jest literą K. Następne to: L, M, N, O, P, Q.
Kolejność powłok (odległość od jądra) | pierwsza | druga | trzecia | czwarta | piąta | szósta | siódma |
|---|---|---|---|---|---|---|---|
Symbol powłoki | K | L | M | N | O | P | Q |
Na każdej z nich może znajdować się określona liczba elektronów. Na przykład na pierwszej powłoce mogą przebywać tylko dwa elektrony, a na trzeciej aż osiemnaście. Im dalej od jądra atomu znajduje się powłoka, tym więcej elektronów może pomieścić. Maksymalną liczbę elektronów, jaka może znajdować się na powłoce, opisuje wzór:
w którym n oznacza numer powłoki.
dla n=5, maks. liczba elektronów to
Numer powłoki (n) | |||||||
|---|---|---|---|---|---|---|---|
Symbol powłoki elektronowej | K | L | M | N | O | P | Q |
Maksymalna liczba elektronów na powłoce () |
Przypisz symbole powłok oraz maks. liczbę elektronów w obrębie danej powłoki.
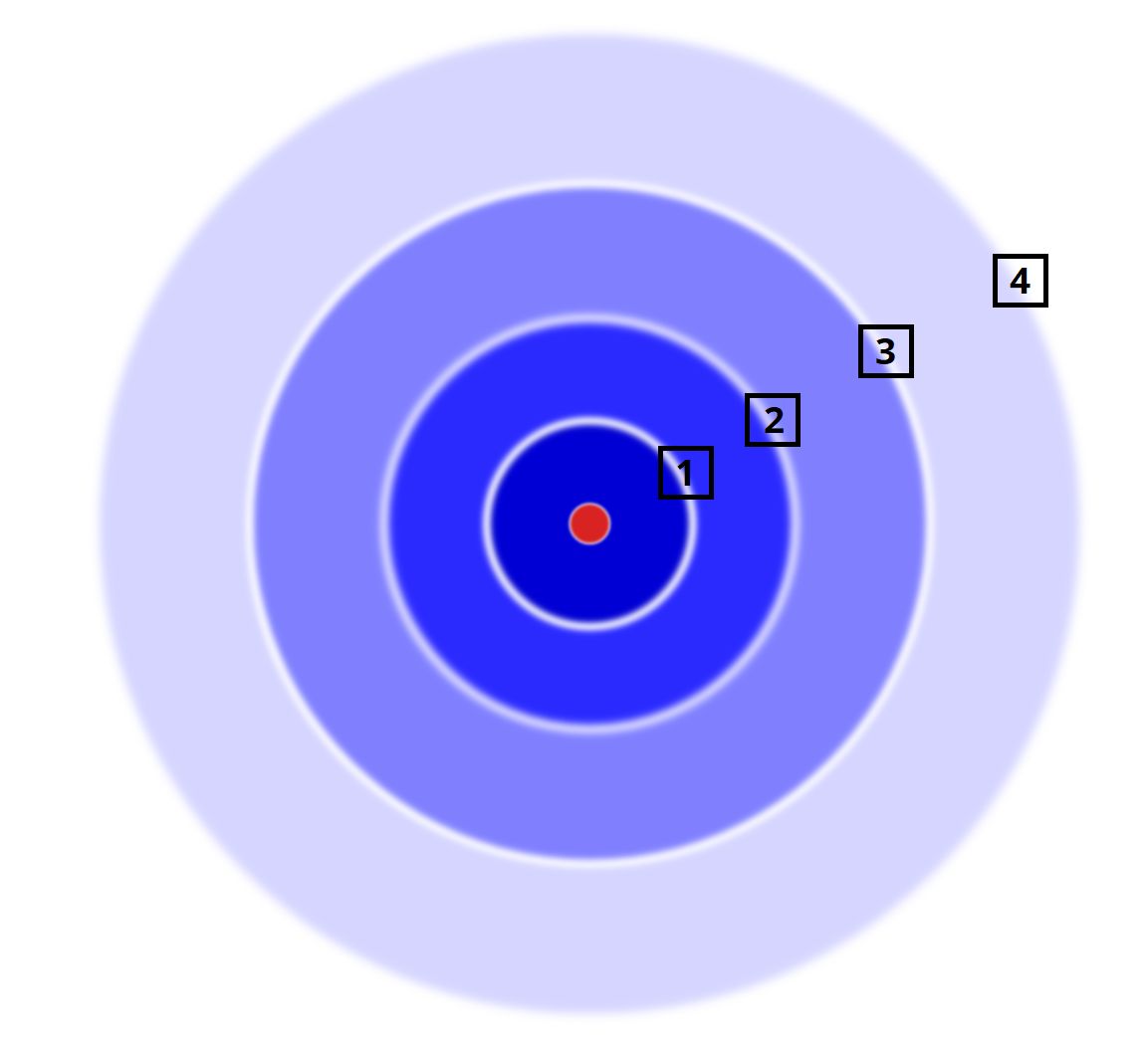
Zapisz maks. liczbę elektronów, jaka może znajdować się na podanych powłokach.
Jak rozmieszczone są elektrony w atomie?
Rozmieszczenie elektronów na poszczególnych powłokach nazywa się konfiguracją elektronowąkonfiguracją elektronową. Jej zapis poznamy na przykładach. Przedstawienie konfiguracji elektronowej atomu rozpoczniemy od atomu helu, który ma dwa elektrony. Mogą one przebywać na pierwszej powłoce K. Tę informację możemy zaprezentować na kilka sposobów, więc przedstawiono je w tabeli .
Sposób prezentacji | Konfiguracja elektronowa | Ogólne zasady zapisu |
|---|---|---|
zapis z użyciem nawiasów kwadratowych | W nawiasie kwadratowym wymieniamy kolejno liczby elektronów, które znajdują się na powłokach: pierwszej, drugiej i kolejnych. Liczby te oddzielamy przecinkami. | |
zapis z użyciem symboli powłok | KIndeks górny 22 | Podajemy symbole zajętych przez elektrony powłok. Z prawej strony każdego symbolu, w indeksie górnym, zapisujemy liczbę elektronów, które znajdują się na powłoce. |
zapis w postaci schematu | 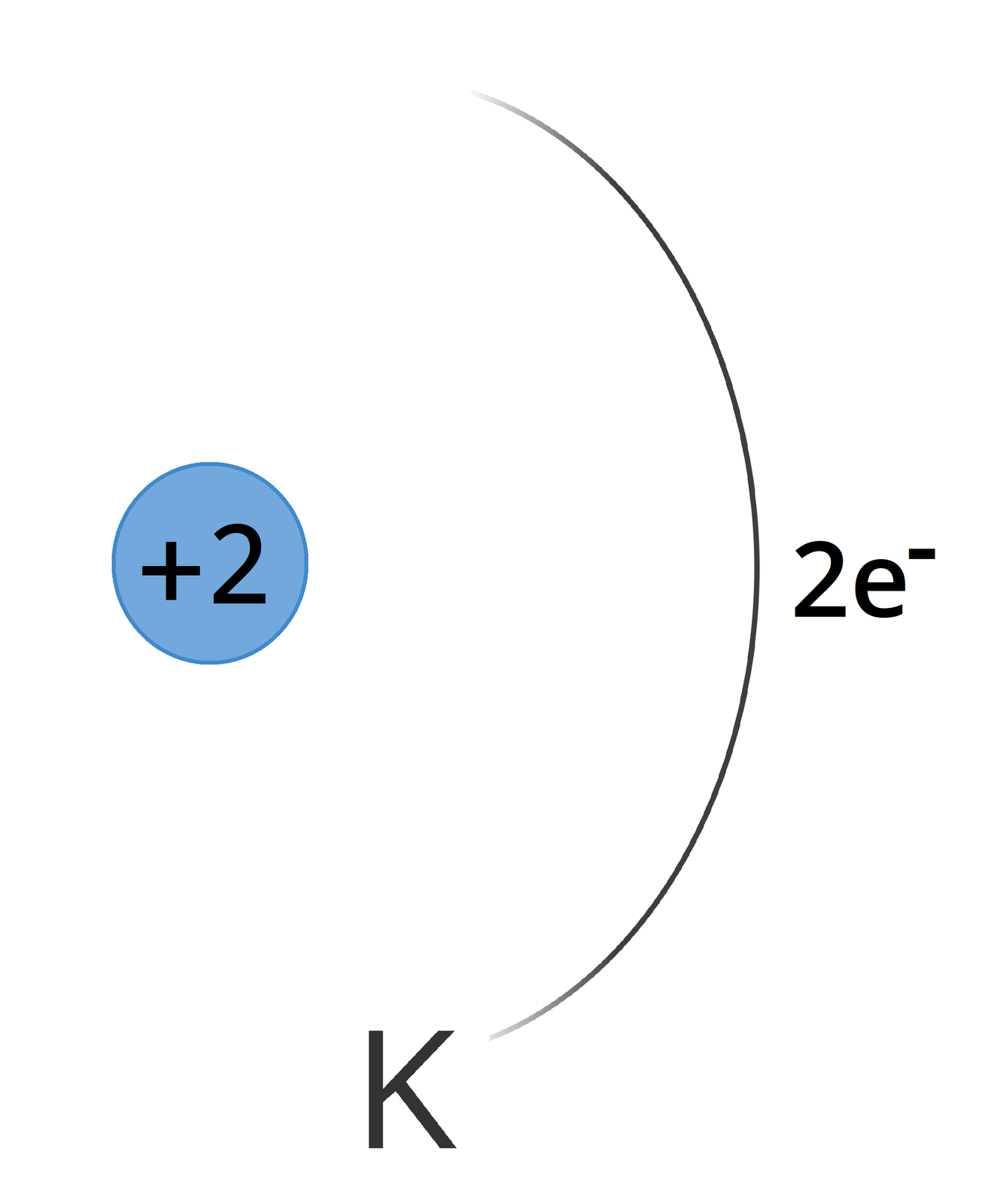 Hel Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | Na schemacie modelu atomu zaznaczamy ładunek jądra równy liczbie protonów. Rysujemy powłoki elektronowe jako półokręgi, podpisujemy je ich symbolami. Następnie zaznaczamy ilość elektronów na poszczególnych powłokach. |
Dokończ poniższe zdanie, wybierając słowo spośród podanych.
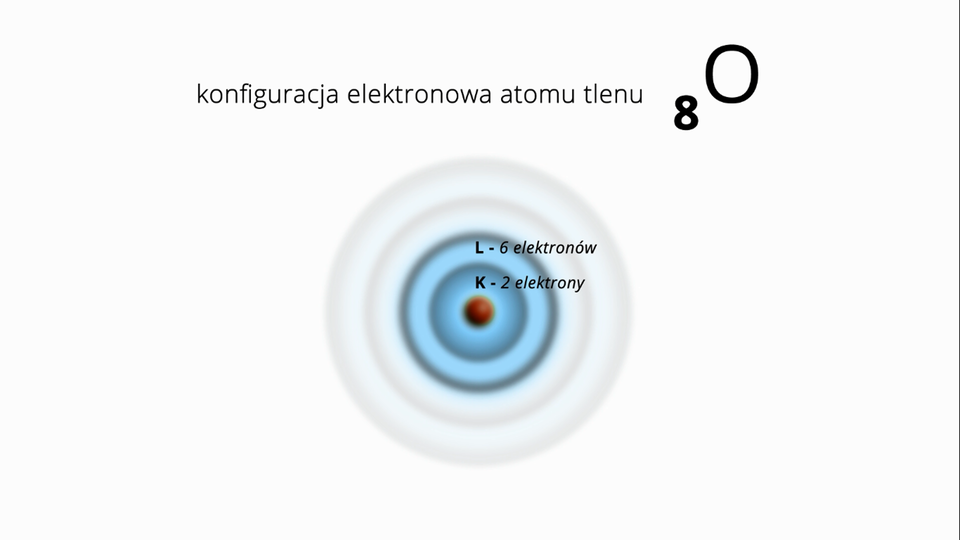
Film dostępny pod adresem /preview/resource/R1WUFq7WebK3L
Na filmie określono liczbę elektronów w atomie tlenu oraz ukazano rozmieszczenie elektronów na poszczególnych powłokach. Konfigurację tę przedstawiono także przy użyciu symboli powłok oraz wykorzystując zapis w kwadratowych nawiasach.
Konfiguracja elektronowa atomu krzemu
Zapis z użyciem nawiasów kwadratowych:
Zapis z użyciem symboli powłok:
K Indeks górny 22L Indeks górny 88M Indeks górny 44
Zapis w postaci schematu:
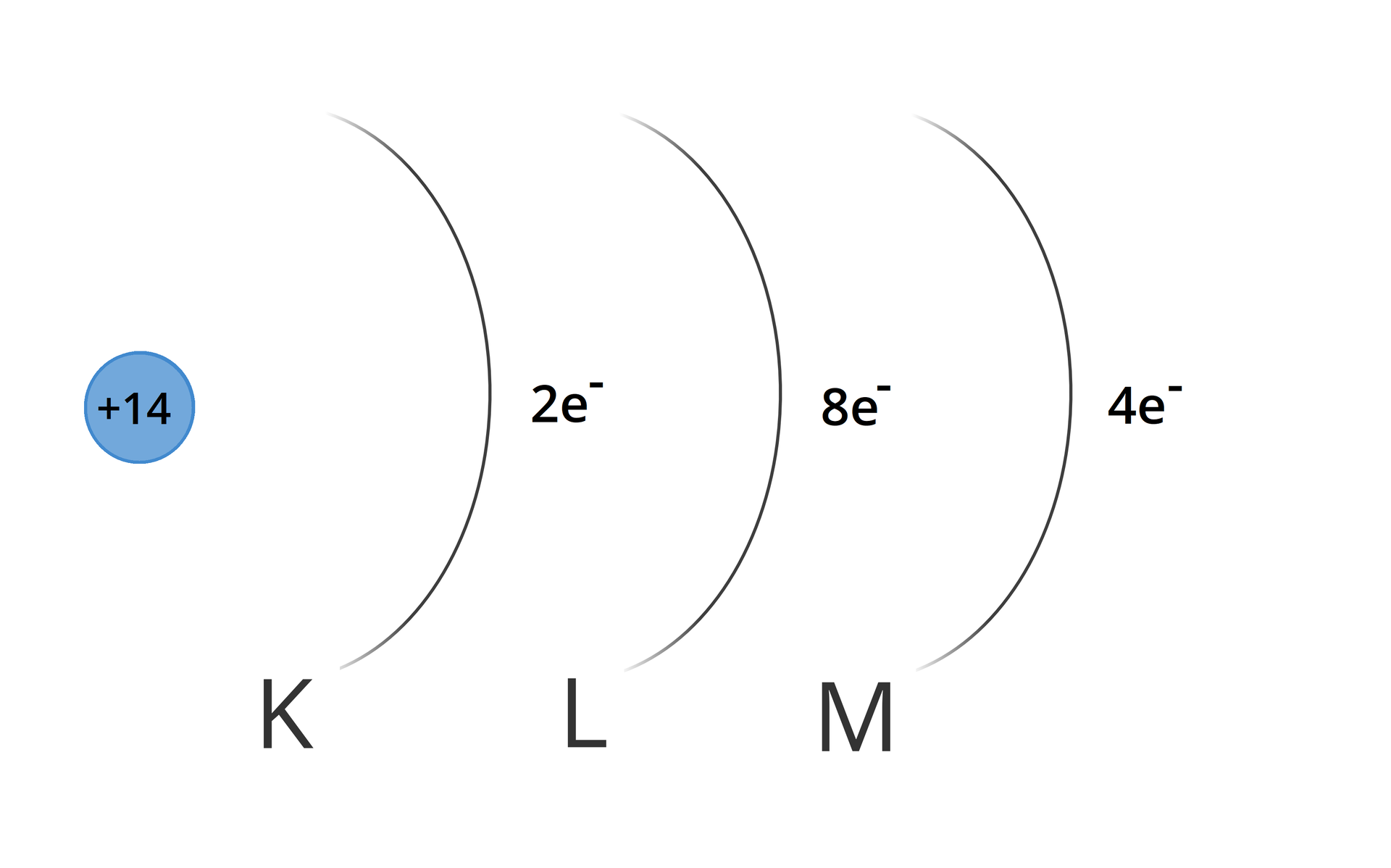
Zapełnienie powłok (L) i (M) następuje, gdy niższa powłoka zostanie zapełniona maksymalną liczbą elektronów. W przypadku atomów o liczbie atomowej większej niż reguła ta zazwyczaj nie obowiązuje. Choć na powłoce trzeciej może znaleźć się maksymalnie elektronów, to obsadzenie czwartej powłoki następuje często zanim powłoka trzecia całkowicie się wypełni. Zjawisko to obrazują prawidłowo zapisane konfiguracje elektronowe, m. in. następujących atomów pierwiastków chemicznych:
Dopasuj symbol pierwiastka do jego konfiguracji elektronowej, zapisanej w postaci schematu.
Dopasuj symbol pierwiastka do jego konfiguracji elektronowej, zapisanej z użyciem symboli powłok.
1. Si, 2. He, 3. O, 4. Ar, 5. Cl, 6. Zn, 7. H, 8. K
1. Si, 2. He, 3. O, 4. Ar, 5. Cl, 6. Zn, 7. H, 8. K
1. Si, 2. He, 3. O, 4. Ar, 5. Cl, 6. Zn, 7. H, 8. K
Czy elektrony ostatniej powłoki są ważne?
Elektrony, które znajdują się najdalej od jądra atomowego, są najsłabiej przez to jądro przyciągane i często oddziałują na elektrony innych atomów. Można o nich w przenośni powiedzieć, że reprezentują atom na zewnątrz. Decydują o właściwościach atomu i nazywane są elektronami walencyjnymi, a powłoka, na której się znajdują, to powłoka walencyjna.Pozostałe elektrony nazywane są elektronami rdzenia atomowego.
Atomy mogą mieć różną liczbę elektronów walencyjnych (od jednego do dwunastu). Dla pierwiastków chemicznych z grup od pierwszej do , liczba elektronów walencyjnych jest równa numerowi grupy. Ale dla pierwiastków chemicznych grup od do , liczbę elektronów walencyjnych oblicza się, odejmując od numeru grupy liczbę (wyjątek stanowi hel, który posiada dwa elektrony walencyjne).
Na przykład sód znajduje się w pierwszej grupie układu okresowego, więc liczba jego elektronów wynosi . Natomiast selen znajduje się w . grupie układu okresowego, więc liczba jego elektronów wynosi . Czasami, w przypadku większych atomów, rolę elektronów walencyjnych – oprócz elektronów ostatniej powłoki – pełnią równocześnie niektóre elektrony przedostatniej powłoki.
Film dostępny pod adresem /preview/resource/R1XoOjzizzTGD
Na filmie wyjaśniono, w jaki sposób odległość elektronów od jądra wpływa na siłę z jaką są one przez nie przyciągane. Przedstawiono również rolę elektronów walencyjnych, a także omówiono ich położenie oraz ilość w atomach helu i tlenu.
Uzupełnij poniższą tabelę, wpisując liczby elektronów walencyjnych dla poszczególnych pierwiastków.
W poniższej tabeli przedstawiono opisy różnych atomów.
Numer atomu | ||||
|---|---|---|---|---|
Opis atomu | atom sodu zawierający w jądrze atomowym protonów | liczba masowa atomu = |
Podsumowanie
Elektrony w atomie poruszają się w ściśle określonej przestrzeni wokół jądra
(w obszarach zwanych powłokami elektronowymi).Każda powłoka może pomieścić ograniczoną liczbę elektronów (, n – numer powłoki).
Liczba powłok elektronowych jest równa numerowi okresu, w którym znajduje się dany pierwiastek.
Rozmieszczenie elektronów w atomie nazywa się konfiguracją elektronową.
Elektrony najdalej oddalone od jądra nazywamy elektronami walencyjnymi – zazwyczaj zajmują one ostatnią powłokę (zwaną wtedy powłoką walencyjną), ale czasami mogą zajmować częściowo również przedostatnią powłokę.
Dla pierwiastków chemicznych znajdujących się w grupach od do , liczba elektronów walencyjnych jest równa numerowi grupy. Dla pierwiastków chemicznych grup od do , liczbę elektronów walencyjnych oblicza się, odejmując od numeru grupy liczbę (wyjątek stanowi hel, który posiada dwa elektrony walencyjne).
Słownik
elektrony poruszające się w zewnętrznej (często położonej najdalej od jądra atomowego; ostatniej) powłoce elektronowej w atomie
rozmieszczenie elektronów w atomie
powłoka, na której znajdują się elektrony walencyjne, często ostatnia (najbardziej zewnętrzna) powłoka elektronowa w atomie