Monitorowanie poziomu zanieczyszczeń środowiska (powietrza, wód i gleb)
CHM.05. Ocena stanu środowiska, planowanie i realizacja zadań w ochronie środowiska - Technik ochrony środowiska 325511
Dobór odczynników chemicznych niezbędnych do badań laboratoryjnych procesów zachodzących w środowisku
SYMULATOR
Zapoznaj się z kolejnością prac związanych z badaniem stanu środowiska, zasadami poboru próbek do badań laboratoryjnych oraz przebiegiem procesu zachodzącego w środowisku.
Spis treści
1. Oznaczanie jonów chlorkowych w próbce wody metodą Mohra1. Oznaczanie jonów chlorkowych w próbce wody metodą Mohra
2. Symulator2. Symulator
3. Ćwiczenia sprawdzające3. Ćwiczenia sprawdzające
- Zadanie 1- Zadanie 1
- Zadanie 2- Zadanie 2
1. Oznaczanie jonów chlorkowych w próbce wody metodą Mohra.
Metoda Mohra, zwana również miareczkowaniem bezpośrednim, wykorzystywana jest do oznaczania jonów chlorkowych w próbkach wody.
Polega ona na analizie roztworu zawierającego jony chlorkowe poprzez stopniowe dodawanie do niego roztworu azotanu (V) srebra (I). Wskaźnikiem używanym w tej metodzie jest chromian (VI) potasu.
W trakcie miareczkowania roztwór azotanu (V) srebra (I) jest stopniowo dodawany, co powoduje wytrącanie się jonów chlorkowych w postaci słabo rozpuszczalnego białego osadu chlorku srebra (I).
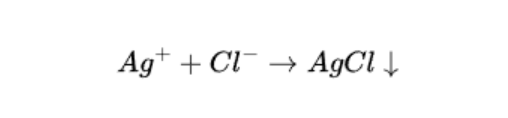
Gdy wszystkie jony chlorkowe zostaną już wytrącone, dodanie jednej kropli nadmiaru azotanu (V) srebra (I) powoduje zmianę koloru osadu z białego na czerwonobrunatny. Nowo powstałym osadem jest chromian (VI) srebra (I). Zmiana barwy zawiesiny na czerwonobrunatną wskazuje na koniec miareczkowania jonów chlorkowych, moment ten nazywamy punktem końcowym miareczkowania.
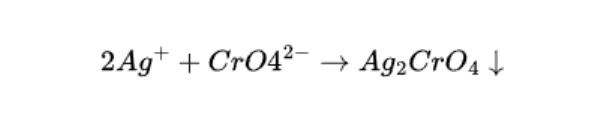
Powrót do spisu treściPowrót do spisu treści
2. Symulator
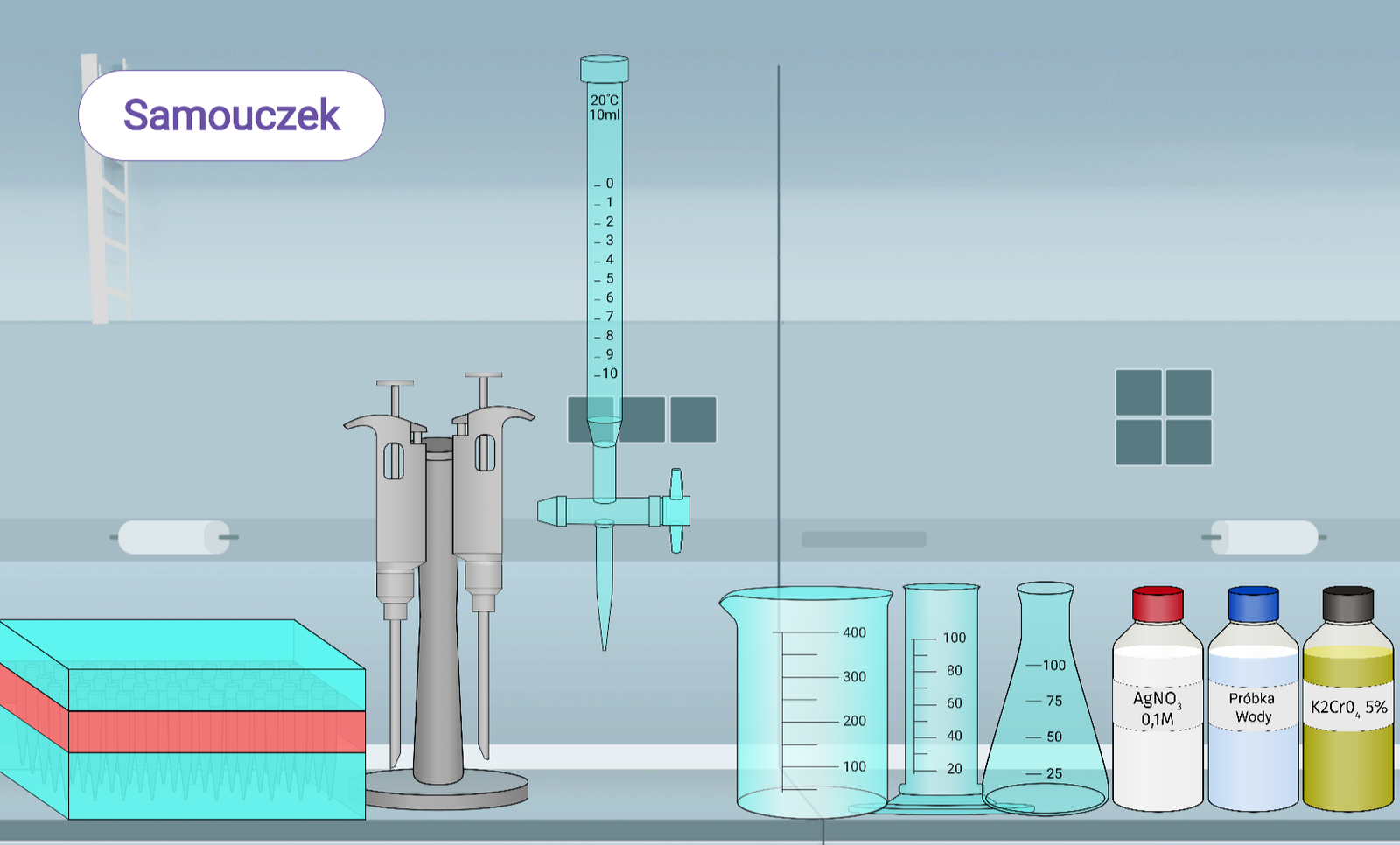
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D19vXFHIK
Pod biuretą ustawiono szklaną zlewkę o pojemności 400 ml.
Wypełniono biuretę 0,1 molowym roztworem AgNOIndeks dolny 33 znajdującym się w szklanym pojemniku z czerwoną nakrętką.
Używając kranika, spuszczono nadmiar roztworu, tak aby dolny menisk cieczy zrównał się z kreską opisaną jako “0”.
Za pomocą cylindra miarowego odmierzono 100 ml próbki wody znajdującej się w szklanym pojemniku z niebieską nakrętką, a następnie przelano ją do kolby stożkowej.
Do roztworu wodnego w kolbie stożkowej dodano 2 ml 5% roztworu chromianu ( ) potasu, który znajduje się w szklanym pojemniku z brązową nakrętką. Aby dokładnie odmierzyć objętość odczynnika, skorzystano z pipety automatycznej.
Odstawiono zlewkę spod biurety. Kolbę stożkową z próbką wody umieszczono pod biuretą. Rozpoczęto miareczkowanie, stopniowo spuszczając krople titranta za pomocą kranika. Ważne by pamiętać o mieszaniu roztworu!
W roztworze powinien wydzielić się biały osad. Kontynuowano miareczkowanie, aż do momentu zmiany barwy osadu z białej na czerwonobrunatną.
Z biurety odczytano ile mililitrów AgNO3 zużyto do zmiareczkowania jonów chlorkowych: 8 ml.
Powrót do spisu treściPowrót do spisu treści
3. Ćwiczenia sprawdzające
Zadanie 1. Na podstawie poniższego wzoru oblicz masę jonów chlorkowych w próbce wody, która została poddana miareczkowaniu. Przyjmij, że masa molowa jonów chlorkowych wynosi 35,45 g/mol. Wynik podaj w miligramach i zaokrąglij do 4 cyfr znaczących.
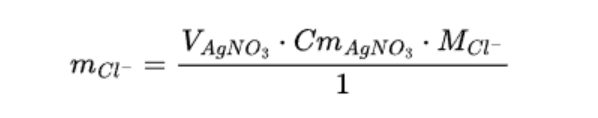
mIndeks dolny Cl-Cl-: masa jonów chlorkowych w próbce wody [g],
VIndeks dolny AgNO3AgNO3: objętość titranta zużytego do zmiareczkowania próbki [dmIndeks górny 33],
CmIndeks dolny AgNO3AgNO3: stężenie molowe titranta [mol/dmIndeks górny 33],
MIndeks dolny Cl-Cl-: masa molowa jonów chlorkowych [g/mol].
Powrót do spisu treściPowrót do spisu treści
Zadanie 2. Wiedząc, że dopuszczalna zawartość jonów chlorkowych w wodzie przeznaczonej do spożycia wynosi 250 mg/dmIndeks górny 33 wody, ustal, czy badany roztwór woda spełnia wymogi wody pitnej i udziel odpowiedzi wraz z krótkim uzasadnieniem.
Powrót do spisu treściPowrót do spisu treści