Gazy szlachetne
Słońce, nowy, leniwy, skryty, obcy – to polskie tłumaczenia greckich nazw pierwiastków chemicznych (kolejno: helu, neonu, argonu, kryptonu oraz ksenonu). Te wraz z radonem nazywane są często gazami szlachetnymigazami szlachetnymi. W czym przejawia się ich szlachetność? Co wspólnego mają te gazy z „neonami” reklamowymi? Odpowiedź na te pytania znajdziesz w poniższym materiale.

symbole pierwiastków chemicznych i sposób posługiwania się nimi;
pojęcie i budowę atomu;
sposób odczytywania informacji z układu okresowego;
zależność pomiędzy budową atomu pierwiastka a jego położeniem w układzie okresowym;
sposób dzielenia izotopów ze względu na ich trwałość;
definicje: izotop promieniotwórczy, pierwiastek promieniotwórczy, promieniotwórczość.
wskazywać położenie gazów szlachetnych w układzie okresowym pierwiastków;
wymieniać nazwy oraz symbole pierwiastków chemicznych, które należą do grupy gazów szlachetnych;
opisywać budowę atomów poszczególnych gazów szlachetnych;
projektować i przeprowadzać doświadczenie, które pozwoli na zbadanie wybranych właściwości fizykochemicznych helu;
opisywać wybrane właściwości gazów szlachetnych;
wskazywać przykłady zastosowania gazów szlachetnych w najbliższym otoczeniu.
1. Gazy szlachetne – występowanie w przyrodzie
Jeśli przypomnisz sobie, że głównymi składnikami powietrza są azot oraz tlen, to okaże się, że stanowią one łącznie objętości powietrza (azot stanowi około , a tlen około ). Jakie więc gazy zawarte są w tym jednym procencie objętości powietrza? Aby odpowiedzieć na to pytanie, przeanalizuj dane zawarte na poniższej grafice.

We wspomnianym jednym procencie objętości powietrza znajdują się między innymi gazy szlachetne. Do tych występujących w powietrzu należą: argonargon, helhel, neonneon, kryptonkrypton oraz ksenonksenon. Dokładne zawartości wymienionych gazów w powietrzu zamieszczono w poniższej tabeli.
Nazwa gazu szlachetnego | Zawartość procentowa w powietrzu ( objętości) |
|---|---|
argon | |
neon | |
hel | |
krypton | |
ksenon |
Indeks górny Na podstawie: Orlińska I., Orliński K., Na krańcu układu – gazy szlachetne [w:] Chemia w szkole, Warszawa 2018 (nr 3), s. 10. Indeks górny koniecNa podstawie: Orlińska I., Orliński K., Na krańcu układu – gazy szlachetne [w:] Chemia w szkole, Warszawa 2018 (nr 3), s. 10.
W powietrzu może być również zawarty radon, jednak jego stężenie w środowisku naturalnym jest tak niskie, że trudno go wykryć metodami chemicznymi. Zależy to między innymi od miejsca pomiaru. Najwięcej można go na ogół odnotować w okolicy kopalń, a najmniej nad oceanami.
Wykorzystując dane zamieszczone w powyższej tabeli, oblicz objętość każdego z wymienionych w niej gazów szlachetnych, zawartych w pomieszczeniu o wymiarach . Wyniki podaj w , z dokładnością do pierwszego miejsca po przecinku (nie zaokrąglaj wyników cząstkowych). Załóż, że pomiarów dokonano w temperaturze pokojowej, pod ciśnieniem normalnym.
Pierwszy z gazów szlachetnych został odkryty w na Słońcu, niezależnie przez dwóch astronomów. Byli nimi Francuz Pierre Janssen (czyt. pier jensen) i Anglik Norman Lockyer (czyt. norman lokje). Nowo odkrytemu pierwiastkowi nadano nazwę hel, od greckiego Helios, czyli „Słońce”. W został otrzymany w laboratorium przez brytyjskiego chemika i fizyka Williama Ramsay’a (czyt. łiljama ramzeja).
Rok wcześniej, ten sam naukowiec, wraz z lordem Rayleighem (czyt. rejlejem), wyodrębnił z powietrza i zidentyfikował kolejny z gazów. Ponieważ gaz był oporny na działanie stosowanych przez uczonych związków chemicznych, nadali mu nazwę argon, od greckiego argos, co znaczy „leniwy”.
Lord Rayleigh i sir Ramsey otrzymali za swoje prace dwie Nagrody Nobla w – w dziedzinie chemii oraz w dziedzinie fizyki.
W Ramsay wraz z innym brytyjskim chemikiem Morrisem Traversem (czyt. morisem trawersem) odkryli trzy kolejne gazy szlachetne – neon, którego nazwa pochodzi od greckiego neos, co oznacza „nowy”, krypton, nazwany od greckiego kryptos, czyli „skryty” (ponieważ „ukrywał się” w skroplonym powietrzu) i ksenon, od greckiego ksenos – „obcy”.
W niemiecki fizyk Friedrich Dorn (czyt. fridriś dorn), odkrył radon – pierwiastek promieniotwórczy.
Na osi czasu przedstawiono daty oraz uczonych, którzy odkryli poszczególne gazy szlachetne lub chociażby przyczynili się do tego.
Rok – odkrycie helu przez Pierre'a Janssena. Był to francuski astronom, który wówczas (niezależnie od Normana Lockyera) zaobserwował na Słońcu nowy pierwiastek – hel. Na slajdzie ukazano portret Pierre'a Janssena – starszego, łysiejącego mężczyzny o białych włosach, brwiach, wąsach oraz brodzie i surowym spojrzeniu. Jest on ubrany w czarny płacz zapięty na dwa guziki. Ręką, opartą na leżącej na stole książce, podpiera głowę.
Rok – odkrycie helu przez Normana Lockyera. Był on angielskim naukowcem i astronomem. We wskazanym roku (niezależnie od Pierre’a Janssena) także zaobserwował na Słońcu nowy pierwiastek, którym podobnie był hel. Na slajdzie ukazano zdjęcie Normana Lockyera – starszego mężczyzny o białych, zaczesanych na lewo włosach, siwych wąsach i brodzie. Ubrany jest w białą koszulę, ciemny krawat i szary, zapięty płaszcz. Na nosie ma okulary, a dłonie opiera na drewnianej lasce.
Rok – odkrycie argonu przez Johna Williama Strutta (lorda Rayleigh). Był to brytyjski fizyk, który w został laureatem Nagrody Nobla z fizyki za badanie gęstości gazów i odkrycie argonu, czego dokonał właśnie w Na slajdzie ukazano zdjęcie Johna Williama Strutta – starszego, silnie łysiejącego mężczyzny o białych włosach i gęstych, białych wąsach. Ubrany jest w białą koszulę, czarną muchę i czarną marynarkę, na którą nałożono czarny płaszcz.
Rok – otrzymanie helu w laboratorium przez Williama Ramsaya. Był to brytyjski chemik i fizyk, a także laureat Nagrody Nobla z chemii w W , wraz z lordem Rayleighem, wyodrębnił z powietrza argon. Rok potem otrzymał w laboratorium hel. Na slajdzie ukazano zdjęcie Williama Ramsaya – starszego mężczyzny o podłużnej twarzy, krótkich, czarnych włosach oraz siwiejących wąsach i brodzie. Ubrany jest w białą koszulę, czarny krawat i marynarkę.
Rok – odkrycie neonu, kryptonu i argonu w powietrzu przez Johna William Strutta (lorda Rayleigha). Wraz z Morrisem Traversem odkrył w powietrzu neon, krypton oraz ksenon. Na slajdzie ukazano zdjęcie Morrisa Traversa – mężczyzny o krótkich, czarnych włosach z okularami na nosie. Ubrany jest w białą koszulę, czarny krawat i jasną marynarkę.
Rok – odkrycie radonu przez Friedricha Ernsta Dorna. Był on niemieckim fizykiem. We wskazanym roku odkrył radon – pierwiastek chemiczny, którego najtrwalszy izotop powstaje na skutek rozpadów promieniotwórczych radu. Na slajdzie ukazano zdjęcie Friedricha Dorna – starszego mężczyzny o białych włosach i gęstych, siwiejących wąsach. Ubrany jest w białą koszulę, czarną muchę i marynarkę.
Prawdziwym bogactwem niemal pozbawionego atmosfery Księżyca jest hel-
(), wysokoenergetyczny izotop helu, wędrujący ze Słońca w postaci wiatru słonecznego. Gaz jest zatrzymywany przez naszą atmosferę, dlatego prawie nie występuje na Ziemi. Jego zasoby szacuje się na tysiące ton na Księżycu i około na Ziemi.
Wstępnie obliczono, że do zasilania Warszawy w energię elektryczną, w wyniku fuzji jądrowej, przez cały rok wystarczyłoby helu-.

2. Gazy szlachetne jako pierwiastki chemiczne
Gazy szlachetne to pierwiastki chemiczne położone w grupie układu okresowego. Należą do niemetali (choć często w legendach, umieszczanych obok układów okresowych, wymienia się je osobno).
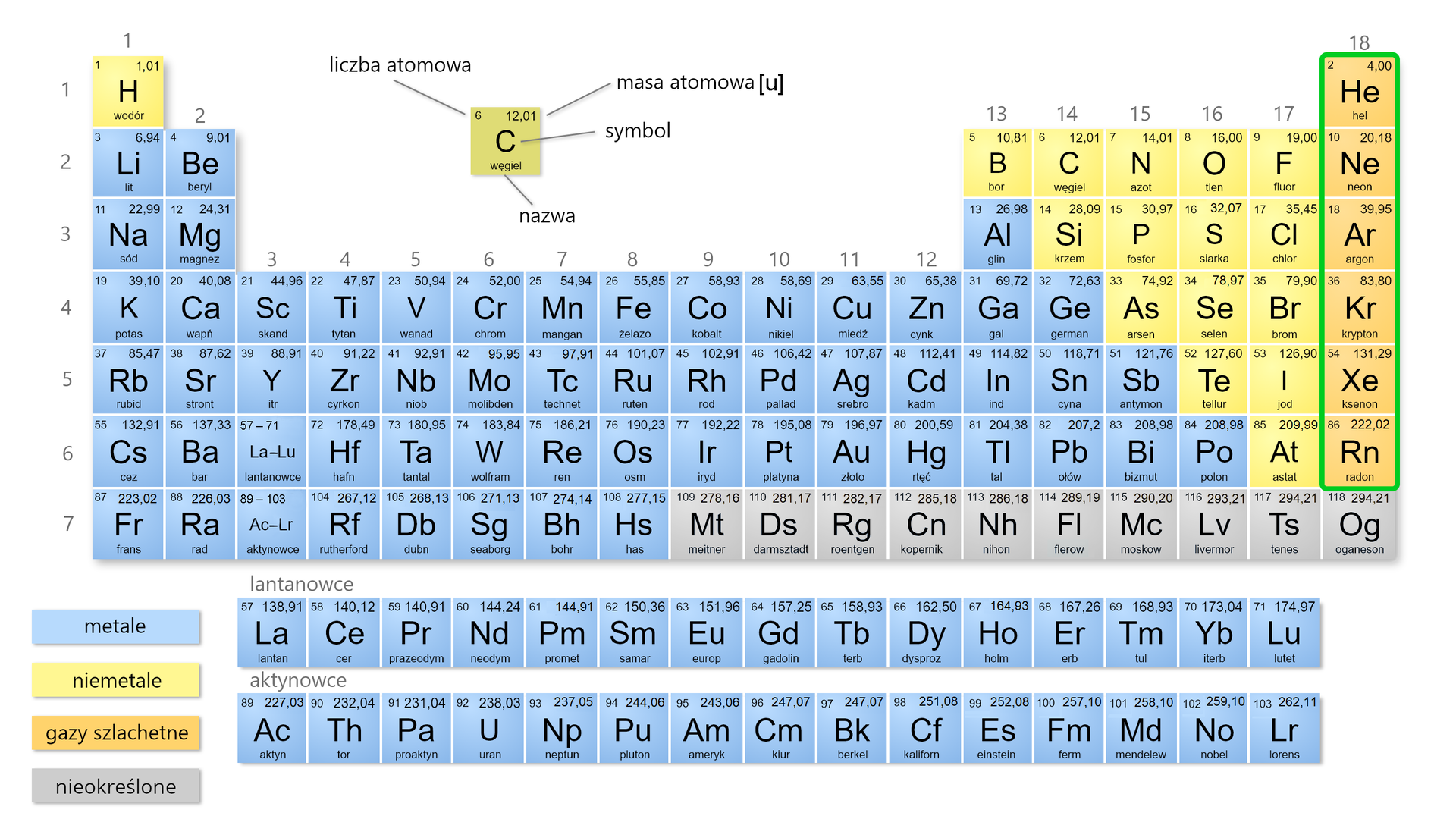
Ponieważ nazwy grup w układzie okresowym tworzymy od nazw rozpoczynających je pierwiastków chemicznych (z wyjątkiem grupy pierwszej), gazy szlachetne często nazywamy również helowcami.
Zwróć uwagę, że do gazów szlachetnych należy również radonradon. Nie jest on jednak naturalnym składnikiem powietrza. Jest to pierwiastek promieniotwórczy (nie mający trwałych izotopów), który stanowi końcowy produkt rozpadów promieniotwórczych złóż uranu i toru.
W grupie układu okresowego znajduje się również pierwiastek chemiczny o nazwie oganeson. Został po raz pierwszy otrzymany w , w wyniku odpowiednich przemian jądrowych. Atomy oganesonu są bardzo niestabilne, dlatego trudno jest zbadać właściwości fizykochemiczne tego pierwiastka. Przewiduje się jednak, że w warunkach normalnych (, ) pierwiastek ten byłby prawdopodobnie ciałem stałym.
W poniższej tabeli zamieszczono konfiguracje elektronowe atomów czterech gazów szlachetnych o najmniejszych liczbach atomowych, z wyszczególnionymi elektronami walencyjnymi.
Nazwa pierwiastka | Konfiguracja elektronowa atomu – zapis powłokowy | Konfiguracja elektronowa atomu – zapis podpowłokowy |
|---|---|---|
hel | ||
neon | ||
argon | ||
krypton |
Okazuje się, że konfiguracja elektronowa atomów gazów szlachetnych jest bardzo trwała (stabilna) energetycznie. Głównie dlatego gazy szlachetne (w przeciwieństwie do innych pierwiastków występujących w przyrodzie w stanie gazowym) nie tworzą cząsteczek – występują naturalnie w formie atomowej.
Przyjrzyj się zamieszczonemu poniżej graficznemu zapisowi konfiguracji elektronowej elektronów walencyjnych gazów szlachetnych.

Zwróć uwagę, że wszystkie elektrony walencyjne w atomach analizowanych helowców są sparowane – na każdym poziomie orbitalnym (w jednej klatce) znajdują się dwa elektrony. Taka sama sytuacja ma miejsce w atomach ksenonu oraz radonu.
To między innymi brak niesparowanych elektronów walencyjnych utrudnia atomom gazów szlachetnych tworzenie cząsteczek.
3. Otrzymywanie i wybrane właściwości fizykochemiczne gazów szlachetnych
Neon, argon, krypton oraz ksenon pozyskuje się na skalę przemysłową w wyniku tak zwanej destylacjidestylacji frakcjonowanej ciekłego (skroplonego) powietrza. Hel pozyskiwany jest ze złóż gazu ziemnego. Z kolei radon produkuje się w niewielkich ilościach (rzędu centymetrów sześciennych rocznie) ze złóż radu.
Problem badawczy:
Jakie właściwości fizykochemiczne ma hel?
Hipoteza:
Hel jest bezbarwnym, bezwonnym i niepalnym gazem, praktycznie nierozpuszczalnym w wodzie, o gęstości mniejszej od gęstości powietrza.
Co było potrzebne:
butla z gazowym helem;
woda destylowana;
butelka (najlepiej z długą wąską szyjką);
duża zlewka lub krystalizator;
łuczywo;
zapałki;
balonik.
Przebieg doświadczenia:
Balonik napełniono ostrożnie helem, zawiązano i wypuszczono. Krystalizator napełniono do wysokości wodą destylowaną, a do butelki odwróconej do góry dnem nabrano helu z butli. Do butelki, trzymanej cały czas do góry dnem, wprowadzono zapalone łuczywo. Następnie umieszczono ją wylotem do dołu w krystalizatorze z wodą destylowaną i pozostawiono na kilkanaście minut.
Obserwacje:
Analizowany gaz jest bezbarwny i bezwonny. Wypełniony tym gazem balonik unosi się w powietrzu. Po wprowadzeniu zapalonego łuczywa do butelki wypełnionej badanym gazem, zaobserwowano, że płomień zgasł. Po zakończeniu doświadczenia, nie odnotowano obecności wody wewnątrz butelki.
Wnioski:
Hel jest gazem bezbarwnym i bezwonnym. Ponieważ napełniony nim balon się unosi, można wnioskować, że ma gęstość mniejszą od gęstości powietrza. Wprowadzone do butelki z helem zapalone łuczywo gaśnie, co oznacza, że jest gazem niepalnym i nie podtrzymującym spalania. Ponieważ po zakończeniu doświadczenia nie odnotowano obecności wody w butelce, można wnioskować, że jest bardzo słabo rozpuszczalny w wodzie.
Podobne właściwości fizykochemiczne do tych, które udało się zbadać w doświadczeniu dla helu, wykazują pozostałe gazy szlachetne. Wszystkie helowce (wyłączając oganeson, o którym nie ma wystarczających danych) to w warunkach normalnych bezbarwne, bezwonne, praktycznie nierozpuszczalne w wodzie gazy. Są niepalne i nie podtrzymują spalania.
Gazy szlachetne odznaczają się zróżnicowaną gęstością. Na poniższym wykresie zilustrowano gęstości wybranych gazów szlachetnych oraz gęstość powietrza, w temperaturze , pod ciśnieniem . Przeanalizuj dane zawarte na wspomnianym wykresie, a następnie wykonaj polecenie .
Na podstawie: Mizerski W., Tablice chemiczne, Warszawa 2004, s. 105.
Na kolumnowym wykresie interaktywnym przedstawiono gęstości wybranych gazów szlachetnych oraz gęstość powietrza w [] w temperaturze , pod ciśnieniem :
hel – ;
neon – ;
argon – ;
krypton – ;
ksenon – ;
powietrze – .
Gazy szlachetne charakteryzują się również zróżnicowanymi temperaturami wrzenia i topnienia. Wartości temperatur wrzenia i topnienia wybranych gazów szlachetnych, pod ciśnieniem , zamieszczono w poniższej tabeli.
Nazwa helowca | Temperatura wrzenia, | Temperatura topnienia, |
|---|---|---|
hel | nie ulega zestaleniu pod normalnym ciśnieniem | |
neon | ||
argon | ||
krypton | ||
ksenon |
Indeks górny Na podstawie: Mizerski W., Tablice chemiczne, Warszawa 2004, s. 105. Indeks górny koniecNa podstawie: Mizerski W., Tablice chemiczne, Warszawa 2004, s. 105.
Zamieszczone w powyższej tabeli dane przedstaw w formie wykresu słupkowego. Wskazane w tabeli helowce ułóż na wykresie zgodnie z malejącymi masami atomowymi. Temperatury wrzenia i topnienia gazów szlachetnych wyraź w kelwinach.
Zwróć uwagę, w jak niewielkim zakresie temperatur gazy szlachetne występują w ciekłym stanie skupienia.
Gazy szlachetne odznaczają się również inną ciekawą właściwością – w polu elektrycznym emitują światło o określonej barwie.

Jak już wspomniano, atomy helowców mają trwałą (stabilną) energetycznie konfigurację elektronową. Dlatego nie występują w postaci cząsteczek, lecz atomów. Mało tego – są bierne chemicznie wobec innych substancji chemicznych. To właśnie z chemicznej bierności helowców wywodzi się nazwa „gazy szlachetne”.
Być może zdarzyło Ci się słyszeć głos osoby, która „nawdychała” się helu. A może miałaś/miałeś okazję samodzielnie przeprowadzić taki eksperyment? Jeśli podczas wdechu napełnimy płuca helem, to nasz głos stanie się zabawnie wysoki. Jak to możliwe? Ze względu na bardzo niską gęstość helu, prędkość rozchodzenia się dźwięku w tym gazie jest trzykrotnie większa niż w powietrzu. Z kolei wysokość (ton) głosu zależy od tego, jak szybko poruszają się, a właściwie drgają, poszczególne części ośrodka mowy. Im szybciej rozchodzi się dźwięk, tym drgania są częstsze, a głos wyższy. Głos wraca do swojej naturalnej wysokości w momencie, kiedy z płuc zostanie usunięty cały hel.
Przeprowadzając eksperyment z wdychaniem helu, należy jednak zachować szczególną ostrożność. Po pierwsze należy zwrócić uwagę, czy wykorzystywany hel nie jest zanieczyszczony jakimś innym gazem. Po drugie, pod żadnym pozorem nie wolno „oddychać” helem (mogłoby to w najlepszym przypadku doprowadzić do utraty przytomności ze względu na niedotlenienie). Do przeprowadzenia eksperymentu wystarczy jeden wdech helu.
To, że gazy szlachetne są bierne chemicznie nie oznacza, że nie tworzą żadnych związków chemicznych z innymi pierwiastkami. Do tej pory udało się bowiem otrzymać związki chemiczne między innymi ksenonu, radonu i kryptonu. Należą do nich przede wszystkim związki o wzorach sumarycznych: , , , , , , , , oraz . Mogą one jednak istnieć jedynie w specjalnych warunkach ciśnienia i temperatury.
4. Zastosowanie gazów szlachetnych
Wybrane zastosowania gazów szlachetnych opisano pokrótce na poniższej mapie myśli. Zapoznaj się z nimi, a następnie wykonaj polecenie .
Jednym z zastosowań gazów szlachetnych jest wspomniane już na początku tego materiału wypełnianie neonów reklamowych. Nazwa „neony” może być jednak nieco myląca, ponieważ do wypełniania lamp neonowych (zwanych często neonówkami) wykorzystywany jest nie tylko neon, ale także pozostałe gazy szlachetne. Najczęściej takie lampy wypełnia się odpowiednio dobraną mieszaniną helowców, których skład zależy od barwy pożądanego światła.
Zmylić może również zastosowanie radonu, między innymi w tak zwanych kąpielach radonowych. Musisz pamiętać, że ten pierwiastek, przez wzgląd na swoje właściwości radioaktywne, traktowany jest jako substancja szkodliwa dla zdrowia. Długotrwałe przebywanie w miejscach, w których w powietrzu znajduje się radon (między innymi w kopalniach), zwiększa ryzyko zachorowania na raka płuc. Z drugiej jednak strony, w odpowiednim stężeniu, pod kontrolą specjalistów, można go wykorzystywać we wspomnianych zabiegach korzystnych dla zdrowia.
Podsumowanie
Gazy szlachetne to niemetale, położone w grupie układu okresowego.
Do gazów szlachetnych zaliczamy: hel, neon, argon, krypton, ksenon, radon.
Hel, neon, argon, krypton oraz ksenon to naturalne składniki powietrza. Radon jest pierwiastkiem promieniotwórczym.
W warunkach normalnych są to bezbarwne, bezwonne, pozbawione smaku gazy, które charakteryzują się bardzo niskimi temperaturami wrzenia i topnienia.
Gazy szlachetne wykazują najmniejszą aktywność chemiczną spośród wszystkich znanych pierwiastków. Właściwość ta jest związana z trwałością konfiguracji elektronowej ich atomów.
Gazy szlachetne (przez wzgląd na stabilną energetycznie konfigurację elektronową atomów) nie tworzą cząsteczek – występują w formie atomowej.
Gazy szlachetne znalazły szereg zastosowań, wśród których najbardziej znanym jest wykorzystanie ich w technice oświetleniowej.
W pewnym laboratorium chemicznym przeprowadzono doświadczenie, zilustrowane na poniższym schemacie.

Zastanów się i napisz, jakie obserwacje powinna odnotować osoba wykonująca to doświadczenie. Następnie ustal, jakie właściwości fizykochemiczne kryptonu można potwierdzić, wykonując analizowane doświadczenie.
Korzystając z dostępnych Ci materiałów, uzupełnij poniższy tekst odpowiednimi wyrażeniami, wybierając spośród podanych poniżej.
Słownik
inaczej helowce; niemetale położone w grupie układu okresowego (do gazów szlachetnych nie zalicza się oganesonu); w warunkach normalnych bezbarwne, bezwonne gazy, występujące w postaci atomów – w przeciwieństwie do innych gazowych pierwiastków chemicznych (między innymi azotu), nie tworzą cząsteczek; substancje bierne (mało aktywne) chemicznie
(Ar, gr. argos „leniwy”) pierwiastek chemiczny o największym rozpowszechnieniu na Ziemi spośród wszystkich gazów szlachetnych; jego zawartość w powietrzu wynosi około (procenty objętościowe); stosuje się go między innymi w procesach chemicznych wymagających obojętnego środowiska, np. podczas spawania, do wypełniania przestrzeni zespolonej w oknach oraz w mieszaninie do wypełniania żarówek razem z azotem
(He, gr. Helios „Słońce”) pierwiastek chemiczny z grupy helowców; gaz szlachetny; po wodorze drugi najbardziej rozpowszechniony pierwiastek chemiczny we wszechświecie; niepalny; stosuje się go między innymi do napełniania balonów, jako czynnik chłodzący w reaktorach jądrowych i nadprzewodnikach, a także składnik mieszaniny z tlenem w butlach tlenowych dla nurków
(Ne, gr. neos „nowy”) pierwiastek chemiczny z grupy helowców; gaz szlachetny; stosuje się go między innymi do produkcji lamp jarzeniowych (czerwona barwa), w laserach oraz jako chłodziwo urządzeń nadprzewodnikowych
(Xe, gr. ksenos „obcy”) pierwiastek chemiczny z grupy helowców; gaz szlachetny; stosuje się go między innymi jako wypełnienie żarówek halogenowych w reflektorach samochodowych oraz fotograficznych lamp błyskowych, a także w diagnostyce rentgenowskiej
(Kr, gr. kryptos „skryty”) pierwiastek chemiczny z grupy helowców; gaz szlachetny; stosuje się go między innymi w lampach jarzeniowych (po wzbudzeniu elektrycznym emituje białe światło), jako wypełnienie przestrzeni między szybami w oknach oraz w diagnostyce rentgenowskiej
(Rn) promieniotwórczy pierwiastek chemiczny z grupy helowców; gaz szlachetny; stosuje się go między innymi w medycynie do tak zwanych kąpieli radowych (leczenie chorób tarczycy i cukrzycy); w niekontrolowanych ilościach szkodliwy dla zdrowia (zwiększa ryzyko zachorowania na raka płuc)
(łac. destillatio „ściekanie kroplami”) metoda rozdziału mieszanin ciekłych, w której wykorzystuje się różnice w temperaturach wrzenia ich składników
Ćwiczenia
Do rozwiązania poniższych ćwiczeń potrzebny Ci będzie układ okresowy pierwiastków chemicznych. Skorzystaj z układu okresowego znajdującego się w tej lekcji.
• pierwiastek chemiczny będący gazem szlachetnym z okresu
• stosowany w lampach jarzeniowych, daje czerwoną barwę
• jest niepalny i nie podtrzymuje spalania, 2. MACIEJ
• pierwiastek chemiczny będący gazem szlachetnym
• stosowany w butlach tlenowych dla nurków
• tworzy liczne związki chemiczne, 3. MARTA
• pierwiastek chemiczny z grupy układu okresowego
• stosowany w technice oświetleniowej, między innymi w tak zwanych neonówkach
• atom neonu ma na ostatniej powłoce osiem elektronów walencyjnych, 4. LENA
• pierwiastek chemiczny z grupy helowców
• występuje w formie pojedynczych atomów
• stosowany w technice oświetleniowej
Uczeń przygotował cztery identyczne baloniki. Trzy z nich napełnił kolejno różnymi gazami: helem, neonem oraz tlenkiem węgla() (dwutlenkiem węgla). Czwarty z balonów napełnił powietrzem. Wszystkie puścił swobodnie.
Przeanalizuj dane zawarte w poniższej tabeli, a następnie zaznacz poprawną obserwację z przeprowadzonego przez ucznia doświadczenia.
Nazwa pierwiastka/związku chemicznego/mieszaniny | Gęstość [] w temperaturze , pod ciśnieniem |
hel | |
powietrze | |
neon | |
tlenek węgla() |
Indeks górny Na podstawie: Mizerski W., Tablice chemiczne, Warszawa 2004, s. 105 Indeks górny koniecNa podstawie: Mizerski W., Tablice chemiczne, Warszawa 2004, s. 105
liczba masowa: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11.
liczba nukleonów: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11.
liczba protonów: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11.
liczba elektronów: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11.
liczba neutronów: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11.
liczba powłok elektronowych: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11.
liczba elektronów walencyjnych: 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11.
The argon atom has 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. electrons, of which 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. are in the atomic core. The electrons in the argon atom move within 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. electron shells.
There are 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. protons in the nucleus of the krypton atom. There are 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. electrons in the electron cloud of a krypton atom. The electrons in the krypton atom move within 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. electron shells.
Bibliografia
Encyklopedia PWN.
Orlińska I., Orliński K., Na krańcu układu – gazy szlachetne, Chemia w szkole, 2018, nr 3, s. 6–15.
Szymońska J., Litwin M., Styka‑Wlazło Sz., To jest chemia 1. Chemia ogólna i nieorganiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2015.