Jak zmniejszyć straty wywołane korozją metali?
Jak zmniejszyć straty wywołane korozją metali?
1. Cele lekcji
a) Wiadomości
Uczeń zna:
pojęcia: korozja, protektor, inhibitor, pasywacja,
rodzaje korozji,
czynniki wpływające na szybkość korozji,
metody ochrony przed korozją.
b) Umiejętności
Uczeń potrafi:
omówić czynniki powodujące korozję chemiczną i elektrochemiczną,
określić wpływ różnych czynników na szybkość korozji,
wyjaśnić proces tworzenia rdzy,
zapisać równania reakcji zachodzące na powierzchni wyrobów stalowych pod wpływem wody i tlenu,
scharakteryzować bierne i aktywne metody ochrony przed korozją,
b) Postawy
Uczeń potrafi pracować w grupie.
2. Metoda i forma pracy
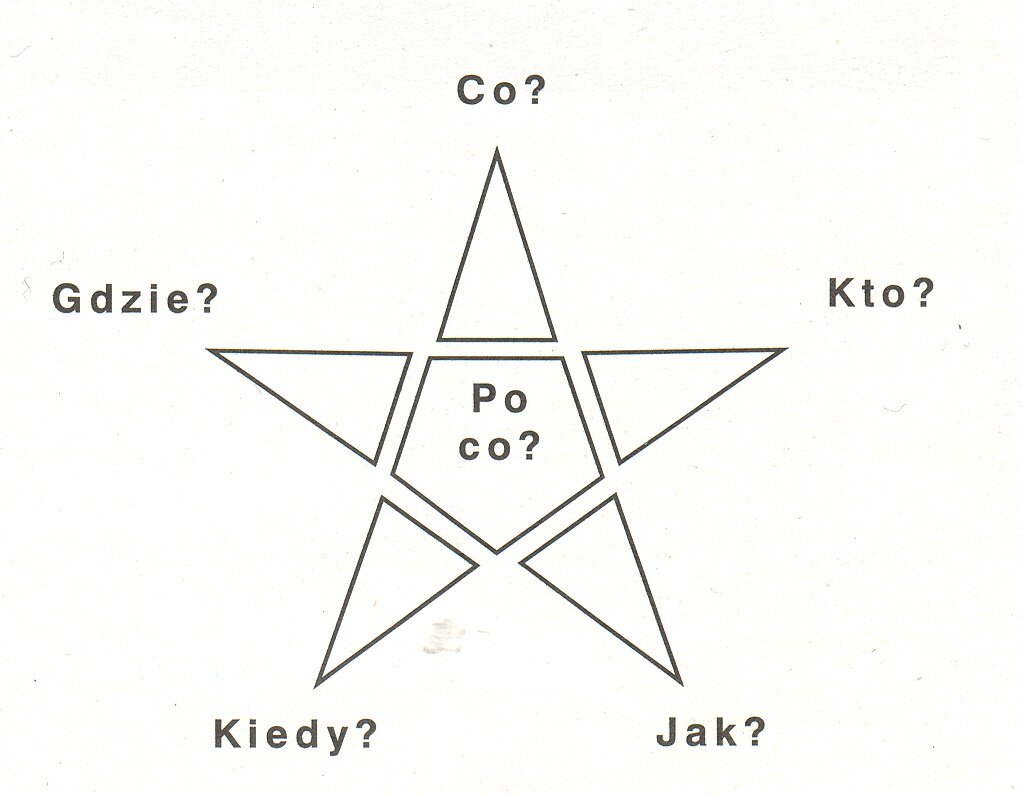
Burza mózgów, pokaz nauczycielski, pogadanka, gwiazda pytań, praca z całym zespołem, praca w grupach równym frontem, praca indywidualna.
3. Środki dydaktyczne
Foliogram przedstawiający mechanizm „korozji w kropli”, szary papier, markery, taśma klejąca lub magnesy, karty pracy, materiały zgromadzone przez uczniów.
4. Przebieg lekcji
a) Faza przygotowawcza
Podanie tematu lekcji. Ustalenie definicji procesu metodą burzy mózgów.
b) Faza realizacyjna
Omówienie rodzajów korozji. Określenie czynników wpływających na szybkość procesu korozji na podstawie obserwacji wyników doświadczeń przygotowanych przez uczniów na poprzedniej lekcji (załącznik 1). Porównanie przez uczniów kolejnych zlewek i szeregowanie ich w kolejności malejącej szybkości korozji. Omówienie procesów zachodzących w kolejnych zlewkach, zapis odpowiednich równań reakcji, sformułowanie wniosków. Przedstawienie foliogramu obrazującego mikroogniwo tworzące się na powierzchni stali i zachodzące w nim reakcje. Wyjaśnienie procesów „korozji w kropli”, zapis odpowiednich równań reakcji. Podział uczniów na grupy. Zadaniem zespołów jest udzielenie odpowiedzi na pytanie zawarte w temacie lekcji metodą gwiazdy pytań (załącznik 2).
c) Faza podsumowująca
Prezentacja i omówienie plakatów wykonanych przez poszczególne grupy.
5. Bibliografia
Babczonek‑Wróbel D., Lekcje chemii w formie dramy, [w:] „Chemia w szkole” 1999, nr 5, s. 282‑283.
Borowska B., Panfil V., Metody aktywizujące w edukacji biologicznej, chemicznej i ekologicznej – propozycje scenariuszy, Wydawnictwo Tekst, Bydgoszcz 2001.
Chemia nieorganiczna. Podręcznik dla liceów ogólnokształcących, pod red K. M. Puzdro, WSiP, Warszawa 1992.
6. Załączniki
a) Karta pracy ucznia
załącznik 1
Zapiszcie, co obserwujecie w kolejnych zlewkach oraz określcie, w których zlewkach korozja zachodzi najwolniej.
załącznik 2
Zastanówcie się nad odpowiedzią na pytanie: „Jak zmniejszyć straty wywołane korozją metali?”. Swoje przemyślenia przedstawcie na szarym papierze. Wykorzystajcie metodę gwiazdy pytań .
b) Zadanie domowe
Wyjaśnij, które zanieczyszczenia obecne w żelazie przyspieszają jego korozję: Mg, Zn, Sn, C, Cu, Mn?
7. Czas trwania lekcji
45 minut
8. Uwagi do scenariusza
Doświadczenia obrazujące proces korozji elektrochemicznej stali w różnych warunkach zostały przygotowane na wcześniejszej lekcji.
Zajęcia mogą zostać przygotowane przy współpracy z nauczycielem technologii informacyjnej, który pomoże uczniom znaleźć w Internecie informacje, dotyczące metod ochrony przed korozją.