Jakie informacje można odczytać z układu okresowego?
Znając położenie pierwiastka chemicznego w układzie okresowym, można ustalić pewne informacje o budowie jego atomów.
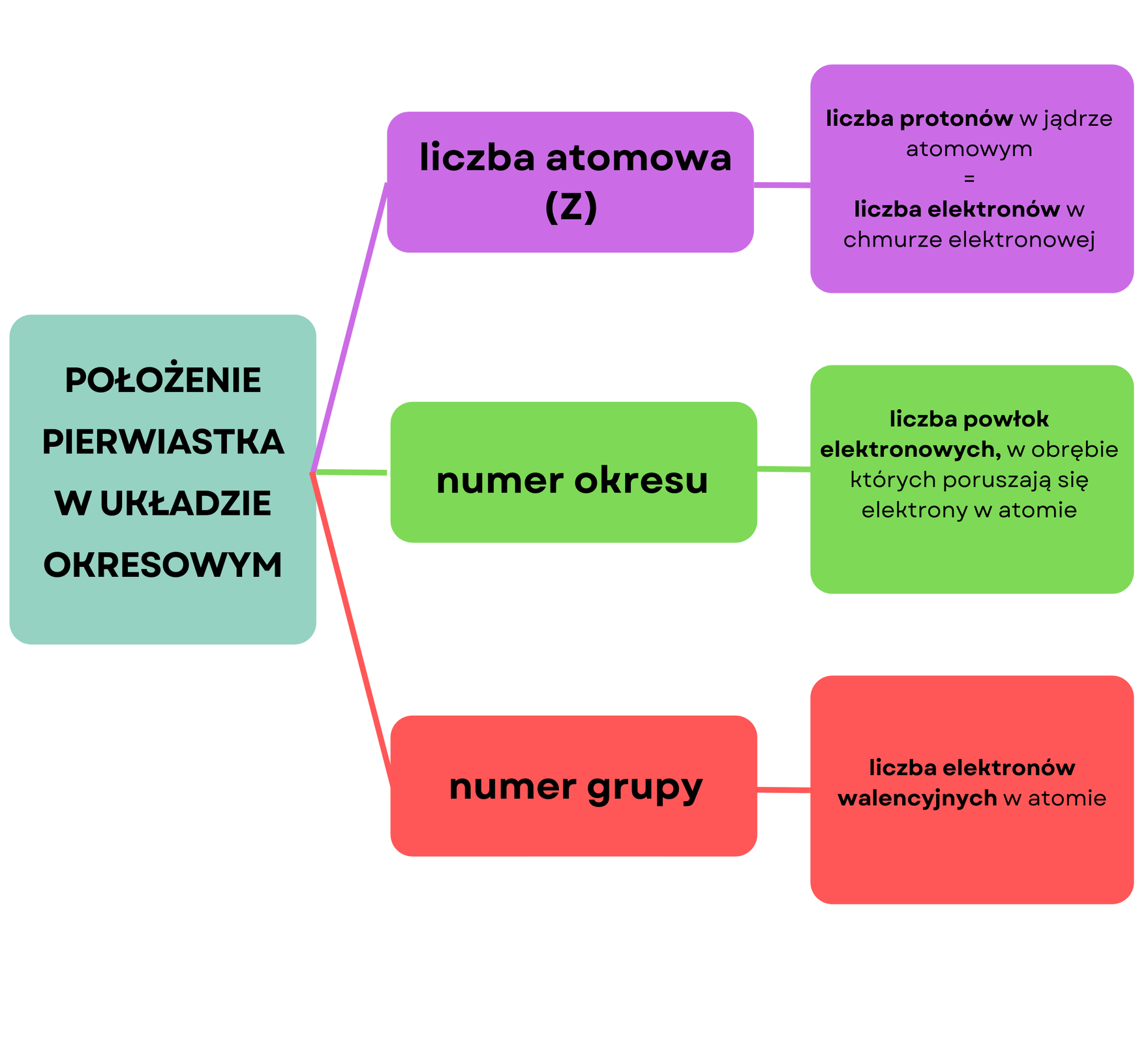
Liczba atomowa (Z) definiowana jest jako liczba ładunków dodatnich, a więc protonów, w jądrze atomowym. Z kolei liczba ładunków dodatnich (protonów) jest w atomie równa liczbie ładunków ujemnych (elektronów), dlatego też atom jest elektrycznie obojętny. Znając liczbę atomową pierwiastka, możemy zatem ustalić liczbę zawartych w atomie protonów i elektronów. Przykładowo, argon ma liczbę atomową równą . Na podstawie tej informacji możemy powiedzieć, że w atomie argonu znajduje się protonów i elektronów.
Znając numer okresu, w którym położony jest dany pierwiastek chemiczny, możemy określić, w obrębie ilu powłok elektronowychpowłok elektronowych poruszają się elektrony w atomie tego pierwiastka. Przykładowo, wapń położony jest w okresie układu okresowego. Możemy zatem wnioskować, że w atomie wapnia elektrony poruszają się w obrębie czterech powłok elektronowych.
Znając numer grupy, w której położony jest dany pierwiastek chemiczny, możemy ustalić liczbę elektronów walencyjnychelektronów walencyjnych w jego atomie. Liczba elektronów walencyjnych w atomach pierwiastków, położonych w grupach od do , równa jest numerowi grupy. Z kolei liczba elektronów walencyjnych w atomach pierwiastków, położonych w grupach od do , równa jest cyfrze jedności z numeru grupy. Wyjątkiem jest położony w grupie hel. W atomie helu znajdują się bowiem jedynie dwa elektrony i obydwa traktowane są jako elektrony walencyjne.

Film dostępny pod adresem /preview/resource/R1M8hxcFQxxLT
Film pokazujący, jakie informacje o tlenie można uzyskać z układu okresowego.
Zastanów się i odpowiedz na pytanie, jakie dwa parametry należy podać, aby określić położenie pierwiastka chemicznego w układzie okresowym.
Korzystając z poniższego programu prześledź, jakie informacje możesz odczytać z układu okresowego - w tym celu wykorzystaj zakładkę tutorial oraz tryb nauki, a następnie za pomocą opcji sprawdź się, zweryfikuj, czy już bezbłędnie odczytujesz informacje zamieszczone w układzie okresowym
Poniżej znajdują się wybrane informacje dotyczące budowy atomów niektórych pierwiastków chemicznych. Do każdej z informacji dopasuj nazwę pierwiastka chemicznego, dla którego jest ona prawdziwa. Dana informacja może być prawdziwa dla kilku pierwiastków jednocześnie.
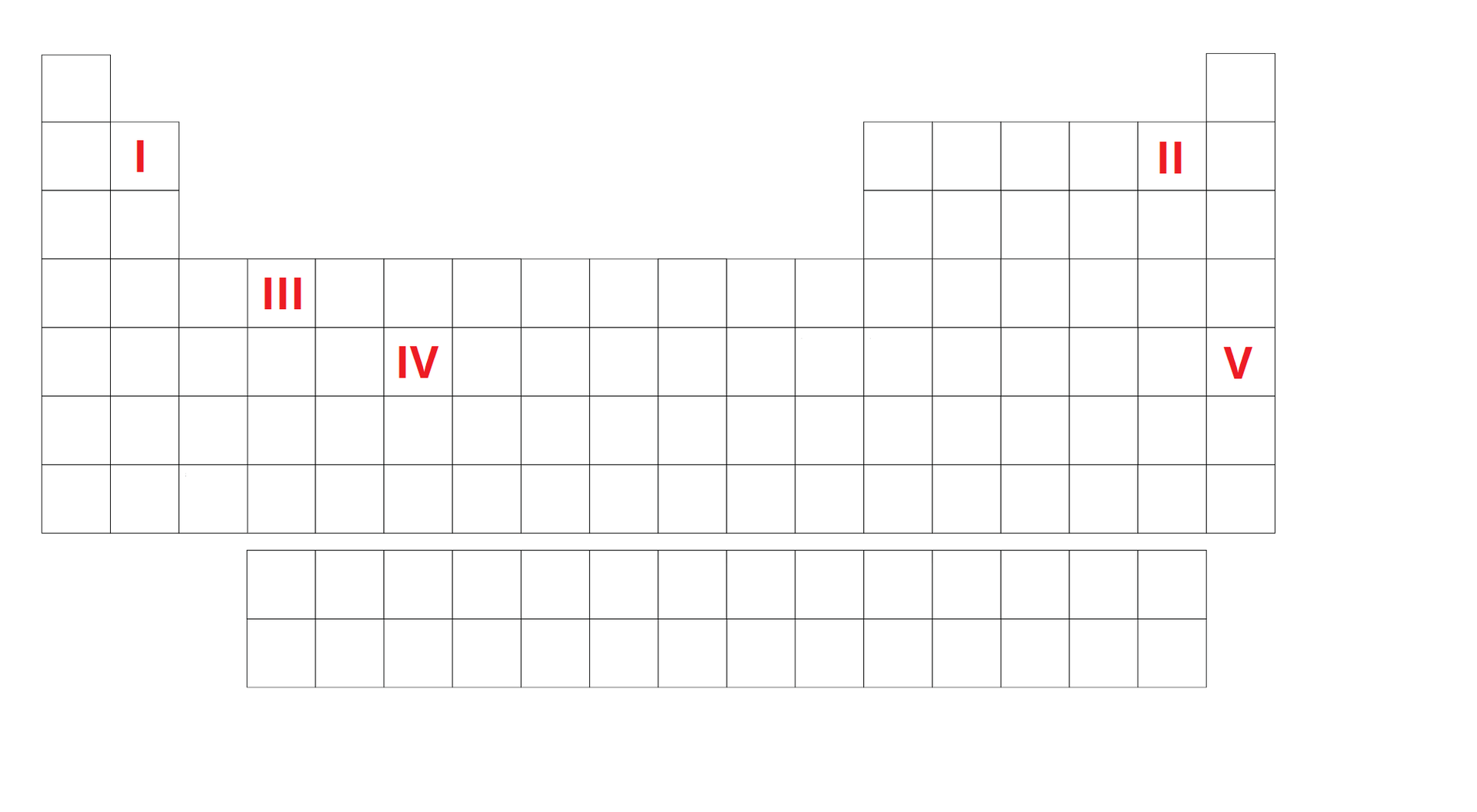
Na poniższym schemacie układu okresowego zaznaczono cyframi położenia pięciu różnych pierwiastków chemicznych ().
W załączonym układzie okresowym odszukaj pierwiastki chemiczne o nazwach: fosfor, potas, glin oraz brom, a potem uzupełnij poniższą tabelę. Masę atomową wskazanych pierwiastków chemicznych zaokrąglij do jedności.
Wyszukaj w układzie okresowym następujące pierwiastki:
A. pierwiastek chemiczny z grupy helowców, używany do napełniania balonów; dostarczony do płuc, powoduje zmianę wysokości głosu;
B. pierwiastek chemiczny z grupy borowców, stosowany do wyrobu puszek do napojów oraz folii do pakowania żywności;
C. pierwiastek chemiczny z drugiej grupy układu okresowego, główny składnik kości;
D. pierwiastek chemiczny z czwartego okresu, będący głównym składnikiem stali;
E. pierwiastek chemiczny z piątego okresu, będący surowcem do tworzenia biżuterii.
Słownik
liczba ładunków dodatnich (protonów) w jądrze atomowym; oznaczana symbolem Z
substancje proste (pierwiastki chemiczne), które charakteryzują się dobrym przewodnictwem cieplnym i elektrycznym, są kowalne i mają charakterystyczny połysk
w uproszczeniu - pierwiastki chemiczne, które nie posiadają jednocześnie wszystkich czterech cech (właściwości) definicyjnych metali: dobrego przewodnictwa prądu i ciepła, połysku metalicznego i kowalności; brak którejkolwiek z wymienionych (czterech) właściwości pozwala na zaklasyfikowanie badanej substancji prostej do niemetali
temperatura () i ciśnienie ()
zbiór elektronów w atomie danego pierwiastka chemicznego, charakteryzujących się zbliżonymi wartościami energii
elektrony, które w atomie danego pierwiastka chemicznego mają największe wartości energii - w uproszczeniu - znajdują się w obrębie najbardziej zewnętrznej podpowłoki (lub najbardziej zewnętrznych podpowłok) elektronowych atomu; elektrony walencyjne biorą udział w tworzeniu wiązań chemicznych i decydują o właściwościach chemicznych pierwiastka
prawo sformułowane początkowo przez Mendelejewa, które w obecnej formie głosi, że właściwości pierwiastków chemicznych, uporządkowanych zgodnie ze wzrastającą liczbą atomową, powtarzają się okresowo