Kwasy beztlenowe
Czy wiesz, że obecność siarkowodoru w produktach rozkładu białka (zawierającego między innymi wodór i siarkę) jest przyczyną charakterystycznego zapachu zepsutych jaj? Siarkowodór jest składnikiem gazu ziemnego i gazów wulkanicznych, a jego niewielkie ilości znajdują się w niektórych wodach mineralnych. Przy bardzo wysokim stężeniu gaz ten staje się niewyczuwalny ze względu na porażenie nerwu węchowego. Niebezpieczeństwo zatrucia siarkowodorem może występować podczas prac wykonywanych w studniach, studzienkach kanalizacyjnych, szambach lub niewentylowanych korytarzach podziemnych.

definicję wskaźników kwasowo‑zasadowych;
zastosowanie wskaźników kwasowo‑zasadowych i przykłady zmiany ich barwy w zależności od odczynu środowiska.
definiować pojęcie: kwas beztlenowy;
projektować doświadczenia pozwalające otrzymać kwasy beztlenowe;
opisywać budowę kwasów beztlenowych;
określać barwę, jaką przyjmują wodne roztwory o odczynie kwasowym w obecności wskaźników kwasowo‑zasadowych;
badać i opisywać właściwości oraz zastosowanie wybranych kwasów beztlenowych.
1. Wskaźniki kwasowo-
-zasadowe
Już wiesz, że pod wpływem wodnych roztworów wodorotlenków wskaźniki kwasowo‑zasadowe (np.: wywar z czerwonej kapusty, alkoholowy roztwór fenoloftaleiny, oranż metylowy, uniwersalny papierek wskaźnikowy) zmieniają zabarwienie.

Wskaźnik | Barwa wskaźnika | |
w wodzie destylowanej | w zasadzie | |
wywar z czerwonej kapusty | fioletowo‑niebieska | niebiesko‑zielona |
uniwersalny papierek wskaźnikowy | żółta | niebieska |
alkoholowy roztwór fenoloftaleiny | bezbarwna | malinowa |
wodny roztwór oranżu metylowego | żółto‑pomarańczowa | żółta |
Co się stanie po wprowadzeniu tych wskaźników do roztworu o odczynie kwasowym?
Przeprowadź doświadczenie chemiczne polegające na badaniu zachowania wskaźników kwasowo‑zasadowych w wodzie oraz kwasie cytrynowym.
Przeprowadzono doświadczenie chemiczne polegające na badaniu zachowania wskaźników kwasowo‑zasadowych w wodzie oraz kwasie cytrynowym.
Problem badawczy:
Czy wskaźniki kwasowo‑zasadowe zmienią zabarwienie po wprowadzeniu ich do kwasu?
Hipoteza:
Niektóre wskaźniki kwasowo‑zasadowe zmieniają zabarwienie pod wpływem kwasu.
Co było potrzebne:
probówki;
pręciki szklane;
wywar z czerwonej kapusty;
alkoholowy roztwór fenoloftaleiny;
wodny roztwór oranżu metylowego;
uniwersalny papierek wskaźnikowy;
sok z cytryny.
Przebieg doświadczenia:
Do trzech probówek wlano takie same objętości soku z cytryny. Do pierwszej probówki dodano kilka kropli wywaru z czerwonej kapusty, do drugiej alkoholowego roztworu fenoloftaleiny, a do trzeciej wodnego roztworu oranżu metylowego. Tak przygotowane roztwory wymieszano za pomocą szklanych pręcików. Następnie na uniwersalny papierek wskaźnikowy, za pomocą szklanego pręcika, naniesiono kilka kropli soku z cytryny. Obserwowano zachodzące zmiany.
Obserwacje:
Wywar z czerwonej kapusty, uniwersalny papierek wskaźnikowy i wodny roztwór oranżu metylowego, w obecności soku z cytryny, przyjęły barwę czerwoną. Alkoholowy roztwór fenoloftaleiny nie zmienił zabarwienia w obecności soku z cytryny – pozostał bezbarwny.
Postawiona hipoteza okazała się prawdziwa. Niektóre wskaźniki kwasowo-
zasadowe zmieniają zabarwienie pod wpływem kwasu.
Wnioski:
Składnikiem soku z cytryny jest kwas cytrynowy. Wskaźnikami, które zmieniają zabarwienie w roztworach kwasów, są między innymi: wywar z czerwonej kapusty, uniwersalny papierek wskaźnikowy, wodny roztwór oranżu metylowego. Natomiast alkoholowy roztwór fenoloftaleiny nie jest wskaźnikiem używanym do wykrywania obecności kwasów, ponieważ nie zmienia barwy w środowisku kwasowym.
Odpowiedz, za pomocą jakich wskaźników można wykryć roztwór kwasu.
Kwas chlorowodorowyKwas chlorowodorowy (kwas solny) jest składnikiem soku żołądkowego. Niszczy drobnoustroje chorobotwórcze, sterylizuje pokarm i pomaga w trawieniu białek.
U osoby dorosłej pojemność żołądka waha się zazwyczaj od do ( to litr). Wytwarza on co najmniej taką samą objętość soku żołądkowego na dobę. Nadmiar kwasu solnego w żołądku powoduje nadkwasotę.

2. Otrzymywanie kwasów beztlenowych
Przeprowadź doświadczenie chemiczne polegające na zbadaniu, czy chlorowodór rozpuszcza się w wodzie.
Przeprowadzono doświadczenie chemiczne polegające na zbadaniu, czy chlorowodór rozpuszcza się w wodzie.
Problem badawczy:
Czy chlorowodór rozpuszcza się w wodzie?
Hipoteza:
Chlorowodór rozpuszcza się w wodzie i powstaje kwas chlorowodorowy.
Co było potrzebne:
kolba okrągłodenna z otrzymanym wcześniej chlorowodorem (np. w wyniku reakcji chlorku sodu ze stężonym kwasem siarkowym());
korek do kolby okrągłodennej z osadzoną w nim cienką rurką szklaną;
pręcik szklany;
krystalizator;
woda destylowana;
wodny roztwór oranżu metylowego.
Przebieg doświadczenia:
Do krystalizatora wlano wodę i dodano kilkanaście kropli wodnego roztworu oranżu metylowego. Całość zamieszano szklanym pręcikiem. Kolbę z zebranym wcześniej chlorowodorem zamknięto korkiem z osadzoną w nim szklaną rurką. Kolbę z chlorowodorem odwrócono do góry dnem, a wylot szklanej rurki zanurzono w krystalizatorze z wodnym roztworem oranżu metylowego. Obserwowano zachodzące zmiany.
Obserwacje:
Woda z oranżem metylowym najpierw stopniowo, a następnie bardzo szybko wypełnia kolbę okrągłodenną, w której zmienia zabarwienie z żółtej na czerwone.
Wnioski:
Początkowo rozpuszczanie otrzymanego w kolbie chlorowodoru zachodzi bardzo powoli, ponieważ dostaje się on przez cienką rurkę do wody (z oranżem metylowym). Im więcej jednak chlorowodoru rozpuści się w wodzie, tym większy jest jego ubytek w kolbie. Ubytek powoduje spadek ciśnienia w kolbie, przez co poziom cieczy w rurce podnosi się. W końcu woda dostaje się do kolby, co powoduje lawinowy wzrost szybkości rozpuszczania chlorowodoru. Zmiana barwy cieczy w kolbie świadczy o kwasowym odczynie powstałego roztworu kwasu chlorowodorowego.
Zaznacz poprawnie zapisane równanie reakcji, która zaszła w czasie doświadczenia.
W jakim stanie skupienia występuje powstający w wyniku doświadczenia chlorowodór?
ChlorowodórChlorowodór należy do grupy wodorków, czyli związków chemicznych wodoru z innymi pierwiastkami chemicznymi. Wodorki niemetaliWodorki niemetali, takie jak np.: chlorowodór, bromowodór, fluorowodórfluorowodór czy siarkowodórsiarkowodór, są gazami i rozpuszczając się w wodzie, tworzą kwasy beztlenowekwasy beztlenowe. Kwasy beztlenowe są zatem wodnymi roztworami wodorków niektórych niemetali.
Skąd pochodzi nazwa „kwas solny”?
Kwas chlorowodorowy otrzymywano dawniej z soli kamiennej i stężonego kwasu siarkowego(), stąd powstała zwyczajowa nazwa „kwas solny”, czyli otrzymywany z soli.
Ile chlorowodoru może rozpuścić się w wody?
W temperaturze (pod ciśnieniem ) w wody można rozpuścić około chlorowodoru.
Kwasy beztlenowe otrzymuje się między innymi przez rozpuszczenie w wodzie związku chemicznego, powstałego podczas reakcji wodoru z niektórymi niemetalami, czyli wodorku, np.:
Kwas chlorowodorowy
gdzie:
– oznacza występowanie substancji w stanie gazowym;
– oznacza występowanie substancji w roztworze wodnym.

Kwas siarkowodorowy
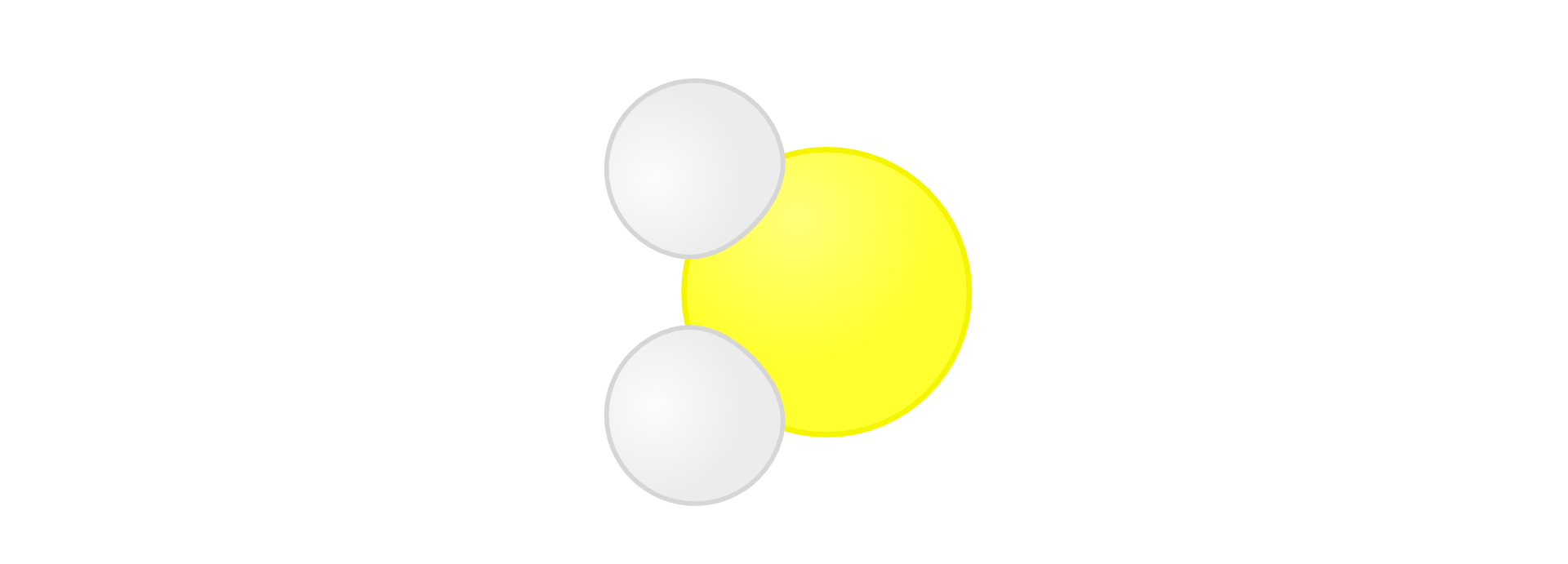
Kwas siarkowodorowy jest zatem wodnym roztworem siarkowodorusiarkowodoru.
Kwasy beztlenowe tworzą także inne pierwiastki chemiczne, między innymi grupy układu okresowego: fluor, brom i jod.
W nazwach kwasów beztlenowych, do nazwy pierwiastka (niemetalu), dodaje się formant „-o-” oraz końcówkę „-wodorowy”:
– kwas bromowodorowy;
– kwas chlorowodorowy;
– kwas jodowodorowy.
Wzór ogólny wodorków, które tworzą kwasy beztlenowe, ma postać:
gdzie:
– liczba atomów wodoru w cząsteczce kwasu;
– reszta kwasowa (dla kwasów beztlenowych są to atomy niemetalu).
Kwasy to według teorii Svante Arrheniusa (szwedzkiego chemika) związki chemiczne, które pod wpływem wody dysocjują na kation wodoru i anion reszty kwasowej. Na przykład:
Mocne kwasy, takie jak kwas chlorowodorowy, tworzą roztwory, w których cząsteczki wodorków są całkowicie zdysocjowane. Dlatego w równaniu dysocjacji elektrolitycznej zapisujemy strzałkę w jedną stronę. Innymi mocnymi kwasami beztlenowymi są kwas bromowodorowy oraz kwas jodowodorowy o następujących wzorach sumarycznych: oraz .
Natomiast słabe kwasy tworzą roztwory, w których cząsteczki wodorków nie są całkowicie zdysocjowane, dlatego w równaniu dysocjacji elektrolitycznej zapisujemy strzałki w dwie strony. Do słabych kwasów beztlenowych należą kwas siarkowodorowykwas siarkowodorowy oraz kwas fluorowodorowykwas fluorowodorowy o następujących wzorach sumarycznych: oraz .
Powstające w wyniku dysocjacji elektrolitycznej kationy hydroniowe są odpowiedzialne za kwasowy odczyn kwasów.

3. Właściwości kwasów beztlenowych
ChlorowodórChlorowodór jest bezbarwnym gazem o ostrym, duszącym zapachu. Bardzo dobrze rozpuszcza się w wodzie. Wodny roztwór chlorowodoru nazywamy kwasem chlorowodorowymkwasem chlorowodorowym lub solnym.
Przeprowadź doświadczenie chemiczne polegające na zbadaniu właściwości stężonego kwasu chlorowodorowego.
Uwaga! Podczas pracy ze stężonym kwasem solnym należy zachować szczególną ostrożność, założyć okulary ochronne i rękawiczki. Doświadczenie należy przeprowadzać pod wyciągiem.
Przeprowadzono doświadczenie chemiczne polegające na zbadaniu właściwości stężonego kwasu chlorowodorowego.
Problem badawczy:
Jakie charakterystyczne właściwości ma stężony kwas chlorowodorowy?
Hipoteza:
Stężony kwas chlorowodorowy ma nieprzyjemny, ostry, duszący zapach oraz właściwości żrące.
Co było potrzebne:
stężony kwas solny;
zlewka;
szalka Petriego;
papier (bibuła);
kawałki tkanin;
pipeta lub wkraplacz.
Przebieg doświadczenia:
Ostrożnie odkręcono butlę ze stężonym kwasem chlorowodorowym i niewielką jego ilość nalano do zlewki. Na dwóch połówkach szalki Petriego umieszczono papier i kawałki tkanin. Za pomocą pipety naniesiono na badane materiały po kilka kropli stężonego kwasu chlorowodorowego. Pozostawiono na kilka minut. Obserwowano zachodzące zmiany.
Obserwacje:
Kwas chlorowodorowy jest bezbarwną cieczą, o charakterystycznym drażniącym zapachu. Nad otwartą butelką tworzy się „mgła”. Zetknięcie kwasu z tkaninami oraz papierem powoduje ich zniszczenie.
Hipoteza:
Postawiona hipoteza okazała się prawdziwa. Stężony kwas chlorowodorowy ma nieprzyjemny, ostry, duszący zapach oraz właściwości żrące.
Wnioski:
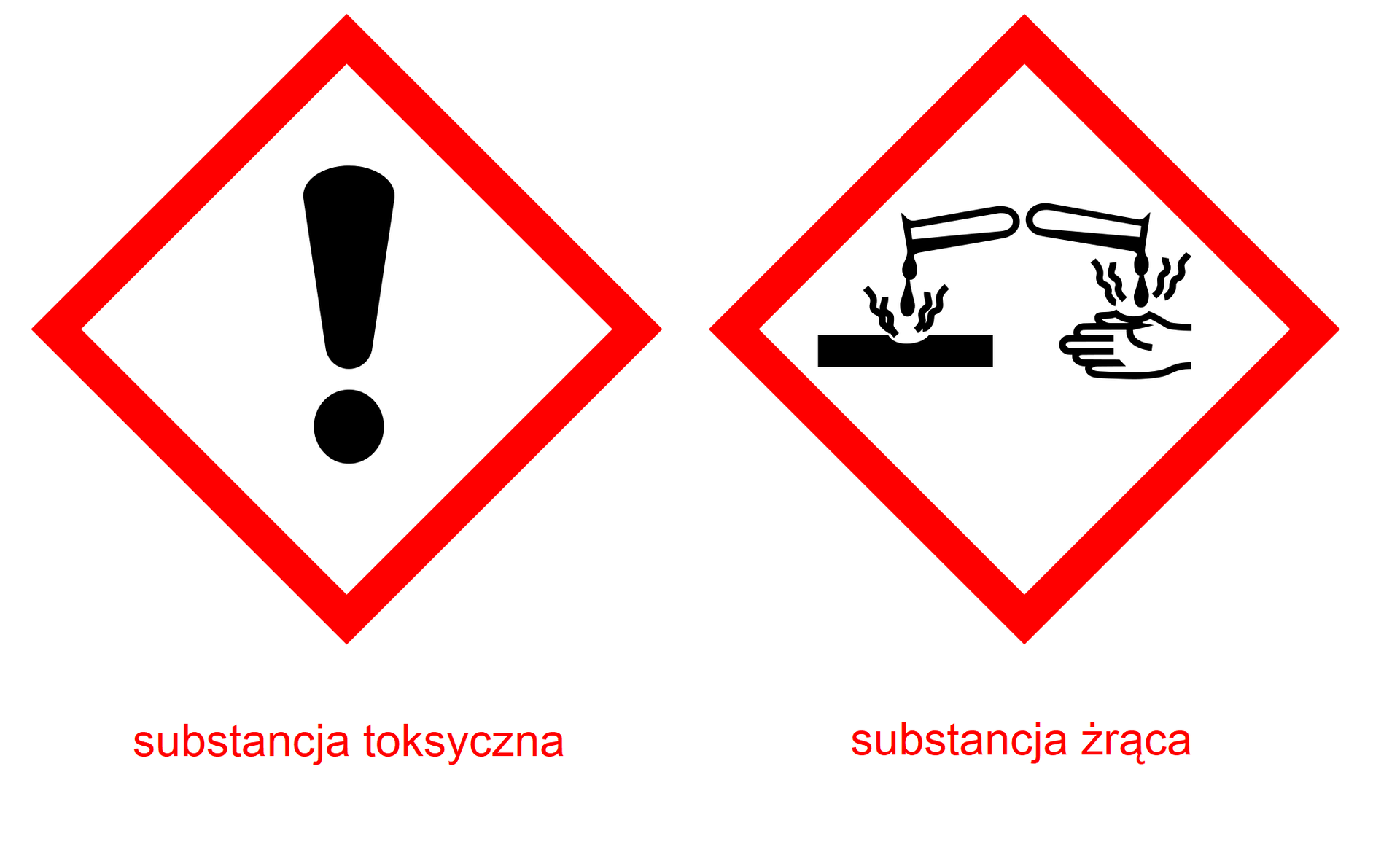
Kwas chlorowodorowy to bezbarwna ciecz, o charakterystycznym drażniącym zapachu. Jeżeli naczynie ze stężonym kwasem chlorowodorowym pozostawimy otwarte, ulatniający się chlorowodór, reagując z wilgocią zawartą w powietrzu, utworzy „mgłę”. Dlatego stężony kwas solny określamy jako dymiący na powietrzu. Kwas ten niszczy papier i tkaninę – ma zatem właściwości żrące. Dlatego na opakowaniu umieszcza się piktogramy ostrzegawcze, informujące o substancjach toksycznych oraz o substancjach żrących.
Problem badawczy:
Jakie charakterystyczne właściwości ma stężony kwas chlorowodorowy?
Hipoteza:
Stężony kwas chlorowodorowy ma nieprzyjemny, ostry, duszący zapach oraz właściwości żrące.
Co było potrzebne: stężony kwas solny, zlewka, szalka Petriego, papier (bibuła), kawałki tkanin, pipeta lub wkraplacz.
Przebieg doświadczenia: Ostrożnie odkręcono butlę ze stężonym kwasem chlorowodorowym i niewielką jego ilość nalano do zlewki. Obserwowano zachodzące zmiany. Na dwóch połówkach szalki Petriego umieszczono papier i kawałki tkanin. Za pomocą pipety naniesiono na badane materiały po kilka kropli stężonego kwasu chlorowodorowego. Pozostawiono na kilka minut. Obserwowano zachodzące zmiany.
Zastosowanie wybranych kwasów beztlenowych
Kwas chlorowodorowy wykorzystuje się jako odczynnik chemiczny, w procesie obróbki metali, do produkcji: tworzyw sztucznych, cukru, sztucznego miodu, przypraw, serków homogenizowanych i twarogów.
Kwas siarkowodorowy stosowany jest jako odczynnik chemiczny do wykrywania jonów niektórych metali.

Kwas fluorowodorowy używa się do trawienia szkła (matowienia jego fragmentów). W ten sposób nanosi się na wyroby szklane napisy i wzory dekoracyjne. Metoda ta została odkryta przez Heinricha Schwanhardta w Norynberdze już w Fluor i fluorowodór są składnikami środków grzybobójczych (do impregnacji podkładów kolejowych), bakteriobójczych (w przemyśle spirytusowym) i owadobójczych.

Podsumowanie
W cząsteczkach kwasów beztlenowych nie występują atomy tlenu, a atomy wodoru łączą się bezpośrednio z innymi atomami niemetalu.
Kwasy beztlenowe powstają w wyniku rozpuszczenia w wodzie gazu, będącego produktem reakcji syntezy wodoru z niemetalem (innym niż wodór).
Chlorowodór i siarkowodór są gazami trującymi. Rozpuszczone w wodzie tworzą kwasy (kwas chlorowodorowy i kwas siarkowodorowy), wykazujące odczyn kwasowy.
Kwas chlorowodorowy jest mocnym kwasem, który „dymi” na powietrzu.
Kwas siarkowodorowy jest słabym kwasem, który ma charakterystyczny zapach, przypominający zgniłe jaja.
Słownik
bezbarwny, dymiący gaz o silnie duszącej woni; cięższy od powietrza, niepalny; bardzo dobrze rozpuszcza się w wodzie, tworząc kwas chlorowodorowy (solny)
bezbarwna ciecz (temperatura wrzenia ) lub trujący gaz o silnie drażniącej woni; wywołuje stan zapalny błon śluzowych
bezbarwny, silnie trujący gaz o ostrym, duszącym zapachu zgniłych (nieświeżych i długo gotowanych) jaj; jego wodny roztwór to kwas siarkowodorowy
wodny roztwór chlorowodoru
wodny roztwór fluorowodoru
wodny roztwór siarkowodoru
związki chemiczne, które powstały w wyniku rozpuszczenia w wodzie wodorku niemetalu
związek chemiczny wodoru z niemetalem
Ćwiczenia
Wykorzystując zestaw modeli atomów lub kolorową plastelinę i wykałaczki (lub zapałki), skonstruuj modele cząsteczek chlorowodoru, siarkowodoru oraz fluorowodoru.
Zaznacz poprawnie zapisaną parę równań reakcji otrzymywania kwasu chlorowodorowego w roztworze wodnym.
, 2.
, 3.
Oceń prawdziwość podanych informacji na temat kwasu solnego.
| Prawda | Fałsz | |
| Kwas ten jest trującym gazem. | □ | □ |
| Kwas ten jest bezbarwną cieczą. | □ | □ |
| Kwas ten ma właściwości higroskopijne. | □ | □ |
| Kwas ten jest nazywany kwasem chlorowodorowym. | □ | □ |
| Kwas ten jest składnikiem soku żołądkowego ssaków. | □ | □ |
| Stężony roztwór tego kwasu ma właściwości żrące. | □ | □ |
Oceń prawdziwość podanych informacji na temat kwasu siarkowodorowego.
| Prawda | Fałsz | |
| Kwas ten jest gazem o zapachu zgniłych jaj. | □ | □ |
| Kwas ten jest bezbarwną cieczą. | □ | □ |
| Kwas ten łatwo rozpuszcza się w wodzie, tworząc siarkowodór. | □ | □ |
| Kwas ten jest składnikiem wody królewskiej. | □ | □ |
| Kwas ten barwi fenoloftaleinę na kolor czerwony. | □ | □ |
Przyporządkuj informacje przeciągnij pasujące elementy do odpowiedniej kategorii.
jako składnik niektórych mineralnych wód leczniczych, w przemyśle farmaceutycznym, jako odczynnik chemiczny w analizie chemicznej, w przemyśle włókienniczym, w przemyśle spożywczym (m.in. w cukrownictwie), do produkcji mas plastycznych i tworzyw sztucznych (PCV), jako odczynnik chemiczny, do produkcji barwników organicznych, w przemyśle metalurgicznym (do czyszczenia – trawienia stali), do uzdatniania wody pitnej i w basenach
| Kwas chlorowodorowy jest stosowany: | |
|---|---|
| Kwas siarkowodorowy jest stosowany: |
Zapisz, jakie piktogramy mogą znaleźć się na butelce ze stężonym kwasem chlorowodorowym.
Kwasy beztlenowe otrzymuje się między innymi poprzez rozpuszczenie w wodzie związku chemicznego, powstałego podczas reakcji wodoru z wybranym niemetalem. Uzupełnij poniższe równania reakcji.
( luka do uzupełnienia ) luka do uzupełnienia ( luka do uzupełnienia )
luka do uzupełnienia luka do uzupełnienia
Bibliografia
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy ósmej szkoły podstawowej, Warszawa 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy siódmej szkoły podstawowej, Kielce 2020.