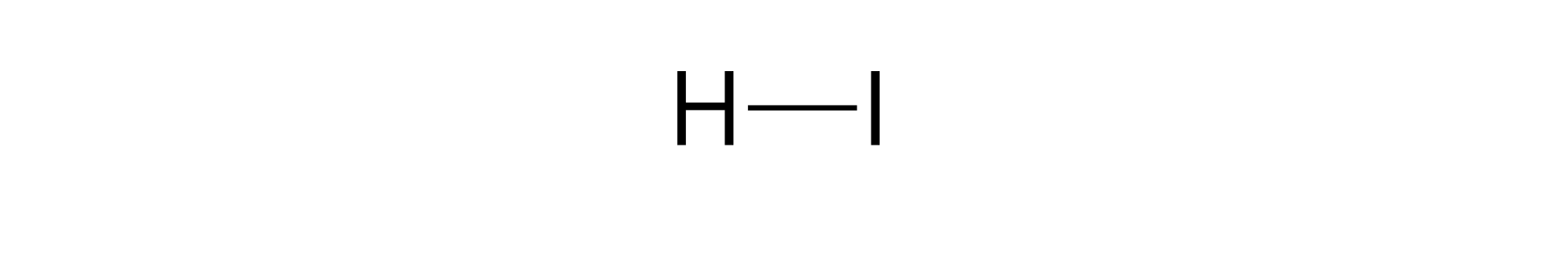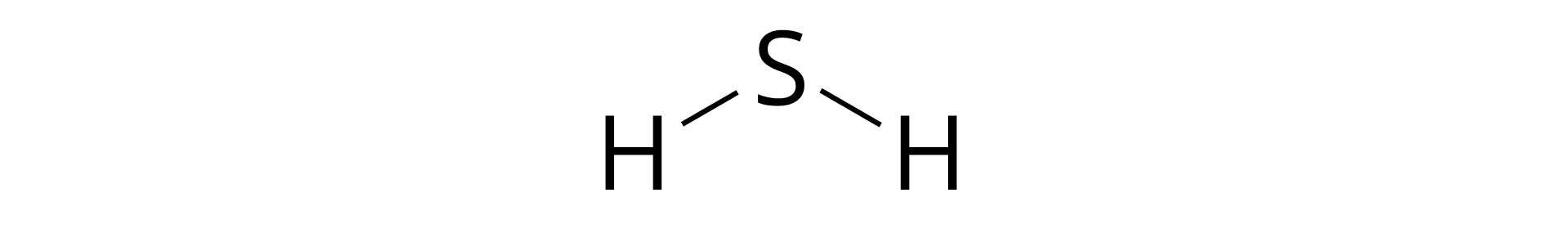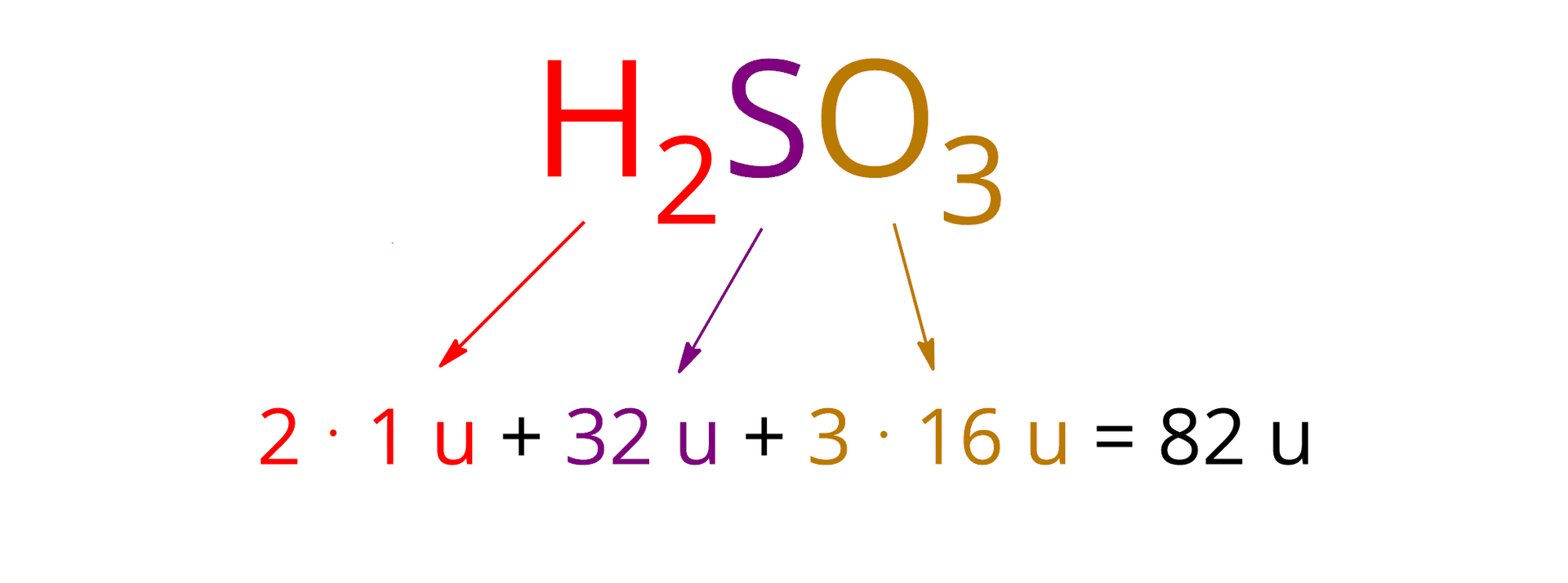Kwasy nieorganiczne - powtórzenie i podsumowanie wiadomości.
Poniższy materiał stanowi uzupełnienie treści zawartych w materiale: https://zpe.gov.pl/a/zasady-i-kwasy–podsumowanie/D15lmwbUN
Dużo osób na słowo „kwas” reaguje z przerażeniem, kojarząc go jako substancję żrącą i niebezpieczną. A może i Ty masz takie skojarzenia? Czy wiesz jednak, że kwasy nieorganiczne stosowane są powszechnie w przemyśle spożywczym? Jak myślisz, w produkcji których produktów spożywczych się je wykorzystuje? Zapoznaj się z poniższym materiałem i usystematyzuj swoją wiedzę z zakresu kwasów nieorganicznych.
właściwości substancji zaliczane do właściwości fizycznych oraz właściwości zaliczane do właściwości chemicznych;
sposób rysowania wzorów strukturalnych związków chemicznych; mechanizm procesu dysocjacji elektrolitycznej kwasów;
definicję wskaźników kwasowo‑zasadowych i ich zastosowanie w laboratorium chemicznym;
definicję kwasów;
sposób zapisu równania reakcji chemicznych w formie cząsteczkowej.
ustalać nazwy kwasów nieorganicznych w oparciu o ich wzory sumaryczne i odwrotnie;
wskazywać różnice w budowie cząsteczek kwasów tlenowych i beztlenowych;
zapisywać równania reakcji otrzymywania wybranych kwasów tlenowych;
wyjaśniać zależność pomiędzy wybranymi właściwościami fizykochemicznymi kwasów a ich zastosowaniem;
wykorzystywać wiedzę dotyczącą budowy kwasów nieorganicznych w prostych obliczeniach chemicznych.
Kwasy nieorganiczne – budowa i nazewnictwo
Definicja
Kwasy nieorganiczneKwasy nieorganiczne to związki chemiczne, których cząsteczki zbudowane są z przynajmniej jednego atomu wodoru oraz reszty kwasowej. Wzór ogólny kwasów nieorganicznych ma postać:
gdzie:
– symbol atomu wodoru;
– reszta kwasowa;
– liczba atomów wodoru w cząsteczce kwasu (równa wartościowości reszty kwasowej).
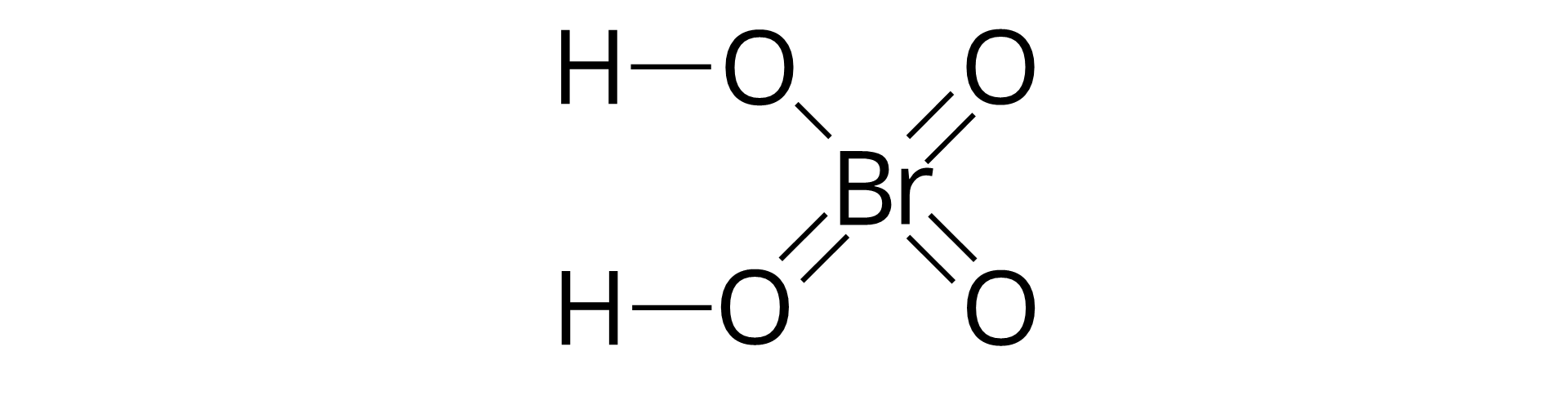
Ze względu na skład reszty kwasowej wyróżnia się kwasy beztlenowekwasy beztlenowe i kwasy tlenowekwasy tlenowe. Resztę kwasową w cząsteczkach kwasów beztlenowych stanowią atomy pierwiastka (a czasem pierwiastków) innego niż tlen i wodór. Z kolei w skład reszt kwasowych cząsteczek kwasów tlenowych wchodzą atomy tlenu oraz atom (a czasem atomy) pierwiastka innego niż tlen i wodór (zwykle niemetalu). Atom wspomnianego pierwiastka jest w kwasach nazywamy atomem centralnym, a atomy wodoru, w przypadku cząsteczek większości kwasów tlenowych, nie są z nim połączone bezpośrednio, ale poprzez atomy tlenu.
Pamiętaj, że kwasy beztlenowe nie są substancjami „czystymi”, a wodnymi roztworami odpowiednich wodorków (czyli mieszaninami jednorodnymi wodorków z wodą).
Nazwy kwasów tworzy się w zależności od ich przynależności do kwasów tlenowych lub beztlenowych. Przeanalizuj opisane poniżej zasady nazewnictwa kwasów wraz z przykładami, klikając na poniższe kafelki.
Ponieważ kwasy beztlenowe to tak naprawdę wodne roztwory odpowiednich wodorków, które są w temperaturze pokojowej gazami, w celu odróżnienia tych dwóch form, do wzoru kwasu dodajemy często symbol aq, oznaczający roztwór wodny (łac. aqua – czyt. akwa – „woda”), a do wzoru wodorku symbol g, oznaczający, że mamy do czynienia z gazem. Symbole te zapisujemy w nawiasie w indeksie dolnym.
np. – chlorowodór, – kwas chlorowodorowy
Zapisz nazwy kwasów nieorganicznych o następujących wzorach sumarycznych: , , , , .
Napisz nazwy kwasów nieorganicznych o następujących wzorach sumarycznych: , , , . Następnie narysuj wzory strukturalne kwasów tlenowych i wzory strukturalne wodorków, które po rozpuszczeniu w wodzie utworzą wskazane w poleceniu kwasy beztlenowe.
Napisz nazwy kwasów nieorganicznych o następujących wzorach sumarycznych: , , , .
Oblicz masowy skład procentowy kwasu siarkowego. Wyniki podaj w procentach z dokładnością do drugiego miejsca po przecinku.
Kwasy nieorganiczne – otrzymywanie
Metody otrzymywania kwasów nieorganicznych, podobnie jak ich nazewnictwo, uzależnione są od tego, czy kwas, który chcemy otrzymać, jest kwasem tlenowym czy beztlenowym.
Zapoznaj się z metodami otrzymywania kwasów nieorganicznych, klikając na poniższe kafelki.
Napisz równania reakcji otrzymywania wymienionych poniżej kwasów na drodze reakcji chemicznej tlenku odpowiedniego pierwiastka z wodą.
Uzupełnij równania reakcji otrzymywania wymienionych poniżej kwasów na drodze reakcji chemicznej tlenku odpowiedniego pierwiastka z wodą.
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
Równanie reakcji otrzymywania kwasu azotowego:
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
Równanie reakcji otrzymywania kwasu manganowego:
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
Tlenek pewnego pierwiastka chemicznego (oznaczonego symbolem ) ma wzór . W wyniku reakcji tego tlenku z wodą powstaje kwas o wzorze . Wiedząc, że opisany tlenek zawiera masowych tlenu, ustal jego wzór sumaryczny. Następnie zapisz równanie reakcji opisanej w poleceniu. Napisz nazwy wszystkich reagentów tej reakcji.
Tlenek pewnego pierwiastka chemicznego (oznaczonego symbolem ) ma wzór . W wyniku reakcji tego tlenku z wodą powstaje kwas o wzorze . Wiedząc, że opisany tlenek zawiera masowych tlenu, ustal jego wzór sumaryczny. Następnie uzupełnij równanie reakcji opisanej w poleceniu. Napisz nazwy wszystkich reagentów tej reakcji.
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15.
Równanie reakcji chemicznej opisanej w poleceniu ma postać:
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. , 14. , 15.
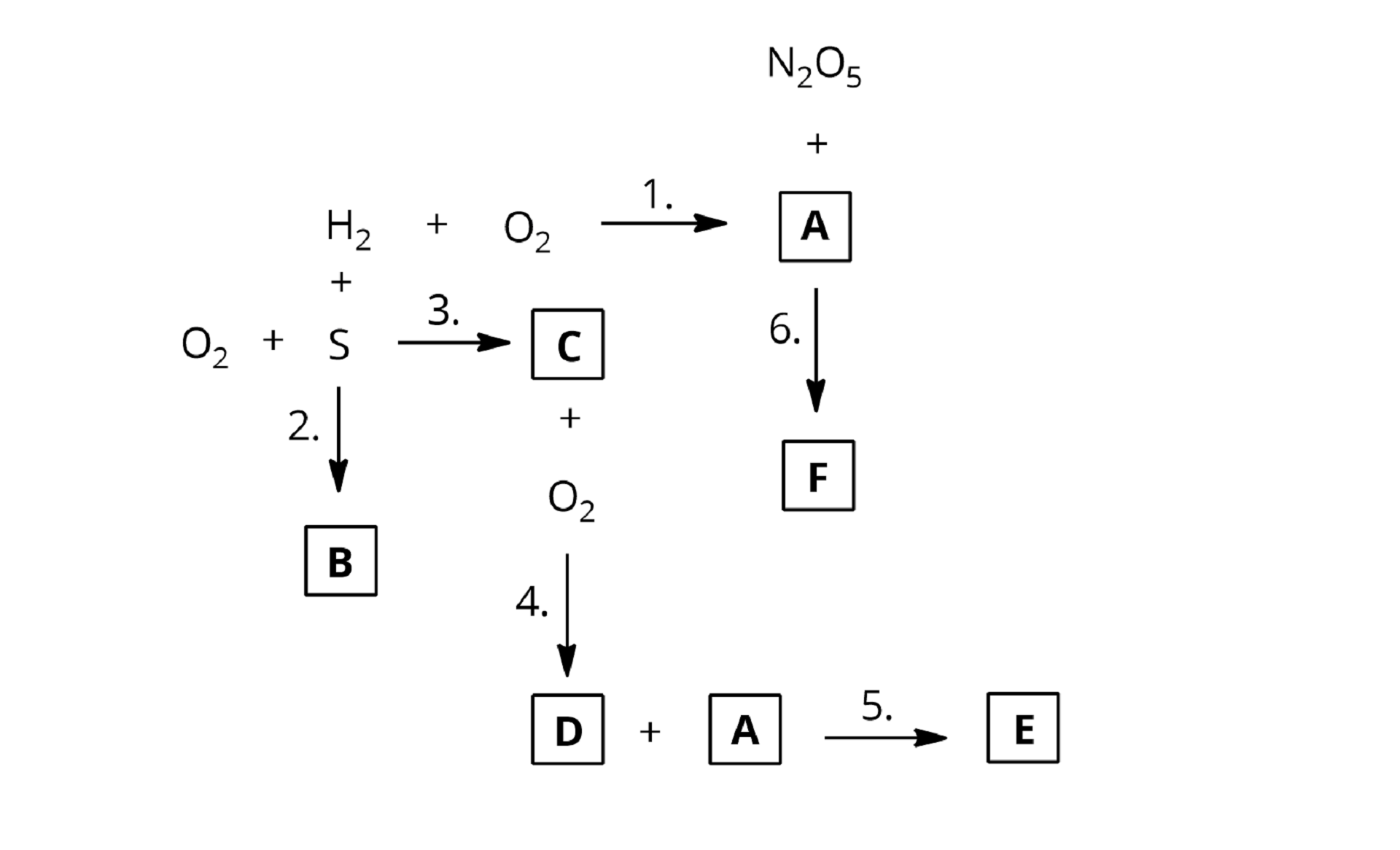
Zapisz równania reakcji chemicznych, oznaczonych na poniższym chemografie cyframi od do . Napisz wzory (lub symbole) i nazwy substancji, oznaczonych literami od do .
Kwas krzemowy () jest kwasem praktycznie nierozpuszczalnym w wodzie i nie można go otrzymać na drodze reakcji chemicznej tlenku krzemu () z wodą. Jak zatem otrzymać wspomniany kwas, mając do dyspozycji tlenek krzemu i dowolne odczynniki nieorganiczne (w których skład nie wchodzi krzem)? Można to zrobić w dwóch etapach. W pierwszym należy wprowadzić tlenek krzemu do wodnego roztworu wodorotlenku, np. wodorotlenku sodu. W wyniku zachodzącej reakcji chemicznej powstaje rozpuszczalny w wodzie związek chemiczny o nazwie krzemian sodu i wzorze sumarycznym . Następnie do roztworu tego związku można wprowadzić kwas chlorowodorowy (solny). Poskutkuje to wytrąceniem się z roztworu białego, galaretowatego osadu kwasu krzemowego. Równania opisanych reakcji chemicznych mają postać:
Etap :
Etap :
Kwasy nieorganiczne – właściwości fizykochemiczne
Poniżej zebrano niektóre właściwości fizykochemiczne wybranych kwasów nieorganicznych. Kliknij na poszczególne odnośniki, aby się z nimi zapoznać.
Wodne roztwory kwasów mają odczyn kwasowy. Oznacza to, że stężenie kationów wodoru (), jest w tych roztworach większe od stężenia anionów wodorotlenkowych (). Stężenia tych jonów w czystej wodzie są równe.
Duża liczba kationów wodoru w wodnych roztworach kwasów pochodzi z procesu dysocjacji elektrolitycznejdysocjacji elektrolitycznej tych kwasów. Kwasy rozpuszczalne w wodzie, pod wpływem jej cząsteczek, rozpadają się na kationy wodoru oraz aniony reszt kwasowych. Uproszczony schemat tego procesu można zapisać jako:
gdzie:
– kation wodoru;
– anion reszty kwasowej;
– liczba atomów wodoru w cząsteczce kwasu (równa wartościowości reszty kwasowej).
Jednak w rzeczywistości w roztworze wodnym nie znajdują się kationy wodoru, a tak zwane kationy oksoniowe (), utworzone przez przyłączenie cząsteczki wody do kationu wodoru. Schemat procesu dysocjacji elektrolitycznej kwasów z uwzględnieniem jonów oksoniowych ma postać:
gdzie: – kationy oksoniowe.
Uproszczony zapis procesu dysocjacji elektrolitycznej kwasu chlorowodorowego ma postać:
pod wpływem cząsteczek wody dysocjuje na
a z uwzględnieniem jonów oksoniowych:
Kwas siarkowodorowy ulega dysocjacji dwuetapowej. Proces dysocjacji elektrolitycznej kwasu siarkowodorowego zapiszemy jako:
Etap :
pod wpływem cząsteczek wody dysocjuje na
Etap :
pod wpływem cząsteczek wody dysocjują na
Zapis tego procesu, z uwzględnieniem jonów oksoniowych będzie miał postać:
Etap :
Etap :
Napisz równania procesów dysocjacji elektrolitycznej kwasów o nazwach: kwas azotowy, kwas bromowodorowy, kwas chromowy.
Uzupełnij równania procesów dysocjacji elektrolitycznej kwasów o nazwach: kwas azotowy, kwas bromowodorowy, kwas chromowy.
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10.
kwas bromowodorowy:
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10.
kwas chromowy:
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10.
Obecność kationów wodoru (kationów oksoniowych), a zarazem obecność kwasu w roztworze wodnym, można potwierdzić za pomocą odpowiednich wskaźników kwasowo–zasadowychwskaźników kwasowo–zasadowych. Na poniższej grafice przedstawiono barwy wybranych wskaźników kwasowo–zasadowych w wodnym roztworze kwasu.
Obecność kationów wodoru (kationów oksoniowych), a zarazem obecność kwasu w roztworze wodnym, można potwierdzić za pomocą odpowiednich wskaźników kwasowo–zasadowych.
Podstawowe wskaźniki kwasowo–zasadowe w wodnym roztworze kwasu zachowują się w następującyh sposób:
wodny roztwór oranżu metylowego zmienia zabarwienie z żółtopomarańczowego na czerwone;
wywar z czerwonej kapusty zmienia zabarwienie z różowofioletowego na czerwone;
uniwersalny papierek wskaźnikowy zmienia zabarwienie z żółtego na czerwone.
W wodnych roztworach niektórych kwasów nieorganicznych nie ma cząsteczek tych kwasów, a jedynie jony pochodzące z ich dysocjacji elektrolitycznej – kationy oksoniowe i aniony reszt kwasowych. Kwasy takie nazywamy mocnymi, a ich całkowity rozpad na jony pod wpływem wody, zaznaczamy w równaniu procesu dysocjacji strzałką w jedną stronę (). Do mocnych kwasów należą między innymi kwas chlorowodorowy, kwas bromowodorowy oraz kwas azotowy. W przypadku kwasów o mniejszej mocy (tak zwanych kwasów słabych), w ich wodnych roztworach znajdują się zarówno jony pochodzące z procesu dysocjacji elektrolitycznej, jak i cząsteczki niezdysocjowanych kwasów. Kwasy te nie ulegają bowiem całkowitemu rozpadowi na jony pod wpływem wody. Fakt ten zaznacza się w równaniu procesu dysocjacji dwiema strzałkami skierowanymi w przeciwne strony (). Do słabych kwasów należą między innymi kwas siarkowodorowy, kwas węglowy i kwas azotowy.
Kwasy nieorganiczne – zastosowanie
Kliknij na wybrany kafelek, aby zobaczyć treści.
- Nazwa kategorii: kwas chlorowodorowy HCl
- Nazwa kategorii: odczynnik w laboratorium chemicznym
- Nazwa kategorii: uzdatnianie wody w różnych gałęziach przemysłu
- Nazwa kategorii: w przemyśle metalurgicznym m.in. do oczyszczania powierzchni metali, np. usuwanie rdzy
- Nazwa kategorii: w przemyśle spożywczym m.in. jako regulator kwasowości w produktach żywnościowych (E507)
- Nazwa kategorii: produkcja chemii przemysłowej i gospodarczej
- Nazwa kategorii: w przemyśle farmaceutyczny do syntezy leków (m.in. kwasu askorbinowego)
- Nazwa kategorii: w garbarstwie do odtłuszczania powierzchni skór
- Nazwa kategorii: produkcja sztucznej bawełny
- Nazwa kategorii: woda królewska - do roztwarzania metali szlachetnych Koniec elementów należących do kategorii kwas chlorowodorowy HCl
- Elementy należące do kategorii kwas chlorowodorowy HCl
Na mapie myśli ukazano wybrane zastosowania kwasu chlorowodorowego. Jest on wykorzystywany do produkcji chemii przemysłowej i gospodarczej, produkcji sztucznej bawełny. W przemyśle farmaceutycznym jest używany do syntezy leków, między innymi kwasu askorbinowego. W postaci wody królewskiej jest wykorzystywany do roztwarzania metali szlachetnych. W garbarstwie używany jest do odtłuszczania powierzchni skór. Wykorzystywany jest do uzdatniania wody w różnych gałęziach przemysłu oraz jako odczynnik w laboratorium chemicznym. W przemyśle metalurgicznym jest używany między innymi do oczyszczania powierzchni metali, na przykład usuwania rdzy, a w przemyśle spożywczym miedzy innymi jako regulator kwasowości w produktach żywnościowych (E pięćset siedem).
- Nazwa kategorii: kwas azotowy(V)
- Nazwa kategorii: odczynnik w laboratorium chemicznym, m.in. do wykrywania białek
- Nazwa kategorii: środek myjąco-dezynfekujący w przemyśle spożywczym
- Nazwa kategorii: w przemyśle pirotechnicznym m.in. do produkcji nitrogliceryny i trotylu
- Nazwa kategorii: w przemyśle farmaceutycznym do produkcji leków, m.in. nitrogliceryny
- Nazwa kategorii: oczyszczanie powierzchni metali
- Nazwa kategorii: produkcja barwników i lakierów
- Nazwa kategorii: produkcja nawozów sztucznych (saletry)
- Nazwa kategorii: woda królewska - do roztwarzania metali szlachetnych Koniec elementów należących do kategorii kwas azotowy(V)
- Elementy należące do kategorii kwas azotowy(V)
Na mapie myśli ukazano wybrane zastosowania kwasu azotowego pięć. Jest on wykorzystywany do oczyszczania powierzchni metali, do produkcji barwników i lakierów oraz do produkcji nawozów sztucznych (saletry). W postaci wody królewskiej służy do roztwarzania metali szlachetnych. Jest on wykorzystywany jako odczynnik w laboratorium chemicznym między innymi do wykrywania białek. W przemyśle pirotechnicznym służy między innymi do produkcji nitrogliceryny i trotylu, a w przemyśle farmaceutycznym do produkcji leków, między innymi nitrogliceryny. Wykorzystywany jest również jako środek myjąco dezynfekujący w przemyśle pożywczym.
- Nazwa kategorii: kwas siarkowy(VI)
- Nazwa kategorii: osuszanie olejów, nafty i parafiny w przemyśle petrochemicznym
- Nazwa kategorii: odczynnik w laboratorium chemicznym
- Nazwa kategorii: produkcja nawozów sztucznych (siarczanu(VI) amonu i innych)
- Nazwa kategorii: produkcja materiałów wybuchowych (np. trotylu (TNT))
- Nazwa kategorii: wzbogacanie rud miedzi w górnictwie i metalurgii
- Nazwa kategorii: elektrolit w akumulatorach kwasowo-ołowiowych
- Nazwa kategorii: produkcja substancji zapachowych w przemyśle kosmetycznym
- Nazwa kategorii: produkcja barwników Koniec elementów należących do kategorii kwas siarkowy(VI)
- Elementy należące do kategorii kwas siarkowy(VI)
Na mapie myśli ukazano wybrane zastosowania kwasu siarkowego sześć. Służy on między innymi do osuszania olejów, nafty i parafiny w przemyśle petrochemicznym. Wykorzystuje się go również jako odczynnik w laboratorium chemicznym, a także do produkcji nawozów sztucznych (siarczanu sześć amonu i innych) oraz do produkcji materiałów wybuchowych (np. trotylu (TNT)). Kwas siarkowy sześć wykorzystuje się również do wzbogacania rud miedzi w górnictwie i metalurgii oraz jako elektrolit w akumulatorach kwasowo ołowiowych. Służy on również do produkcji substancji zapachowych w przemyśle kosmetycznym, a także do produkcji barwników.
- Nazwa kategorii: kwas fosforowy(V)
- Nazwa kategorii: produkcja nawozów sztucznych (fosfaty, superfosfaty)
- Nazwa kategorii: regulator kwasowości w przemyśle spożywczym (E338), m.in. w napojach gazowanych typu cola i galaretkach
- Nazwa kategorii: składnik środka do odrdzewiania stali (tzw. fosolu)
- Nazwa kategorii: odkamienianie armatury w ciepłownictwie
- Nazwa kategorii: preparaty stomatologiczne - porcelana i cement dentystyczny Koniec elementów należących do kategorii kwas fosforowy(V)
- Elementy należące do kategorii kwas fosforowy(V)
Na mapie myśli ukazano wybrane zastosowania kwasu fosforowego pięć. Służy on między innymi do produkcji nawozów sztucznych (fosfaty, superfosfaty). Wykorzystuje się go również jako regulator kwasowości w przemyśle spożywczym (E trzysta trzydzieści osiem), między innymi w napojach gazowanych typu cola i galaretkach. Stanowi on również składnik środka do odrdzewiania stali (tak zwanego fosolu). Kwas fosforowy pięć wykorzystuje się też do odkamieniania armatury w ciepłownictwie oraz jako preparaty stomatologiczne (porcelana i cement dentystyczny).
Mapa pojęć
Zapoznaj się z informacjami zawartymi na poniższej mapie pojęć i uporządkuj swoją wiedzę dotyczącą kwasów nieorganicznych. Następnie wykonaj polecenia .
Mapa myśli opisuje kwasy nieorganiczne. Dzielą się one na beztlenowe i tlenowe. Wzór ogólny kwasów beztlenowych to , gdzie reszta kwasowa nie zawiera atomów tlenu. Resztę kwasową stanowi atom odpowiedniego metalu. Kwasy beztlenowe otrzymuje się poprzez rozpuszczenie odpowiedniego wodorku w wodzie. Poniżej przedstawiono równania reakcji otrzymywania kwasów poprzez bezpośrednią syntezę z pierwiastków:
Przykładem kwasu beztlenowego jest kwas siarkowodorowy . Jest to roztwór wodny gazowego siarkowodoru, stanowi bezbarwną, przezroczystą ciecz o zapachu zgniłych jaj. W niewielkich ilościach stanowi składnik wód leczniczych. Innym przykładem kwasu beztlenowego jest kwas chlorowodorowy (solny) . Jest to roztwór wodny gazowego chlorowodoru, stanowi przezroczystą, bezbarwną ciecz o ostrym, drażniącym zapachu. Ze względu na swój kwaśny smak jest stosowany jako regulator kwasowości. Z kwasem azotowym pięć tworzy wodę królewską, którą używa się do roztwarzania metali szlachetnych. Kwas chlorowodorowy jest aktywny chemicznie. Jest on stosowany między innymi do uzdatniania wody w różnych gałęziach przemysłu, do oczyszczania powierzchni metali, na przykład usuwania rdzy. Używany jest do syntezy leków (między innymi kwasu askorbinowego) oraz do odtłuszczania powierzchni skór i produkcji sztucznej bawełny. Stężony kwas chlorowodorowy jest silnie żrący i dymi na powietrzu (kwas “dymiący”). Kwas ten stanowi również składnik soków żołądkowych ssaków – umożliwia on trawienie białek.
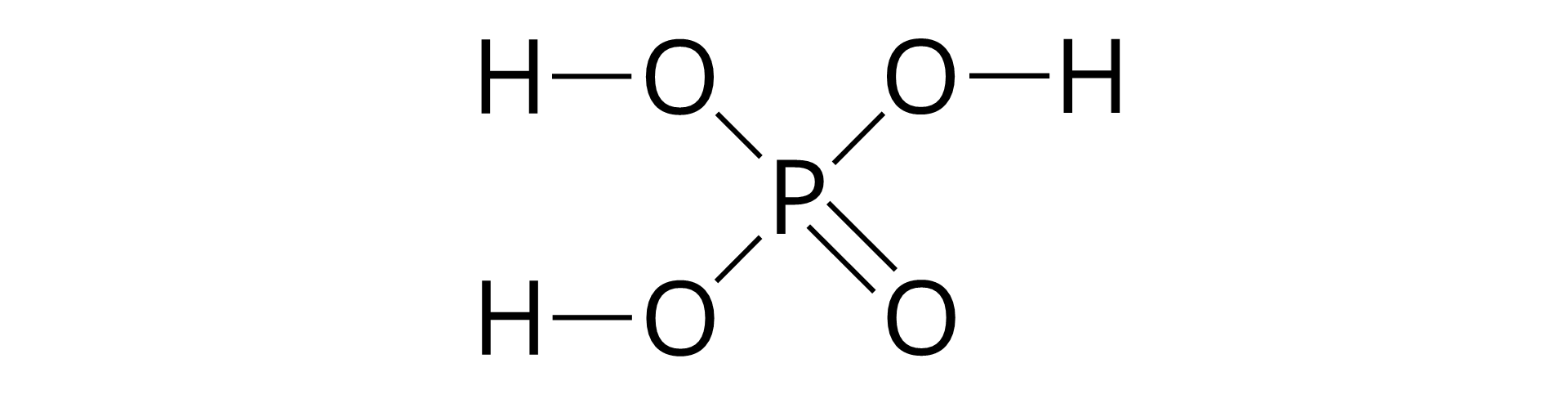
Wzór ogólny kwasów tlenowych to , gdzie reszta kwasowa zawiera atomy tlenu. W jej skład wchodzą również atomy innego niż tlen i wodór pierwiastka (najczęściej niemetalu). Kwasy tlenowe otrzymuje się w wyniku reakcji chemicznej tlenku odpowiedniego pierwiastka z wodą. Poniżej przedstawiono równania reakcji otrzymywania kwasów tlenowych:
Przykładem kwasu tlenowego jest kwas węglowy . Jest to bezbarwna, przezroczysta ciecz. Jest on nietrwały (rozkłada się na tlenek węgla cztery i wodę) – roztwory kwasu węglowego mają niskie stężenie. Kwas węglowy stosowany jest w produkcji wód i napojów gazowanych – odpowiada za ich kwaśny smak. Innym przykładem jest kwas siarkowy cztery . Jest to bezbarwna ciecz o duszącym zapachu, jest nietrwały – rozkłada się na tlenek siarki cztery i wodę. Ma właściwości bakteriobójcze i grzybobójcze, w związku z czym stosowany jest do dezynfekcji beczek na kiszonki i wino. Ma również właściwości bielące – wykorzystywany jest między innymi do bielenia wełny i w przemyśle papierniczym. Kolejnym kwasem jest kwas fosforowy pięć . Jest to bezbarwne ciało stałe, jest aktywny chemicznie. Reaguje on ze składnikami rdzy, w związku z czym stosowany jest jako składnik środka do odrdzewiania stali (tak zwanego fosolu). Stosowany jest między innymi w produkcji nawozów sztucznych i jako regulator kwasowości między innymi w napojach gazowanych typu cola. Następnym przykładem jest kwas azotowy pięć. Jest to bezbarwna, przezroczysta ciecz, a stężony jest silnie żrący. Z kwasem chlorowodorowym tworzy “wodę królewską”, która wykorzystywana jest do roztwarzanie metali szlachetnych. Kwas ten jest aktywny chemicznie, stosowany jest między innymi do wykrywania białek w laboratorium chemicznym i w produkcji nawozów sztucznych (saletry). Wykorzystywany jest również jako środek myjąco–dezynfekujący w przemyśle spożywczym, w przemysł pirotechnicznym (produkcja nitrogliceryny i TNT) oraz w przemyśle farmaceutycznym (nitrogliceryna). Innym przykładem jest kwas siarkowy sześć . Jest to bezbarwna, oleista ciecz, silnie żrąca. Kwas ten jest higroskopijny, w związku z czym jest wykorzystywany do osuszania olejów, nafty i parafiny w przemyśle petrochemicznym. Jest to kwas aktywny chemicznie, nazywany jest “krwią przemysłu chemicznego”. Wykorzystywany jest między innymi do produkcji nawozów sztucznych (między innymi siarczanu sześć amonu). Używa się go również do syntezy benzyny, produkcji substancji zapachowych oraz jako elektrolit w akumulatorach kwasowo–ołowiowych.
Słownik
związki chemiczne, których cząsteczki są zbudowane z przynajmniej jednego atomu wodoru i reszty kwasowej; wzór ogólny cząsteczki kwasu ma postać , gdzie – symbol atomu wodoru, – reszta kwasowa, – liczba atomów wodoru w cząsteczce kwasu (równa wartościowości reszty kwasowej)
związki chemiczne, których cząsteczki zbudowane są z przynajmniej jednego atomu wodoru i reszty kwasowej, w skład której wchodzi co najmniej jeden atom tlenu i atom pierwiastka innego niż tlen i wodór (najczęściej niemetalu)
wodne roztwory związków chemicznych, których cząsteczki zbudowane są z przynajmniej jednego atomu wodoru i reszty kwasowej, którą stanowi atom odpowiedniego niemetalu (lub atomy niemetali np. )
tlenek, który w reakcji z wodą tworzy odpowiedni kwas tlenowy
(łac. aqua regia) mieszanina stężonego kwasu chlorowodorowego i stężonego kwasu azotowego() w stosunku objętościowym równym ; roztwarza prawie wszystkie metale (w tym złoto)
substancje, które mają zdolność do pochłaniania wilgoci z powietrza
rozpad związku chemicznego na jony (tak jak w przypadku kwasów) lub uwolnienie jonów ze struktury kryształu jonowego (tak jak w przypadku wodorotlenków) pod wpływem rozpuszczalnika o budowie polarnej; w niniejszym materiale wspomnieliśmy o dysocjacji elektrolitycznej kwasów pod wpływem cząsteczek rozpuszczalnika polarnego, jakim jest woda
substancje, które zmieniają barwę w roztworach o różnym odczynie
Ćwiczenia
Uczeń wykonał opisane poniżej doświadczenie:
Próbkę pewnej substancji X, występującej (w temperaturze pokojowej) w stałym stanie skupienia, wprowadził do do probówki z wodą destylowaną. Następnie do zawartości probówki dodał kilka kropel wodnego roztworu oranżu metylowego. Stwierdził, że zawartość probówki zabarwiła się na czerwono.
Oblicz skład procentowy kwasu fosforowego (w procentach masowych).
Uczeń przeprowadził doświadczenie zilustrowane na poniższym schemacie:
Uczeń przeprowadził doświadczenie, polegające na dodaniu do sześciu probówek z wodą destylowaną z dodatkiem oranżu metylowego różnych substancji:
tlenku krzemu
tlenku magnezu
tlenku fosforu
tlenku azotu
tlenku azotu
tlenku siarki
Wskaż numery probówek, w których uczeń odnotował zmianę zabarwienia roztworu z żółtopomarańczowego na czerwone, a następnie uzupełnij podane poniżej równania reakcji.
probówka 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. : 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. }
próbówka 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. : 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
probówka 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. : 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. , 10. , 11. , 12. , 13.
Bibliografia
Encyklopedia PWN
Zegar A., Pac B., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2019.
Zegar A., Pac B., Reakcje w roztworach wodnych w teorii i zadaniach, Kraków 2020.