Obliczanie mas cząsteczkowych
Cząsteczki mają niezmiernie małe masy, dlatego – podobnie jak masy atomów – wyraża się je w atomowych jednostkach masy. Masa cząsteczek zależy od masy atomów, które wchodzą w ich skład. Do określania masy cząsteczkowej niezbędna jest znajomość wzoru związku chemicznego. Na jego podstawie można także ustalić udział każdego pierwiastka w całej masie związku chemicznego.
definicję atomowej jednostki masy;
obliczać masę cząsteczkową prostych związków chemicznych;
określać stosunki masowe pierwiastków w związkach chemicznych;
ustalać masowy skład procentowy związku chemicznego.
1. Co to jest masa atomowa pierwiastka?
Masa atomu jest bardzo mała, stanowi tylko niewielką część grama (około ). Wyraża się ją w atomowych jednostkach masy, zwanych unitami. Wartość jednego unitu wynosi . Aby uświadomić sobie jak mała jest to liczba, zapiszmy ją w innej notacji:
Czy jesteś w stanie wyobrazić sobie tak małą liczbę? Atomy danego pierwiastka mogą różnić się masą z uwagi na możliwość występowania odmian tego pierwiastka, różniących się liczbą neutronów w jądrze – są to izotopy. Masa atomowa pierwiastka jest zatem średnią ważoną jego mas izotopowych. Przy jej obliczaniu uwzględniamy zawartość procentową izotopów danego pierwiastka. Średnie masy atomowe pierwiastków są podane w układzie okresowym.
Masa atomowa jest niepowtarzalną cechą pierwiastka i nie ma dwóch pierwiastków, które miałyby jednakową jej wartość. Dlatego też znając tylko masę atomową, można zidentyfikować pierwiastek.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/b/PvHvxXwdf
Korzystając z układu okresowego, odszukaj pierwiastki o masach atomowych: 32 u, 23 u, 4 u i 40 u, a następnie podaj ich nazwy oraz symbole chemiczne.
2. Jak obliczamy masę cząsteczkową związku chemicznego?
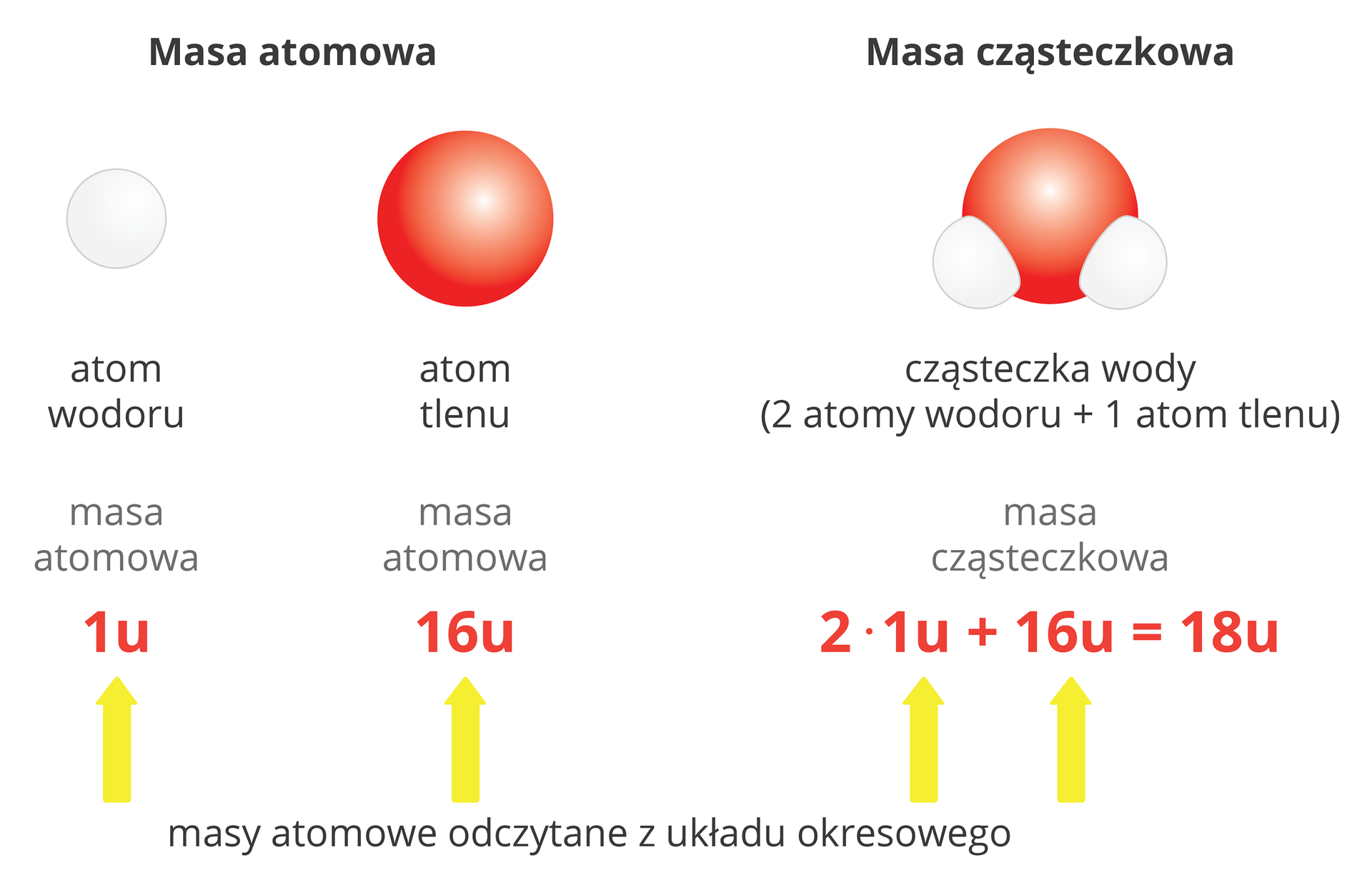
Związki chemiczne są zbudowane z cząsteczek lub tworzą sieci krystaliczne, w których jony występują w określonym stosunku ilościowym. Wzór sumaryczny zwykle odpowiada najprostszemu stosunkowi stechiometrycznemu atomów lub jonów tworzących związek chemiczny. Masa tych najmniejszych struktur związków chemicznych, wyrażona w atomowych jednostkach masy, jest nazywana masą cząsteczkowąmasą cząsteczkową. Mimo tego, że w nazwie tej występuje wyraz „cząsteczkowa”, to jednak jej zakres nie ogranicza się tylko do związków cząsteczkowych, ale obejmuje także substancje zbudowane z jonów. Masa cząsteczkowa jest sumą iloczynów masy atomowej danego pierwiastka i liczby atomów tego pierwiastka w związku chemicznym.
Masę atomową poszczególnych pierwiastków można odczytać z układu okresowego. Jest ona zazwyczaj wyrażona liczbą niecałkowitą, z kilkoma cyframi po przecinku. W obliczeniach chemicznych masy atomowe zaokrągla się zazwyczaj do liczb całkowitych.
Dokonując przybliżeń, trzeba kierować się pewnymi zasadami:
1. Jeśli pierwsza cyfra po przecinku jest mniejsza od 5, to odrzucamy wszystkie cyfry znajdujące się za przecinkiem, na przykład:
2. Jeśli cyfra znajdująca się jako pierwsza po przecinku jest większa od 5, to zwiększamy cyfrę odpowiadającą jedności o 1, na przykład:
3. Dla np. chloru pierwsza cyfra po przecinku wynosi 5 (ich mas atomowych nie zaokrągla się do liczb całkowitych).

Film dostępny pod adresem /preview/resource/RGTxzIE8m46sj
W filmie ukazano, w jaki sposób obliczyć masę cząsteczkową chlorowodoru, wykorzystując układ okresowy pierwiastków.
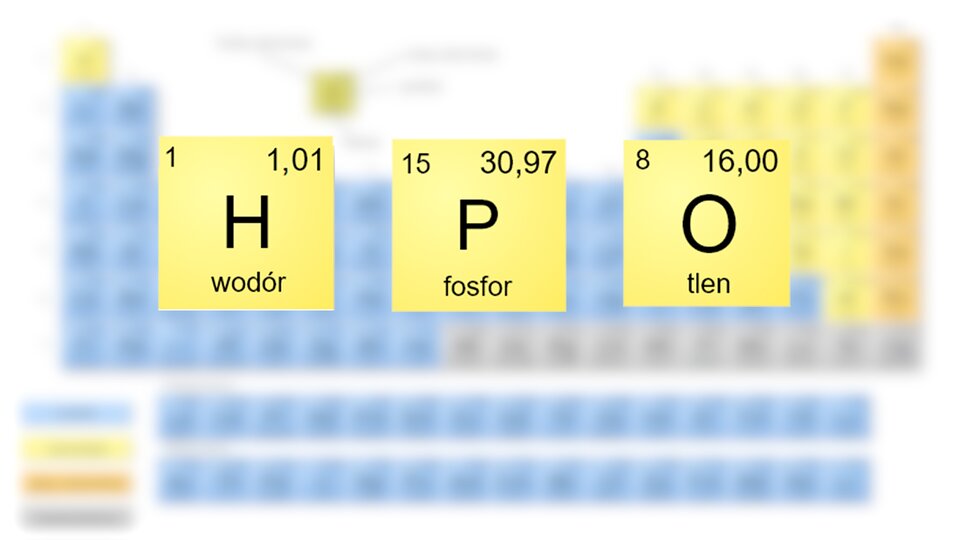
Film dostępny pod adresem /preview/resource/RNQXFuYzXsD2I
W filmie ukazano, w jaki sposób obliczyć masę cząsteczkową kwasu fosforowego(V), wykorzystując układ okresowy pierwiastków.
Wzór sumaryczny | Nazwa związku | Wyrażenie na masę cząsteczkową związku | Wartość |
chlorek sodu | 58,5 | ||
chlorek glinu | 133,5 | ||
metan | 16 | ||
kwas siarkowy(VI) | 98 | ||
sacharoza | 342 | ||
wodorotlenek magnezu | 58 |
3. Kiedy posługujemy się pojęciem masy cząsteczkowej pierwiastka chemicznego?
Niektóre pierwiastki chemiczne, takie jak: wodór, azot, tlen, fluor, chlor, brom czy jod, występują w postaci cząsteczek dwuatomowych. Inne w postaci cząsteczek cztero- lub ośmioatomowych, np. fosfor czy siarka. Określając ich masę, posługujemy się pojęciem masy cząsteczkowej pierwiastkamasy cząsteczkowej pierwiastka. Masa cząsteczkowa pierwiastka chemicznego jest iloczynem jego masy atomowej i liczby atomów tworzących cząsteczkę.
Na przykład masa cząsteczkowa azotu zbudowanego z cząsteczek dwuatomowych, o wzorze , wynosi:
Nazwa pierwiastka | Wzór sumaryczny cząsteczki | Obliczenia masy cząsteczkowej | Masa cząsteczkowa [u] |
azot | 28 | ||
tlen | 32 | ||
fluor | 38 | ||
chlor | 71 | ||
brom | 160 | ||
jod | 254 | ||
fosfor | 124 | ||
siarka | 256 |
4. Jak obliczamy stosunek liczby atomów poszczególnych pierwiastków w związku chemicznym?
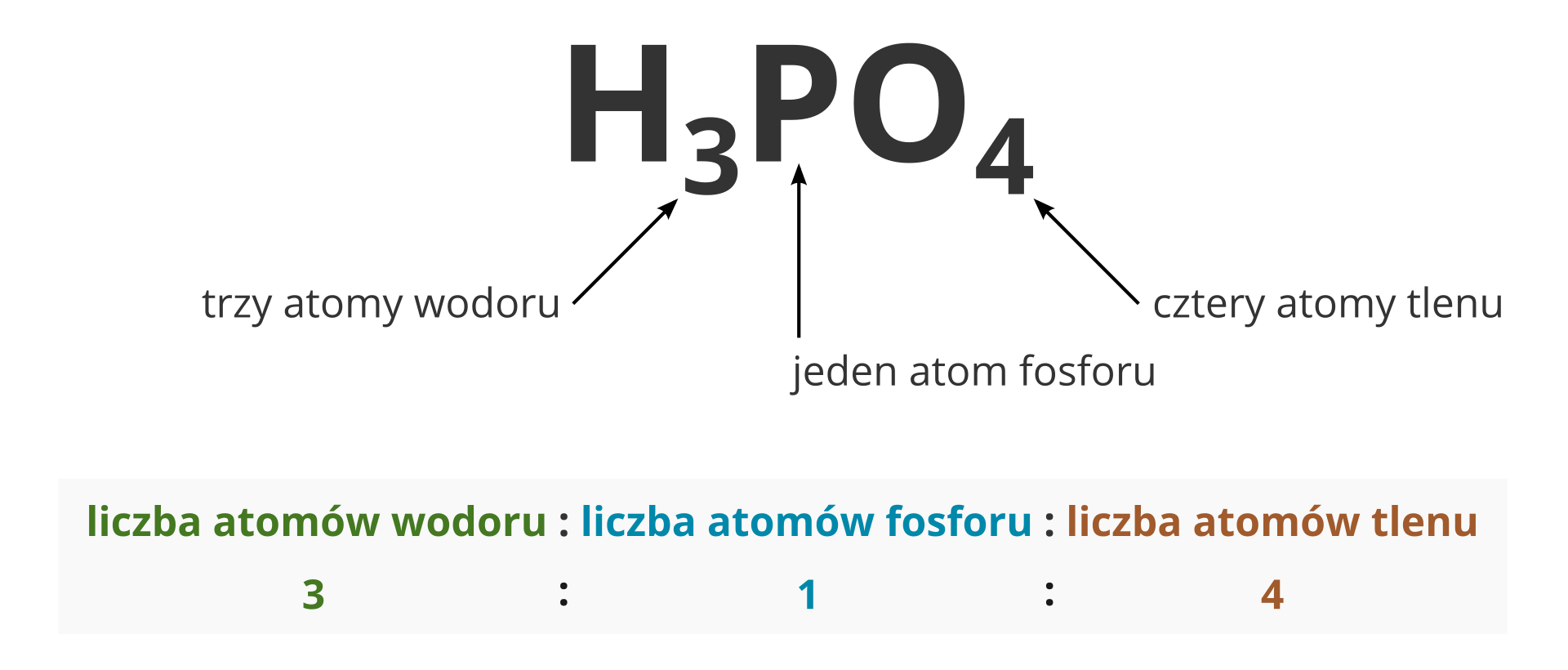
Na podstawie wzoru sumarycznego związku chemicznego można określić wzajemny stosunek liczby atomów (lub jonów) poszczególnych pierwiastków tworzących ten związek. Na przykład w chlorowodorze, o wzorze sumarycznym , na jeden atom wodoru przypada jeden atom chloru. Stosunek liczby atomów wodoru do liczby atomów chloru równy jest 1 : 1. W przypadku wody, której wzór sumaryczny jest następujący: , stosunek liczby atomów wodoru do liczby atomów tlenu wynosi 2 : 1.
Wzór | Nazwa związku | Rodzaj stosunku liczbowego* | Stosunek liczby atomów lub jonów tworzących związek |
chlorek sodu | |||
chlorek glinu | |||
kwas siarkowy(VI) | |||
sacharoza | |||
*Czasami posługujemy się pojęciem atomu w opisie stosunku liczbowego, niezależnie od rodzaju związku chemicznego (kowalencyjny czy jonowy). | |||
5. Jak obliczamy stosunek masowy poszczególnych pierwiastków w związku chemicznym?
Wzór sumaryczny związku chemicznego zawiera informacje o tym, jakie pierwiastki wchodzą w jego skład oraz w jakich stosunkach ilościowych pierwiastki łączą się ze sobą. Mając taką wiedzę, łatwo obliczyć stosunek masowy poszczególnych pierwiastkówstosunek masowy poszczególnych pierwiastków.
Wielkość ta jest określana jako stosunek mas atomów poszczególnych pierwiastków wchodzących w skład związku chemicznego. W cząsteczce chlorowodoru, o wzorze sumarycznym , występuje jeden atom wodoru o masie atomowej 1 u i jeden atom chloru o masie atomowej 35,5 u. Stosunek masowy wodoru do chloru w cząsteczce chlorowodoru wynosi zatem 1 : 35,5.
W związku o wzorze ogólnym:
stosunek masowy jest następujący:
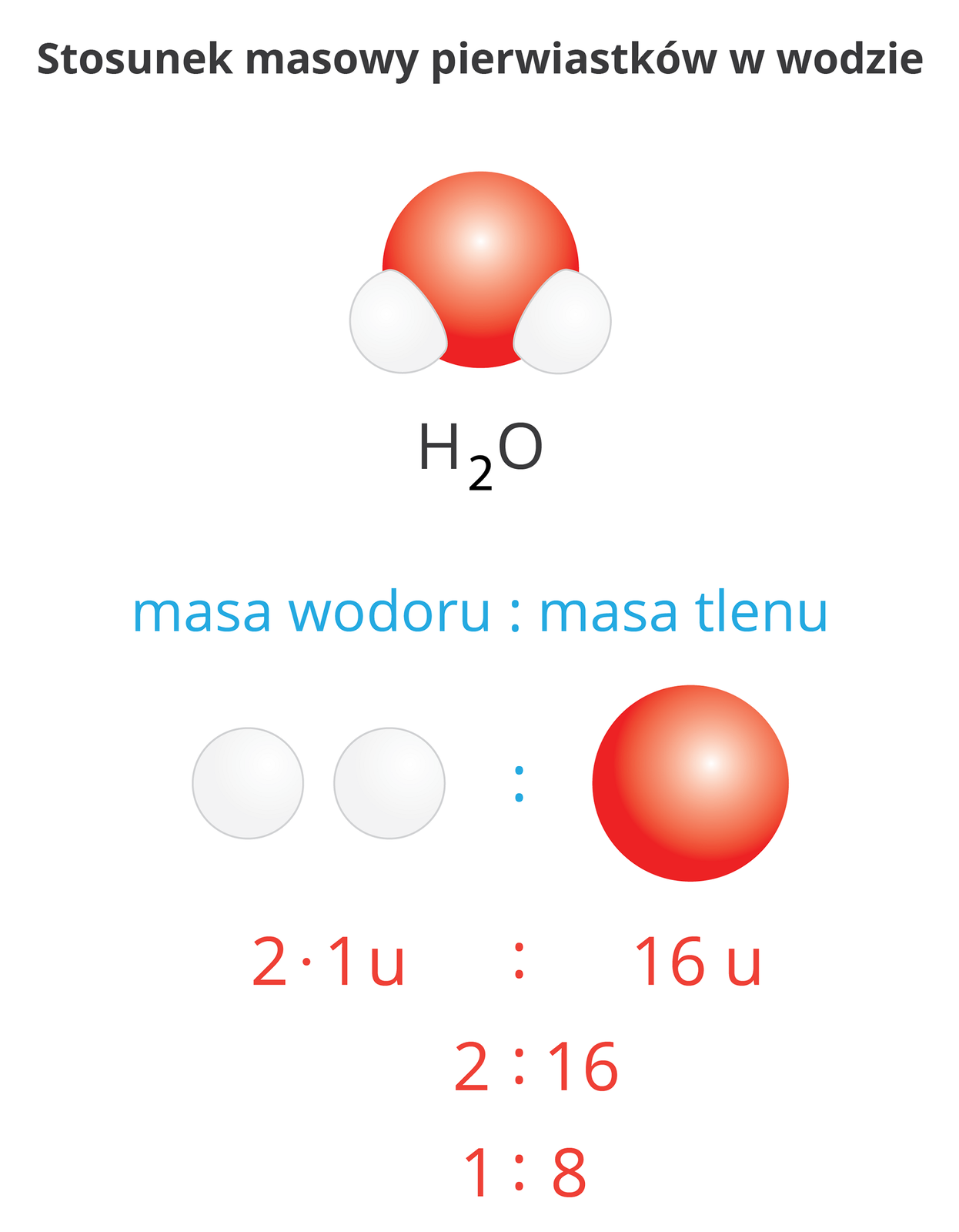
Wzór chemiczny związku | Nazwa związku | Wyrażenie na stosunek masowy | Stosunek masowy |
chlorek sodu | |||
chlorek glinu | |||
kwas siarkowy(VI) | |||
sacharoza |
Podaj stosunek masowy pierwiastków w związku chemicznym o wzorze .
6. Jak obliczamy procentową zawartość pierwiastka w związku chemicznym?
Masowa zawartość procentowa pierwiastka w związku chemicznymMasowa zawartość procentowa pierwiastka w związku chemicznym to stosunek masy atomów tego pierwiastka (wyrażonej w unitach) w najmniejszej części związku chemicznego do masy cząsteczkowej związku, pomnożony przez 100 %. Za najmniejszą część związku chemicznego, w przypadku związków kowalencyjnych, uważa się cząsteczkę, a w związkach o budowie jonowej – najmniejszy zbiór powtarzających się jonów.
Zawartość procentową pierwiastka w związku chemicznym oblicza się według następującego wzoru:
gdzie:
Zawartość procentowa to zatem udział masowy, jaki ma dany pierwiastek w całej masie związku chemicznego. Dlatego czasami wielkość ta jest nazywana procentową zawartością masową. Gdy podane są zawartości procentowe wszystkich pierwiastków tworzących związek, wtedy mówimy o procentowym składzie związku chemicznego.
Jaka jest procentowa zawartość wodoru i chloru w cząsteczce chlorowodoru o wzorze ?
Wzór sumaryczny chlorowodoru | |
Stosunek liczby atomów wodoru do liczby atomów chloru | |
Masa cząsteczkowa chlorowodoru | 36,5 u |
Procentowa zawartość wodoru | |
Procentowa zawartość chloru | |
Suma zawartości procentowych wodoru i chloru |
Suma zawartości procentowej wszystkich pierwiastków wchodzących w skład związku chemicznego jest zawsze równa 100 %. To oznacza, że nie znając zawartości procentowej jednego pierwiastka wchodzącego w skład związku, można ją łatwo obliczyć na podstawie znajomości tej wartości dla pozostałych składników tego związku.

Film dostępny pod adresem /preview/resource/ROXUNTh9pWZBI
Nagranie prezentuje, w jaki sposób obliczyć skład procentowy tlenku krzemu(IV), korzystając z informacji zawartych w układzie okresowym pierwiastków.
Oblicz, jaka jest masowa zawartość procentowa tlenu w pewnym tlenku żelaza, jeśli masowa zawartość procentowa żelaza w tym związku wynosi 78 %.
Wzór związku chemicznego | Nazwa związku chemicznego | Wyrażenie na procentową zawartość tlenu | Procentowa zawartość tlenu [%] |
tlenek magnezu | 40,0 | ||
tlenek siarki(IV) | 50,0 | ||
tlenek siarki(VI) | 60,0 | ||
kwas siarkowy(IV) | 58,5 | ||
kwas siarkowy(VI) | 65,3 |
Ustal, jaki pierwiastek chemiczny kryje się pod literą , jeżeli wiadomo, że masa cząsteczkowa jego tlenku, o wzorze , wynosi 108 u.
Podsumowanie
Na podstawie wzoru sumarycznego związku chemicznego można obliczyć jego masę cząsteczkową, stosunek masowy poszczególnych pierwiastków chemicznych wchodzących w jego skład oraz masową zawartość procentową tych pierwiastków.
Masa cząsteczkowa związku chemicznego jest równa sumie mas atomów pierwiastków wchodzących w skład cząsteczki (jeśli związek jest kowalencyjny) lub najmniejszego zbioru powtarzających się jonów (jeśli związek ma budowę jonową). Wyraża się ją w atomowych jednostkach masy.
Stosunek mas poszczególnych pierwiastków tworzących związek chemiczny nazywany jest stosunkiem masowym pierwiastków w związku.
Udział masowy pierwiastka w związku chemicznym jest nazywany zawartością procentową. Można ją obliczyć ze stosunku masy atomów pierwiastka w najmniejszej strukturze związku chemicznego do masy cząsteczkowej związku, pomnożonego przez 100 %. Najmniejszą częścią związku kowalencyjnego są cząsteczki, natomiast związku o budowie jonowej – najmniejszy zbiór powtarzających się jonów.
Uszereguj podane związki chemiczne według rosnących mas cząsteczkowych: , , .
Uszereguj podane poniżej związki chemiczne według rosnących mas cząsteczkowych.
Oblicz, w którym z wymienionych związków procentowa zawartość żelaza jest największa: , , .
Słownik
masa cząsteczki pierwiastka chemicznego (występującego w warunkach normalnych w postaci cząsteczek, a nie pojedynczych atomów) wyrażona w atomowych jednostkach masy
masa cząsteczki (związek kowalencyjny) bądź najmniejszego zbioru powtarzających się jonów o przeciwnych znakach (związek jonowy), wyrażona w atomowych jednostkach masy
stosunek mas poszczególnych pierwiastków wchodzących w skład związku chemicznego
udział masowy danego pierwiastka w związku chemicznym; stosunek masy atomów pierwiastka w najmniejszej strukturze związku chemicznego do masy cząsteczkowej związku, pomnożony przez 100 %; za najmniejszą część związku chemicznego uważa się cząsteczkę (w przypadku związków kowalencyjnych) bądź najmniejszy zbiór powtarzających się jonów (w związku o budowie jonowej)
Ćwiczenia
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Masa cząsteczkowa pierwiastka lub związku chemicznego jest równa różnicy mas atomowych pierwiastków tworzących daną cząsteczkę. | □ | □ |
| Skład procentowy związku chemicznego to wyrażony w procentach stosunek masy pierwiastka w cząsteczce do masy całej cząsteczki. | □ | □ |
| Zawartość procentowa tlenu w tlenkach wszystkich pierwiastków jest taka sama. | □ | □ |
| Masa cząsteczkowa pierwiastka jest zawsze większa od jego masy atomowej. | □ | □ |
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| W przypadku pierwiastków do opisu ich masy można zamiennie stosować wyrażenia: „masa cząsteczkowa pierwiastka” lub „masa atomowa pierwiastka”. | □ | □ |
| Masę cząsteczkową związku jonowego oblicza się, sumując masy atomowe wszystkich pierwiastków wchodzących w skład najmniejszego zbioru powtarzających się jonów, pomnożone przez ich liczbę w tym zbiorze. | □ | □ |
| Masę atomową pierwiastków wyraża się w gramach. | □ | □ |
| Masę cząsteczkową wyraża się w atomowych jednostkach masy. | □ | □ |
| Skład procentowy związku chemicznego określa zawartość procentową poszczególnych pierwiastków w związku chemicznym. | □ | □ |
Połącz nazwy substancji z wartościami ich masy cząsteczkowej.
gazowy chlor, tlenek wapnia, fluor, tlenek węgla(IV)
| 71 u | |
| 44 u | |
| 38 u | |
| 56 u |
Wskaż zapis określający stosunek liczby atomów węgla do liczby atomów tlenu w tlenku węgla(II).
- 1 : 1
- 1 : 2
- 2 : 1
- 12 : 16
- 3 : 4
Wskaż zapis określający stosunek liczby atomów glinu do liczby atomów tlenu w tlenku glinu.
- 2 : 3
- 3 : 2
- 1 : 1
- 27 : 16
- 1 : 2
- 2: 1
Wskaż zapis określający stosunek masowy siarki do tlenu w tlenku siarki(VI).
- 2 : 3
- 1 : 3
- 1 : 1
- 32 : 16
- 4 : 1
Wskaż zapis określający stosunek masowy tlenu do chloru w tlenku chloru(VII).
- 112 : 71
- 2 : 7
- 16 : 35,5
- 7 : 2
- 32 : 71
Wskaż zapis składu procentowego amoniaku – związku o wzorze: .
-
– 82,35%
– 17,65% -
– 25,00%
– 75,00% -
– 14,00%
– 1,00% -
– 93,33%
– 66,67%
Wskaż zapis składu procentowego związku o wzorze: .
-
– 26,53%
– 35,37%
– 38,10% -
– 18,20%
– 18,20%
– 64,60% -
– 36,40%
– 48,60%
– 15,00% -
– 36,45%
– 48,60%
– 14,95%
Masa cząsteczkowa tlenku pewnego metalu o wzorze wynosi 102 u. Wykonaj odpowiednie obliczenia i wskaż pierwiastek, który kryje się pod symbolem .
Masa cząsteczkowa tlenku pewnego dwuwartościowego metalu wynosi 56 u. Wykonaj odpowiednie obliczenia i wskaż wzór tego tlenku.
Bibliografia
Kulawik J., Kulawik T., Litwin M., Podręcznik do chemii dla klasy siódmej szkoły podstawowej; Warszawa 2020.
Łasiński D., Sporny Ł., Strutyńska D., Wróblewski P., Podręcznik dla klasy siódmej szkoły podstawowej; Kielce 2020.