Odczyn roztworów
Reklamy środków higieny jamy ustnej informują, że aby przywrócić prawidłowy odczyn (pH) śliny, należy myć zęby lub żuć gumę po każdym posiłku. Z innych reklam dowiadujemy się, że idealne do delikatnej skóry jest mydło o pH równym 5,5. Co to jest pH i o czym informuje? Jaki jest zakres skali pH? Czy pH = 5,5 to mało, czy dużo? Jak można zmierzyć pH?

w jaki sposób zdefiniować pojęcia kwas, wodorotlenek i zasada;
czym są wskaźniki kwasowo‑zasadowe i jakie jest ich zabarwienie w wodzie, w zasadach i kwasach;
w jaki sposób wyjaśnić pojęcie dysocjacji elektrolitycznej.
objaśniać, czym są odczyn roztworu oraz skala pH;
wyznaczać wartości pH badanych próbek.
1. Odczyn roztworu – skala pH
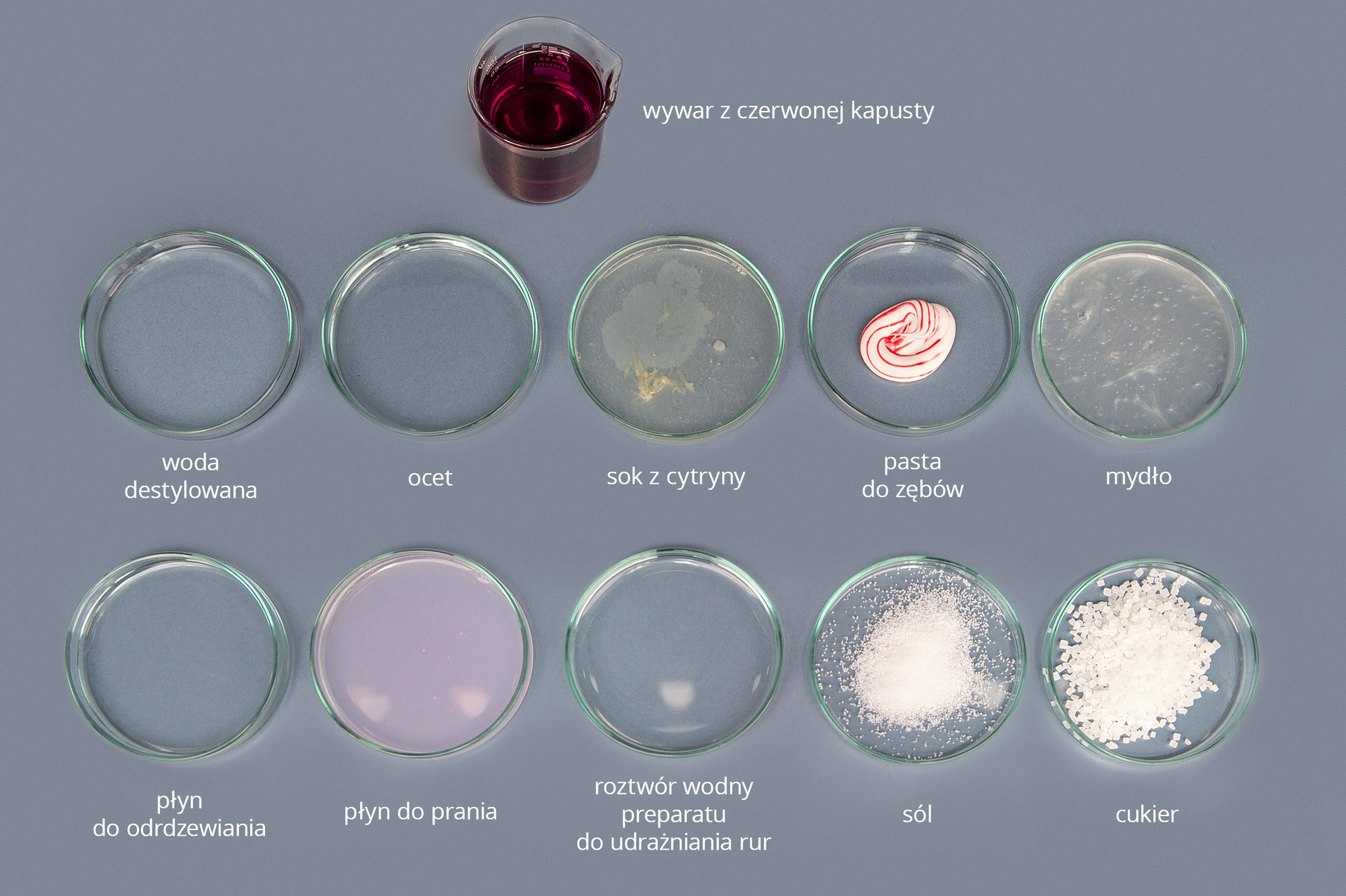
Jaki odczyn mają wybrane produkty z najbliższego otoczenia?
Produkty z najbliższego otoczenia mają różny odczyn.
wywar z czerwonej kapusty,
ocet,
sok z cytryny,
pasta do zębów,
mydło,
płyn do odrdzewiania,
płyn do prania,
roztwór wodny preparatu do udrożniania rur,
sól kamienna,
cukier,
woda destylowana,
10 szalek Petriego.
Na pięć kolejnych szalek Petriego wlej: wodę destylowaną, ocet i sok z cytryny oraz roztwór: płynu do odrdzewiania, płynu do prania, płynu do udrożniania rur.
Sporządź zawiesinę pasty do zębów w wodzie i umieść ją na szalce Petriego.
Sporządź wodne roztwory: mydła, soli kamiennej, cukru i wlej je na szalki Petriego.
Do każdej próbki dodaj kilka kropli wywaru z czerwonej kapusty.
Obserwuj zachodzące zmiany.
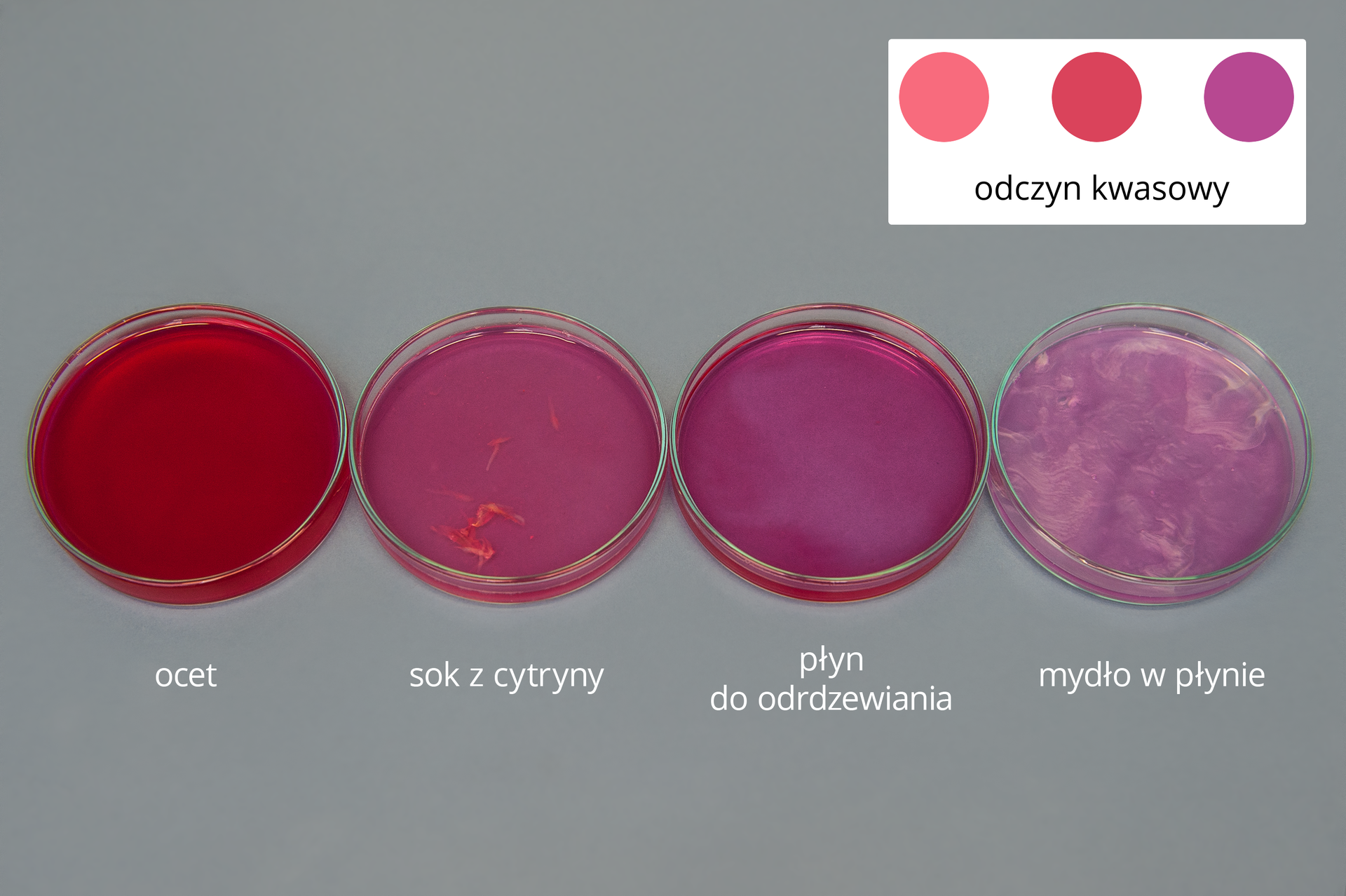
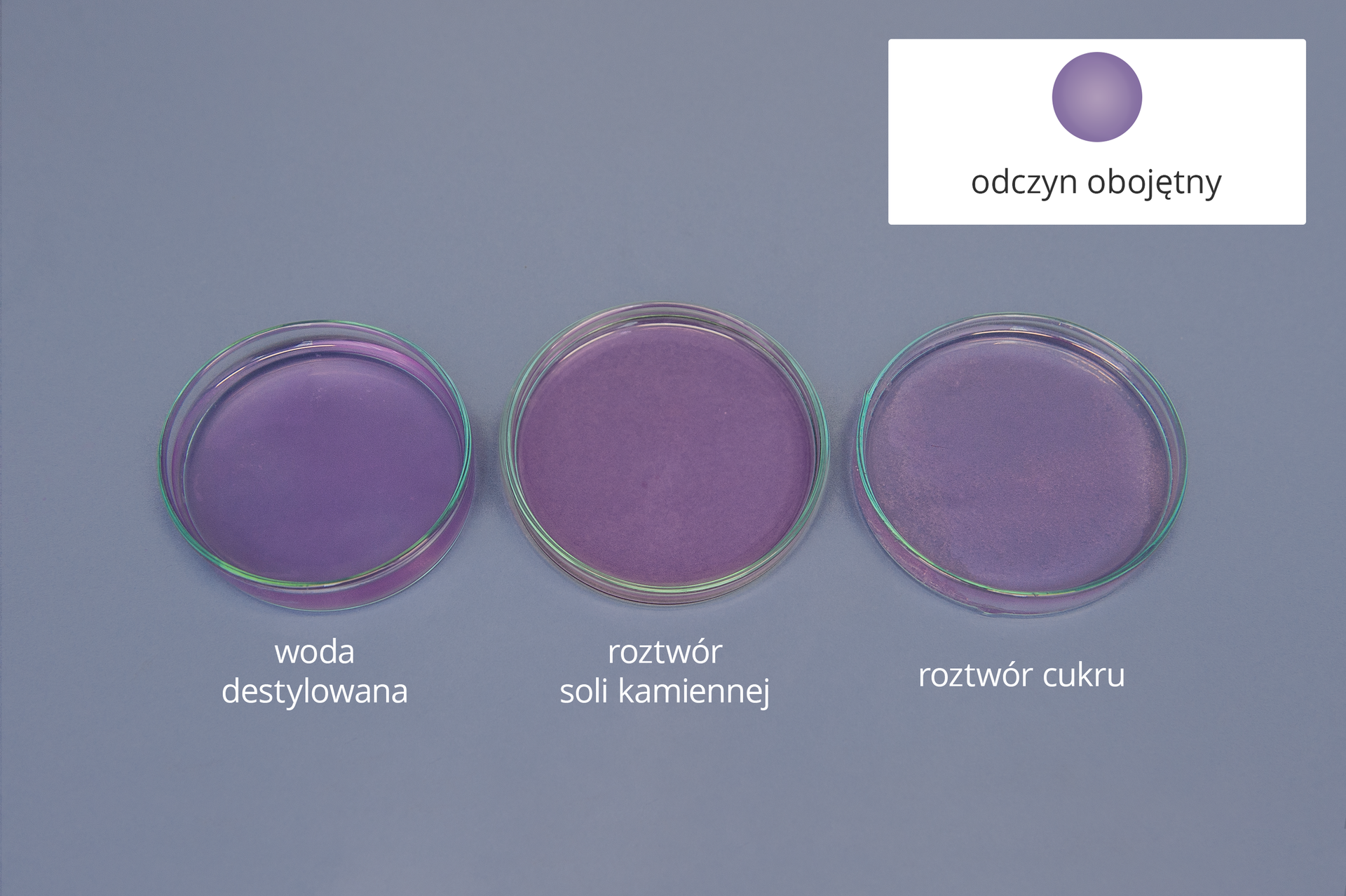
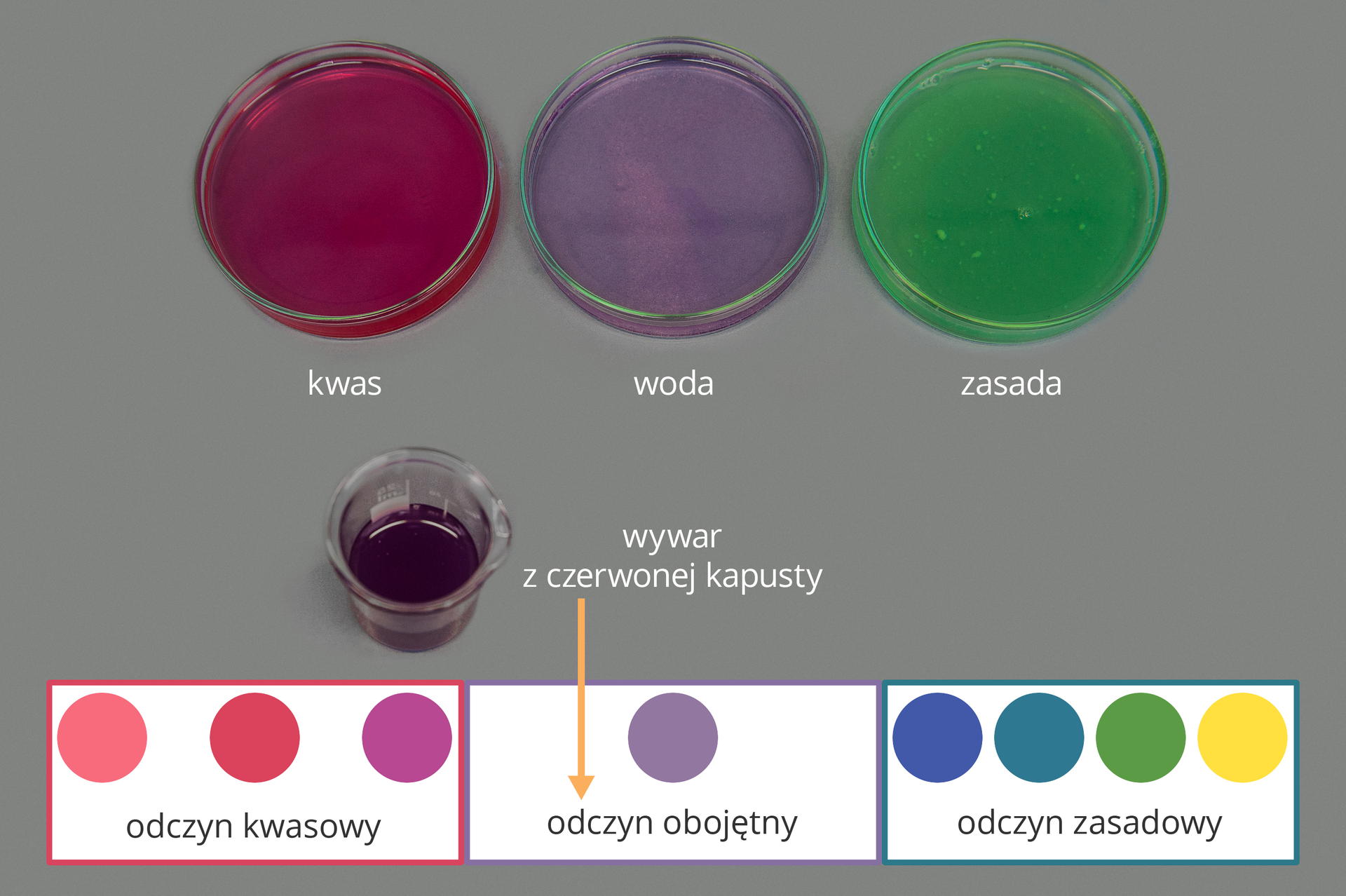
Ocet, sok z cytryny, mydło w płynie, płyn do odrdzewiania mają odczyn kwasowy. Woda destylowana, roztwór soli kamiennej i roztwór cukru wykazują odczyn obojętny; natomiast tradycyjne mydło, pasta do zębów, płyn do prania, płyn do udrażniania rur – odczyn zasadowy.
Obecne w kwasach kationy wodoru powodują zmianę barwy wskaźnika – wywaru z czerwonej kapusty – z fioletowej na czerwoną. W roztworach wodorotlenków (zasad) znajdują się aniony wodorotlenkowe , które wywołują zmianę barwy wywaru z kapusty z fioletowej na zieloną.
Uniwersalne papierki wskaźnikowe w środowisku kwasowym barwią się na czerwono, a w zasadowym – na zielono lub niebiesko.
Miarą kwasowości i zasadowości roztworu jest skala pHskala pH. Przyjmuje ona wartości 0–14.
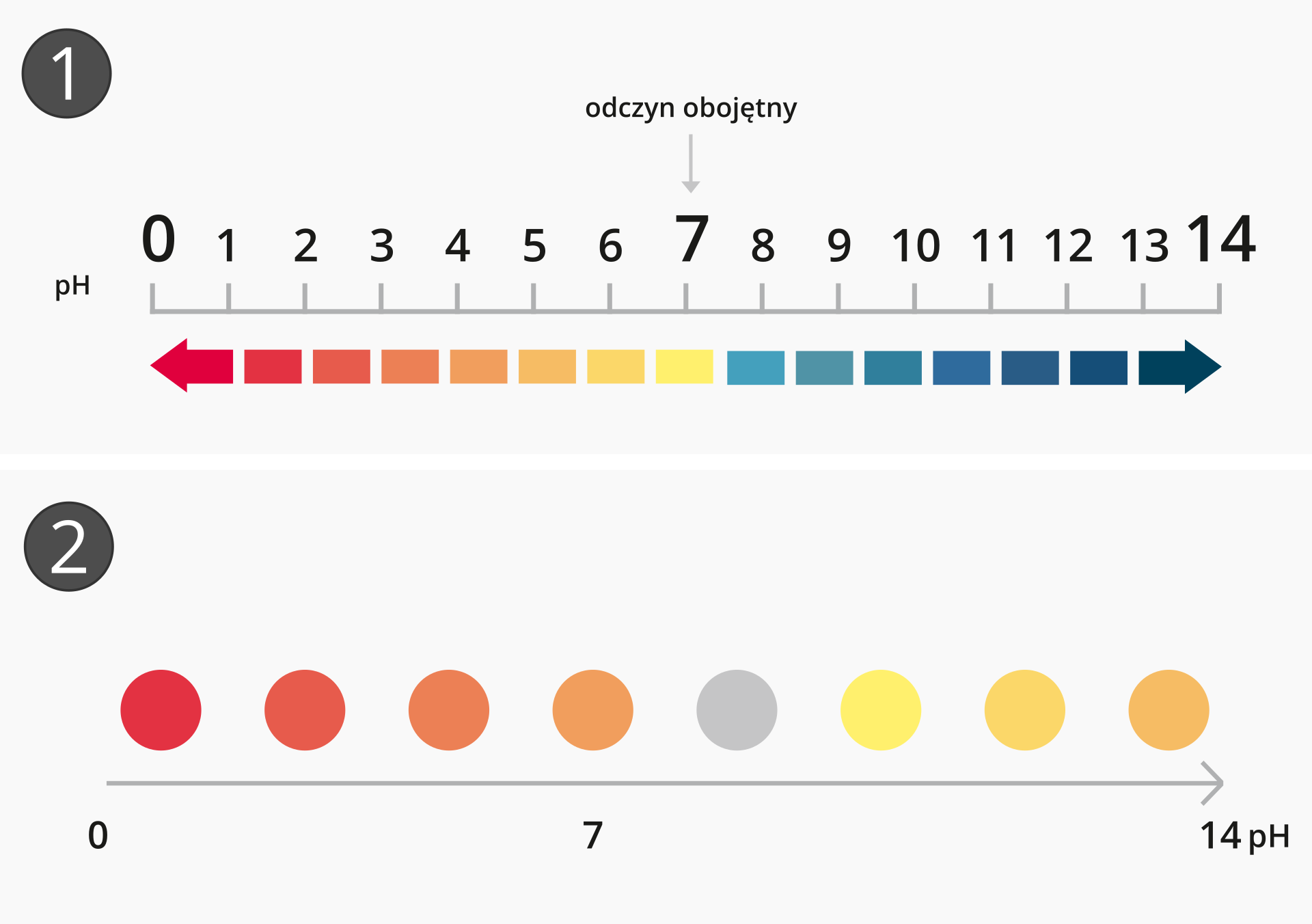
pH < 7 odczyn kwasowy;
pH = 7 odczyn obojętny;
pH > 7 odczyn zasadowy.

Skala pH została wprowadzona na początku XX wieku przez Sørena Sørensena (czyt. sorena sorensena). Zmiana pH o 1 jednostkę powoduje 10‑krotną zmianę kwasowości/zasadowości, a zmiana o 2 jednostki – 100‑krotną zmianę kwasowości/zasadowości.
*Symbol „p” jednostki pH pochodzi od łacińskiego potentio = potęga, zaś „H” jest symbolem chemicznym wodoru, dlatego ma postać wielkiej litery.
Wzrokowe porównanie barwy wskaźników ze wzorcem, np. barwną skalą pH na opakowaniu, pozwala jedynie na przybliżone określenie odczynu roztworu. Do dokładnego wyznaczenia wartości pH roztworu służy m.in. przyrząd zwany pehametrem. Jest on stosowany w laboratoriach chemicznych, medycznych, rolnictwie czy kosmetologii.
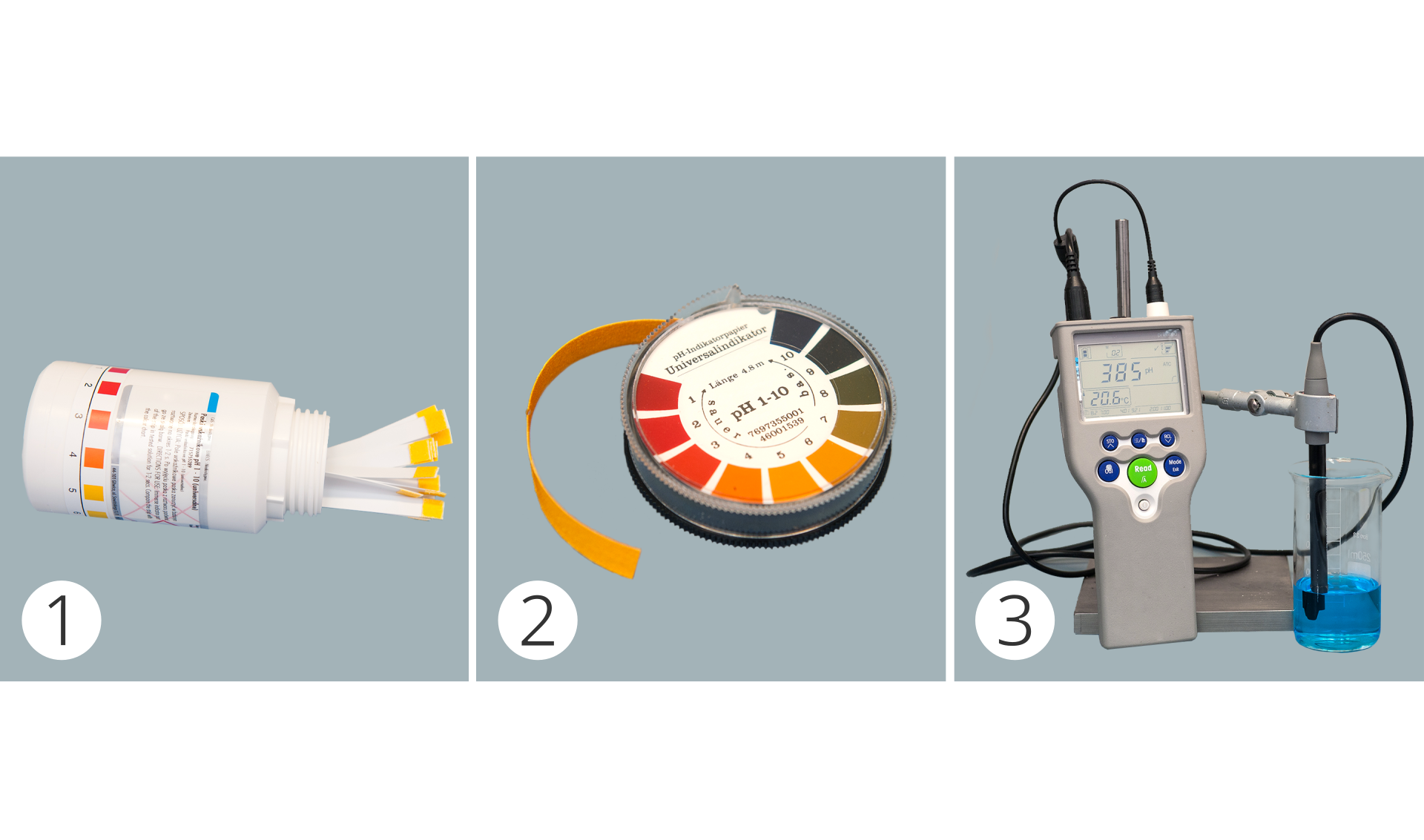
Pehametr składa się z czujnika zwanego elektrodą, którą zanurza się w badanym roztworze, i wyświetlacza, z którego odczytuje się wartość liczbową pH. Niektóre pehametry są wyposażone w termometry, ponieważ temperatura ma wpływ na pomiar.
Do badania odczynu może być stosowany także tzw. wskaźnik uniwersalnywskaźnik uniwersalny, który jest mieszaniną kilku wskaźników. Zmienia on barwę przy różnych wartościach pH. W kwasach przyjmuje barwę czerwoną, a w zasadach – barwy od zielonej do niebieskiej.
Do badania pH gleby – w celu określenia jej przydatności i określenia sposobu jej nawożenia – możemy użyć kwasomierza glebowego. Jest to zestaw składający się z płynu Helliga (odpowiednio dobranej kompozycji wskaźników), ceramicznej płytki ze skalą oraz łyżeczki.
Pomiar polega na obserwacji i ocenie zmiany barwy płynu Helliga.
Sposób pomiaru:
Za pomocą łyżeczki włóż niewielką ilość gleby do wgłębienia w płytce kwasomierza.
Dodawaj kroplami płyn Helliga aż do całkowitego zwilżenia gleby i utworzenia cienkiej warstwy płynu nad glebą.
Po około 2–3 minutach przechyl płytkę tak, aby płyn wskaźnikowy znalazł się w podłużnym kanaliku.
Barwę płynu porównaj ze skalą i odczytaj pH gleby.
R10THXEJDTLpD1  Kwasomierz glebowy
Kwasomierz glebowy
Wzorując się na doświadczeniu 1., zbadaj za pomocą uniwersalnych papierków wskaźnikowych pH produktów spożywczych i środków czystości. Zapisz obserwacje i wnioski.
Porównaj swoje wyniki z przedstawionymi na ilustracji poniżej.

2. Odczyn roztworu w życiu codziennym
Znajomość wartości pH ma duże znaczenie praktyczne, m.in. przy produkcji lekarstw (poza substancją czynną leki zawierają warstwę osłonową, która chroni np. przełyk przed niekorzystnym pH) czy kosmetyków (np. obecnie oferuje się mydła w płynie o odczynie zbliżonym do naturalnego odczynu skóry człowieka – odczyn lekko kwasowy, który ma działanie bakteriobójcze).
Wartość pH gleby decyduje o jej przydatności do uprawy określonych typów roślin. Od odczynu gleby zależą jakość i wysokość plonów. Dla większości roślin pH jest optymalne w zakresie 5,6–7,8, jednak w przypadku każdego gatunku jest to wartość indywidualna.
Roślina | Optymalne pH |
ziemniaki | 4,5–6,0 |
żyto, len | 5,0–6,5 |
ogórek, marchew | 5,5–6,5 |
pomidor, czosnek | 5,5–7,5 |
pszenica, jęczmień, rzepak | 6,0–6,5 |
burak cukrowy, groch, kukurydza | 6,5–7,0 |
drzewa owocowe | 6,5–7,5 |
Płyny ustrojowe w organizmie człowieka mają różne pH, np. sok żołądkowy ma pH = 1,0–1,5, wydzielina trzustki – 7,5–8,8, zaś pH krwi utrzymuje się w granicach 7,35–7,45. Zarówno zbyt niskie, jak i zbyt wysokie pH jest przyczyną wielu chorób. Spadek wartości pH poniżej 6,8 wywołuje tzw. kwasicę, a wzrost powyżej pH 7,45 – zasadowicę. Problem ten może pojawić się podczas uszkodzenia któregoś z narządów odpowiedzialnych za wydalanie toksyn, np. nerek lub płuc, przez co zaczynają one gorzej funkcjonować.
Większość gatunków ryb żyje w wodzie o wartości pH = 6–8. Obniżenie pH wody do poziomu poniżej 5 powoduje nienaturalne zachowanie ryb, polegające na wykonywaniu gwałtownych ruchów, oraz pojawienie się niebieskiego zabarwienia na skórze. Przy pH wyższym niż 8 skóra ryb pokrywa się śluzem, łuski mętnieją, a płetwy strzępią się i odpadają.
Hortensja ogrodowa na glebach bogatych w glin zmienia ubarwienie kwiatów w zależności od kwasowości gleby i przybiera kolor:
intensywnie niebieski przy pH = 4,5,
niebieski przy pH = 5,1,
niebieskoróżowy przy pH = 5,5,
ciemnoróżowy przy pH = 6,5,
różowy przy pH = 6,9,
jasnoróżowy przy pH = 7,4.
RwSigA7MMpAAs1 
Wskaźnik z płatków czerwonej pelargonii
Czerwona pelargonia, podobnie jak czerwona kapusta, może okazać się wygodnym w użyciu wskaźnikiem. W tym celu należy pokrojone płatki zalać gorącą wodą i poczekać 20 minut. Następnie wywar przesączyć przez filtr, np. do kawy, i zachować do badań.

Dobrym wskaźnikiem jest czerwona cebula, która w środowisku kwasowym ma kolor bladoczerwony, zaś w zasadowym – zielony.
Wskaźnikami zapachowymi są cebula i olejek wanilinowy, które w środowisku silnie zasadowym nie wydzielają charakterystycznych zapachów.
Podsumowanie
Miarą kwasowości i zasadowości roztworu jest skala pH, którą ilościowo opisują liczby 0–14.
Roztwór ma odczyn kwasowy, gdy pH < 7.
Roztwór ma odczyn obojętny przy pH = 7.
Roztwór ma odczyn zasadowy, gdy pH > 7.
Im wyższe stężenie jonów wodoru , tym roztwór przyjmuje niższe wartości pH.
Im wyższe stężenie jonów wodorotlenkowych , tym roztwór przyjmuje wyższe wartości pH.
Przygotuj infografikę przedstawiającą skalę pH wraz z naniesionymi wartościami popularnych produktów spożywczych i środków czyszczących.
Uzasadnij wybór uniwersalnego papierka wskaźnikowego jako wskaźnika kwasowo‑zasadowego do odróżnienia wody, zasady i kwasu.
Opisz zastosowanie skali pH.
*Zbadaj pH soku z cytryny i płynu do prania w temperaturze 25 i 15°C. Porównaj otrzymane wartości.
*Zbadaj pH śliny przed posiłkiem, po posiłku oraz po umyciu zębów lub żuciu gumy bez cukru. Otrzymane dane przedstaw w postaci tabeli i wykresu.
Słowniczek
właściwość roztworu wynikająca ze stężenia jonów i w roztworze
ilościowa miara kwasowości i zasadowości roztworu

Søren Sørensen
Duński biochemik. W 1909 r. wprowadził wygodny sposób wyrażenia kwasowości i zasadowości – skalę pH. W latach 1901–1938 był szefem laboratorium Carlsberga w Kopenhadze.
mieszanina kilku wskaźników, która zmienia barwę przy różnych wartościach pH; w kwasach przyjmuje barwę czerwoną, a w zasadach – od zielonej do niebieskiej
substancje, które zmieniają barwę w roztworach o różnym odczynie
Zadania
Uzupełnij luki, wybierając poprawne wyrażenia.
czerwoną, żółtą, malinową, czerwoną, niebieską, fioletową, fioletowoniebieską, czerwoną, bezbarwną, żółtą, żółtopomarańczową, malinową, czerwoną, bezbarwną, zieloną, bezbarwną, żółtą, niebieską, zieloną
Wskaźniki przyjmują różne barwy w zależności od środowiska.
• Uniwersalny papierek wskaźnikowy przyjmuje barwy:
- w kwasie ............................................
- w wodzie ............................................
- w zasadzie ............................................
• Oranż metylowy przyjmuje barwy:
- w kwasie ............................................
- w wodzie ............................................
- w zasadzie ............................................
• Fenoloftaleina przyjmuje barwy:
- w kwasie ............................................
- w wodzie ............................................
- w zasadzie ............................................
• Wywar z czerwonej kapusty przyjmuje barwy:
- w kwasie ............................................
- w wodzie ............................................
- w zasadzie ............................................
Uporządkuj nazwy podanych środków czystości zgodnie z ich malejącą kwasowością.
- płyn do czyszczenia piekarnika pH = 12
- soda oczyszczona pH = 9
- odkamieniacz pH = 3
- mydło pH = 5
- wybielacz pH = 11
- woda z solą kamienną pH = 7
W roztworze o odczynie zasadowym pH przybiera wartości:
- większe od 7.
- mniejsze od 7.
- równe 7.
- od 7 do 14.
- od 0 do 7.
Wskaż, które zdania są prawdziwe, a które – fałszywe.
| Prawda | Fałsz | |
| Jeżeli pH = 5, to znaczy, że roztwór ma odczyn zasadowy. | □ | □ |
| Jeżeli pH = 3, to znaczy, że roztwór ma odczyn kwasowy. | □ | □ |
| Jeżeli pH =7, to znaczy, że roztwór ma odczyn obojętny. | □ | □ |
| Jeżeli pH = 3, to znaczy, że w roztworze jest więcej jonów niż jonów . | □ | □ |
| Jeżeli pH = 9, to znaczy, że w roztworze jest więcej jonów niż jonów . | □ | □ |
Oddana do analizy próbka wody miała pH = 4,5. Oznacza to, że jej odczyn był
- kwasowy.
- zasadowy.
- obojętny.