Odmiany węgla pierwiastkowego
Czy wiesz, że węgiel to niezwykły pierwiastek? Jak to możliwe, że ołówek i najdroższa biżuteria są zbudowane z tego samego pierwiastka? W czym tkwi fenomen najtwardszych minerałów w przyrodzie? Co wspólnego mają węgiel i piłka nożna? Jak sądzisz, czy obiecujące perspektywy zastosowań grafenu mogą okazać się największą przygodą chemiczną XXI wieku?
że chemicy pierwiastkami chemicznymi nazywają substancje proste, np.: , , , ;
że węgiel wchodzi w skład wielu związków nieorganicznych i wszystkich substancji organicznych.
wyjaśniać, na czym polega zjawisko alotropii;
wymieniać odmiany alotropowe węgla, opisywać ich budowę, właściwości i zastosowania;
uzasadniać zależność właściwości i zastosowania diamentu, grafitu, fullerenów, grafenu od ich budowy wewnętrznej;
wymieniać inne pierwiastki, które mogą tworzyć odmiany alotropowe.
1. Pojęcie alotropia
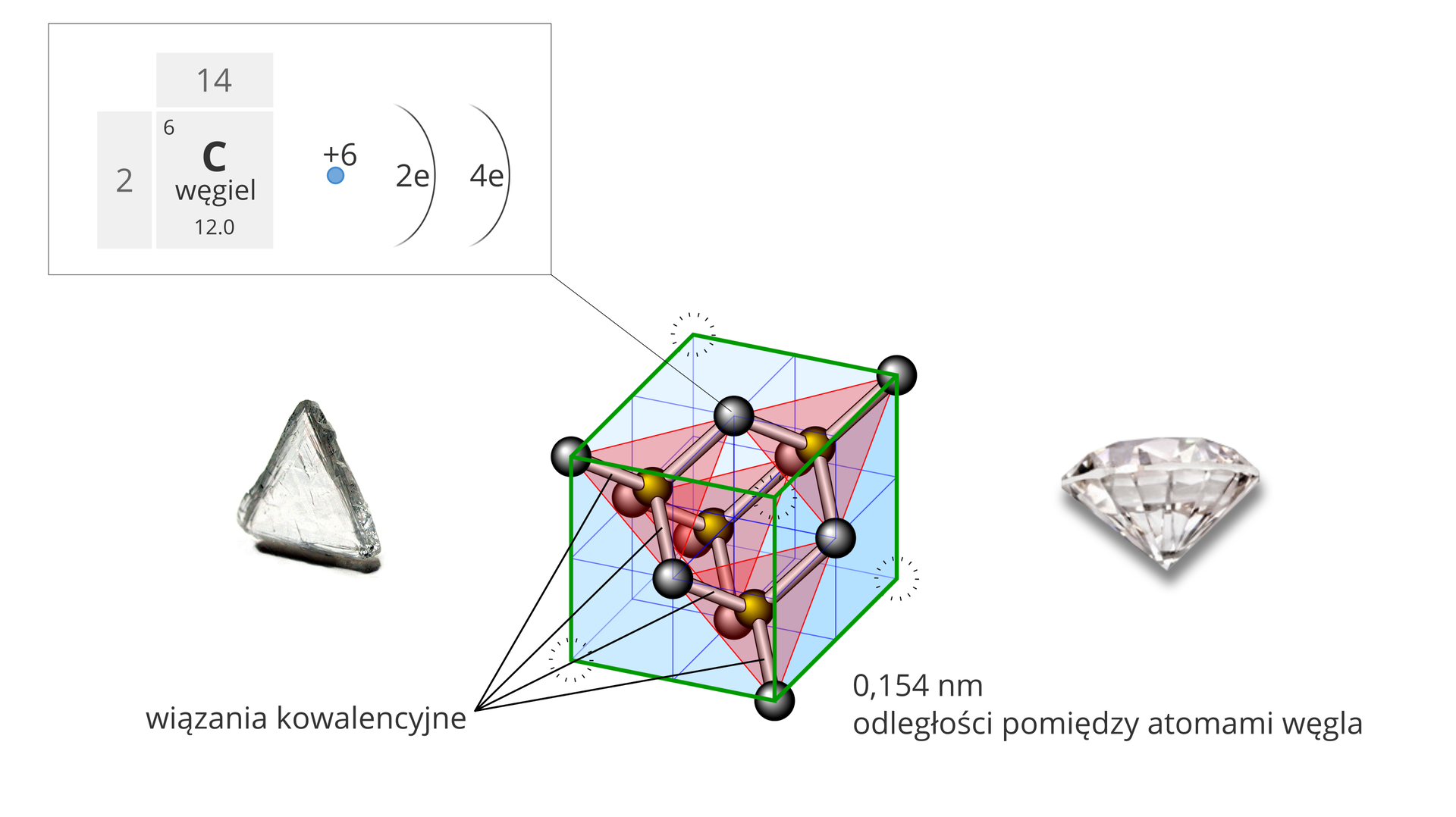
Niektóre pierwiastki chemiczne, głównie niemetale, występują w różnych postaciach, które mają odmienne właściwości fizyczne i różną aktywność chemiczną. Postaci te zwane odmianami alotropowymiodmianami alotropowymi różnią się budową sieci krystalicznej (np. diament, grafit, fullereny, grafen) i liczbą atomów w cząsteczce (np. – ditlen, – tritlen, czyli ozon, – tetratlen, czyli tlen czerwony). To zjawisko nazywa się alotropiąalotropią, od greckiego: allos (inny) i tropos (rodzaj).

2. Grafit – węgiel, którym można pisać
GrafitGrafit tworzy najbardziej stabilną strukturę węgla. Jego sieć zbudowana jest z płaskich warstw ułożonych jedna nad drugą. Każda warstwa przypomina strukturę plastra miodu. Atomy węgla są ułożone w regularne sześciokąty o wspólnych bokach. W obrębie każdej warstwy atomy są połączone silnymi wiązaniami kowalencyjnymi z trzema sąsiednimi atomami tego pierwiastka. Natomiast między warstwami występują tylko słabe oddziaływania (van der Waalsa), dlatego kryształy grafitu są miękkie i łatwo dają się łupać. Odległości między płaszczyznami są niemal 2,5 razy większe niż długości wiązań między atomami węgla w pierścieniach, stąd siła wiązań między warstwami jest mała. Dlatego poszczególne warstwy grafitu stosunkowo łatwo się rozdzielają, co wykorzystujemy za każdym razem, przyciskając ołówek do kartki papieru.

Grafit jest odmianą węgla o czarnoszarej barwie i metalicznym połysku. Jest bardzo miękki (twardość grafitu w skali Mohsa wynosi 1), podatny na ścieranie i łupliwy. Ma doskonałe właściwości smarne, jest tłusty w dotyku i wytrzymały na wysokie temperatury. Wykazuje wysoką odporność mechaniczną na ściskanie i niewielką – na rozciąganie. Ponadto grafit i wyroby grafitowe nie rozpuszczają się w wodzie, charakteryzują się małą aktywnością chemiczną, łatwością składowania i utylizacji oraz brakiem negatywnego wpływu na środowisko. Dzięki tym cechom zyskał on miano materiału nowoczesnego, a zarazem ekologicznego.
Czy grafit przewodzi prąd elektryczny i ciepło?
Grafit to odmiana alotropowa węgla, która przewodzi prąd elektryczny i ciepło.
pręcik grafitowy z baterii,
dioda typu LED,
przewody z zaciskami typu krokodylki,
bateria 9V,
kartka papieru,
ołówek,
palnik spirytusowy,
termometr,
szczypce.
Zbuduj obwód elektryczny składający się z baterii, diody, przewodów elektrycznych zakończonych krokodylkami. Umieść w nim pręcik grafitowy z płaskiej baterii. Sprawdź, czy po zamknięciu obwodu płynie prąd elektryczny.
Na kartce papieru narysuj grubą kreskę ołówkiem (najlepiej miękkim – typu „B”). Na tak narysowanej kresce połóż krokodylki wcześniej zmontowanego obwodu elektrycznego. Czy dioda się zaświeciła?
Jeden koniec pręcika grafitowego umieść w płomieniu palnika i ogrzewaj przez około 2 minuty. Po tym czasie zmierz temperaturą drugiego końca elektrody, przykładając do niego termometr. Zwróć też uwagę na to, jak szybko grafit się ochładza.
Po zamknięciu obwodu elektrycznego dioda się zaświeciła. Prąd popłynął również, gdy w obwodzie umieszczono kartkę papieru z grubą kreską narysowaną ołówkiem. Podczas ogrzewania pręcik szybko stał się ciepły, a po usunięciu źródła ciepła także szybko się ochłodził. Stąd można wysunąć wniosek, że grafit dobrze przewodzi prąd elektryczny i ciepło.

Film dostępny na portalu epodreczniki.pl
Chemik buduje obwód elektryczny, składający się z: baterii, diody, przewodów elektrycznych zakończonych krokodylkami i pręcika grafitowego. Zanim obwód elektryczny zostanie zamknięty chemik myśli, a nad jego głową pojawia się chmurka z informacją (Czy dioda zaświeci się po zamknięciu obwodu elektrycznego?). Chemik zamyka obwód elektryczny, łącząc krokodylek z elektrodą grafitową. Po zamknięciu obwodu dioda zaświeci się. Chemik rysuje na kartce papieru grubą kreskę ołówkiem. W chmurce nad jego głową pojawia się pytanie: Czy grafit jest dobrym, czy słabym przewodnikiem prądu elektrycznego?. Na narysowanej kresce kładzie krokodylki. Dioda znowu się zaświeciła. Chemik pisze na tablicy zdanie o treści: Grafit jest dobrym przewodnikiem prądu elektrycznego. Chemik trzyma pręcik grafitowy szczypcami i jeden jego koniec umieszcza w płomieniu palnika. Ogrzewa go, a po chwili, cały czas ogrzewając pręcik, przykłada termometr do drugiego końca pręcika. Słupek rtęci w termometrze podnosi się. Chemik gasi płomień palnika. Po chwili znowu przykłada termometr do pręcika. Słupek rtęci powoli opada.
Wyjaśnij, dlaczego grafit przewodzi prąd elektryczny.
Co jest nośnikiem prądu elektrycznego w metalach? Z iloma sąsiednimi atomami węgla łączy się każdy atom w strukturze grafitu? Co dzieje się z elektronem walencyjnym węgla, który nie bierze udziału w tworzeniu wiązań kowalencyjnych?
Ten bardzo niepozorny minerał ma różnorodne zastosowanie w życiu codziennym. Już w średniowieczu używano go do pisania i wyrobu tygli stosowanych w pracowniach alchemików. Dzisiaj również piszemy ołówkami, których rysiki są grafitowe i nadal wytwarza się z niego tygle oraz materiały ogniotrwałe (np. cegły, bloki węglowe, betony grafitowe). Ponadto, odmianę tę wykorzystuje się do produkcji: szczotek węglowych, klocków hamulcowych w samochodach, suchych smarów, farb antykorozyjnych, elektrod używanych do elektrolitycznego otrzymywania metali oraz elektrod do produkcji baterii, moderatorów (prętów spowalniających neutrony) w reaktorach atomowych i materiałów konstrukcyjnych, np. kompozytów grafitowych (te znalazły zastosowanie do produkcji rakiet tenisowych i elementów bolidów Formuły 1).

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D8mRW9Ag8
Co wspólnego mają ołów i ołówek?
Dzisiaj mamy wiele różnych przyborów, których używamy do pisania na papierze. W starożytności, kiedy nie znano jeszcze ołówków, Rzymianie, Grecy, Egipcjanie używali do tego celu najczęściej ołowiu i papirusu. Ołów do pisania przestał być używany w 1564 roku. Legenda głosi, że pewnego dnia na północy Anglii straszna burza poprzewracała ogromne drzewa, odkrywając duże pokłady czarnej substancji pod ich korzeniami. Wyglądała ona jak węgiel, ale się nie paliła. Pasterze zorientowali się, że jest to idealny materiał do znakowania owiec. I tak odkryto grafit, jednak nazwa ołówek pozostała.
Współczesny ołówek jest pręcikiem wykonanym najczęściej nie tylko z grafitu, lecz również z kaolinu, umieszczonego w oprawie drewnianej lub z tworzywa sztucznego. Podczas pisania grafit ściera się, pozostawiając ślad na powierzchni, np. papieru. Twardość oraz odcień rysika ołówka zależą od proporcji pomiędzy grafitem a glinką kaolinową. Im więcej grafitu, tym ciemniejszy oraz bardziej miękki jest ołówek. Większa ilość kaolinu sprawia, że ołówek jest twardszy i jaśniejszy. Ołówek 9B ma wkład z czystego grafitu. W ołówkach piszących w różnych kolorach nie stosuje się w ogóle grafitu, tylko produkuje się je z mieszanki wosku, kaolinu i barwników. Ołówek z gumką opatentowano dopiero w 1858 roku.

3. Diament – symbol bogactwa, piękna i oczarowania
Od stuleci diamenty zachwycają ludzi swoim doskonałym pięknem, rzadkością występowania i niezwykłymi właściwościami. DiamentDiament zbudowany jest z atomów węgla tworzących regularną sieć przestrzenną, o kształcie czworościanu foremnego (tetraedru), w której każdy atom łączy się z czterema innymi atomami węgla. Równomiernie rozłożone, krótkie a zarazem mocne wiązania kowalencyjne wpływają na bardzo dużą twardość tej odmiany alotropowej (w skali Mohsa twardość diamentu wynosi 10).
Cullinan – największy diament świata
Znaleziono go 25 czerwca 1905 r. w Republice Południowej Afryki. Miał wymiary 10 x 6 x 5 cm i ważył 3106 karatów, czyli 621,2 g. Pierwotnie był on najprawdopodobniej jeszcze większy. Kamień został ofiarowany królowi Edwardowi VII na jego 66. urodziny. Na polecenie króla 10 lutego 1908 roku znany amsterdamski szlifierz po trzech miesiącach oglądania kamienia zdecydował się podzielić diament na dwie części.
Umieścił precyzyjnie ostrze w najlepiej wybranym punkcie, uderzył młotkiem i ostrze pękło, lecz kamień pozostał nienaruszony. Przy drugim uderzeniu diament pękł tak, jak przewidywał szlifierz, jednak on sam zemdlał na skutek ogromnego stresu wywołanego możliwością uszkodzenia tego wyjątkowego cudu natury. Z Cullinanu uzyskano 9 dużych kamieni i 96 mniejszych o łącznej masie 1063,65 karata, co stanowi 34,25% masy początkowej i oznacza stratę sięgającą 65%. Kamienie szlifowano wiele miesięcy.

Film dostępny na portalu epodreczniki.pl
Na ekranie pojawia się i powiększa zdjęcie diamentu na bryłach węgla. Zdjęcie się powiększa i przechodzi w sieć krystaliczną diamentu. Następnie pojawia się erupcja wulkanu, po czym animacja przechodzi do widoku ogromnego krateru wydrążonego w ziemi, z której wydobywa się diamenty (Rosja - Jakucja). Na ekranie pojawia się człowiek przesiewający żwir z dna rzeki. Widoczna mapa z zaznaczonymi obszarami wydobywania diamentów. Jak narrator wymienia obszary występowania diamentów, to te podświetlają się na mapie. W następnej kolejności pojawia się taki nieobrobiony diament. W kolejnym etapie pokazuję się kolejno diamenty: Cullinan I, Regent, Orłow, Koh-i-noor, Hope, Pink Start, Tiffany Yellow, Millemnium Star, Centenary, Zielony Brylant Saski. Na koniec pojawia się symbol pierwiastka węgla i model budowy jego atomu.
Diamenty w stanie czystym tworzą z reguły bezbarwne, przeźroczyste kryształy. Ponieważ często w ich sieci krystalicznej występują jony innych pierwiastków, np.: boru, azotu, manganu, żelaza, zdecydowana większość wydobywanych kamieni jest zabarwiona. Wyróżnia się diamenty o barwie: żółtej, czerwonej, niebieskiej, fioletowej. Znane są nawet czarne diamenty, tzw. karbonado. Diamenty są wykorzystywane do cięcia szkła, ze względu na ich największą twardość wśród wszystkich minerałów. Obliczono, że diament o masie 1 karata – 0,2 g – wystarczyłby na przecięcie tafli szkła o długości większej niż odległość z Ziemi do Księżyca. O wyjątkowości diamentów wśród innych minerałów decyduje fascynująca gra świateł. Po oszlifowaniu powstają tzw. brylanty, które silnie załamują światło, a także mocno je rozszczepiają.
Wykorzystując poniższą aplikację, porównajcie przewodnictwo elektryczne diamentu i kilku innych minerałów.
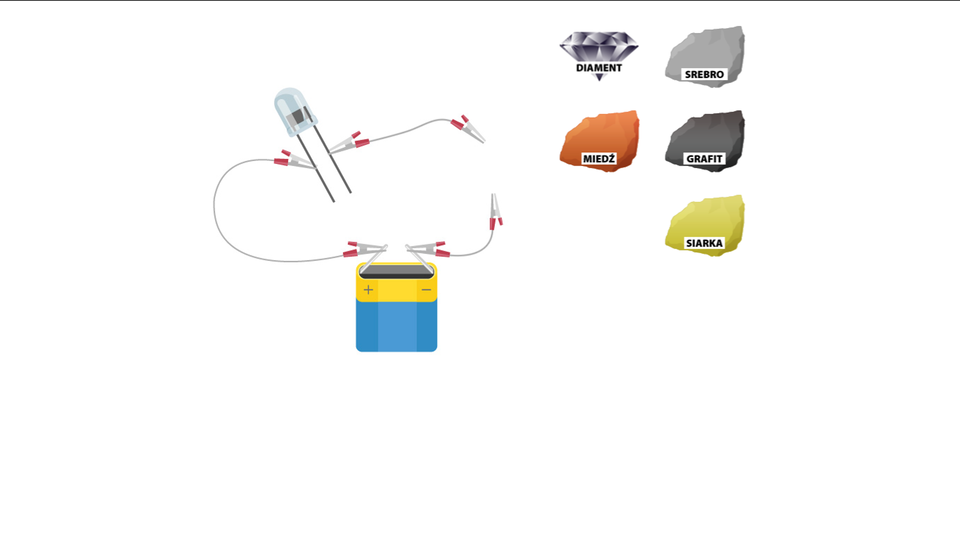
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D8mRW9Ag8
Diament ze względu na swoją budowę nie przewodzi prądu elektrycznego, ale jest bardzo dobrym przewodnikiem ciepła. Jest bierny chemicznie. Słowo diament pochodzi od greckiego adamas, co oznacza niezwyciężony, jednak jest kruchy, a przy ogrzaniu go do temperatury 1100 K spala się.

Brylanty nie od jubilera, czyli syntetyczne diamenty
Pod każdą szerokością geograficzną diament wzbudza emocje i jest utożsamiany z prestiżem, bogactwem i luksusem. Grecy uważali, że jego kryształy to łzy bogów. Rzymianie zaś wierzyli, że to okruchy gwiazd. Dla Indian był talizmanem chroniącym przed chorobą. Królowie liczyli, że diament osłoni ich podczas bitwy. Nic dziwnego, że od wieków ludzie marzyli o tym, żeby skraść tajemnicę naturze i nauczyć się wytwarzać diamenty. Udało się to po raz pierwszy 15 lutego 1953 roku szwedzkiej firmie elektroenergetycznej ASEA. Stworzono warunki laboratoryjne podobne do tych, jakie występują głęboko pod powierzchnią Ziemi. Dzięki zastosowaniu olbrzymiego ciśnienia, tzn. 100 000 atmosfer, w wysokiej temperaturze ok. 3000 K i w obecności metali, które pełnią rolę katalizatorów, przeprowadzono reakcję przemiany grafitu w diament. Diamenty syntetyczne nie różnią się praktycznie niczym od diamentów naturalnych – cechują się tą samą strukturą, barwą i właściwościami. Trudności z ich odróżnieniem od diamentów naturalnych mają nawet jubilerzy. Niestety, nie zmniejszyło to ceny diamentów. Syntetyczne diamenty są za małe, żeby oprawiać je w szlachetne kruszce. Największe mają tylko około 1 do 2 karatów, a koszt ich wytwarzania jest bardzo wysoki. W kwestii klejnotów jesteśmy zdani na to, co oferuje nam natura.

Omów różnice między diamentem i grafitem.
Jakie różnice dostrzegasz w budowie sieci krystalicznej diamentu i grafitu? Która z tych odmian alotropowych przewodzi prąd elektryczny? Jaką twardość wykazuje każda z tych odmian w skali Mohsa? Czym jeszcze różnią się te dwa rodzaje węgla?
4. Fullereny – najbardziej fascynująca postać węgla
W 1985 roku eksperyment naukowców Harolda Kroto, Richarda Smalleya i Roberta Curla doprowadził do odkrycia kolejnej odmiany alotropowej węgla – fullerenówfullerenów. Są to cząsteczki zbudowane z parzystej liczby: od 28 do około 1500 atomów węgla, które tworzą zamkniętą bryłę. Najbardziej popularny, fulleren , wyglądem przypomina piłkę futbolową i jest zbudowany z 60 atomów, które tworzą 12 pierścieni pięcioczłonowych i 20 pierścieni sześcioatomowych. Takie struktury geodezyjne, przypominające cząsteczki , konstruował niegdyś R. Buckminster Fuller i właśnie od nazwiska tego amerykańskiego architekta, matematyka i filozofa powstała nazwa tej odmiany. Odkrycie to ukazało zupełnie nowe oblicze węgla – pierwiastka, który wydawał się dotąd doskonale znany. Oprócz fullerenów właściwych otrzymano ponadto nanorurki i nanocebulki.

Jaka struktura wymaga najmniejszej ilości materiałów, np. budowlanych, by zamknąć konkretną przestrzeń w jedną całość?
Jaka forma jest strukturą najwytrzymalszą na obciążenia zgniatające lub próbujące ją rozerwać? Jaką postać powinny mieć budynki, które byłyby najodporniejsze na huragan czy trzęsienia Ziemi? Jaki kształt przestrzenny uważa się za najdoskonalszy?

5. Grafen – droga do miniaturyzacji
Niezwykłą odmianą węgla jest też grafengrafen, czyli warstwa grafitu o grubości jednego atomu. Ponieważ warstwa grafenu jest niezmiernie cienka, nanosi się go na inne materiały, którym nadaje on niezwykłe właściwości. Grafen został uzyskany w 2004 roku przez Andre Geima i Kostya Novoselova. Jest to niezwykle obiecująca substancja. Okazało się bowiem, że nowo odkryta forma węgla jest najtwardszym (twardszym od diamentu) i zarazem najbardziej rozciągliwym znanym materiałem. To znakomity przewodnik ciepła – dziesięciokrotnie lepszy od srebra. Podobnie jak grafit jest również bardzo dobrym przewodnikiem prądu elektrycznego, ale jeśli przyłączy się do niego atomy wodoru, to tworzy nowy materiał, zwany grafanem, będący doskonałym izolatorem. W porównaniu ze stalą nowy materiał ma od pięciu do sześciu razy mniejszą gęstość, jest dwukrotnie twardszy, 13‑krotnie bardziej elastyczny i 100‑krotnie bardziej wytrzymały na rozciąganie. Jego wiązania atomowe są tak ścisłe, że nie przepuszcza on nawet bakterii. Grafen jest jak współczesny kamień filozoficzny – podobnie rozbudza nadzieje i wyobraźnię, tyle że potrafimy go produkować. Jego historia jest związana z naszym krajem, ponieważ to właśnie polskim naukowcom zawdzięczamy opracowanie technologii przemysłowego otrzymywania tej niezwykłej substancji. Obecnie to najdroższy materiał, ale ze względu na swoje doskonałe właściwości z pewnością zastąpi w przyszłości krzem.

6. Alotropia siarki
Siarka tworzy najwięcej odmian alotropowych wśród pierwiastków – ponad 30, z których najważniejsze to siarka rombowa () i siarka jednoskośna (). Obie odmiany zbudowane są z pierścieni ośmioatomowych () różniących się sposobem ułożenia atomów w kryształach. Siarka rombowa jest trwała do temperatury 95,6°C. W tej temperaturze przekształca się w siarkę jednoskośną. W temperaturze 119,6°C siarka jednoskośna topi się i przechodzi w ruchliwą jasnożółtą ciecz – . Kiedy temperatura wzrasta, siarka brunatnieje i gęstnieje – powstaje . Podwyższenie temp. do poziomu powyżej 200°C powoduje zmniejszenie się lepkości siarki, ciecz staje się znowu łatwo płynna, nie zmieniając już barwy. W temp. 445°C siarka wrze, dając pomarańczowe pary składające się z cząsteczek , które podczas dalszego ogrzewania ulegają dysocjacji na coraz mniejsze drobiny (kolejno w i ). Powolne chłodzenie siarki powoduje odwrotną kolejność przemian, aż do otrzymania siarki rombowej. Natomiast gwałtowne chłodzenie stopionej siarki prowadzi do trzymania tzw. siarki plastycznej, która ma postać brunatnej masy. Szybko chłodzone pary siarki kondensują w postaci drobnego żółtego proszku, zwanego kwiatem siarczanym.

7. Alotropia fosforu i innych pierwiastków
Fosfor został odkryty w 1669 roku przez niemieckiego alchemika Henniga Brandta, który poszukując kamienia filozoficznego, prażył zagęszczony mocz z piaskiem bez dostępu powietrza. W trakcie jednej z takich prób Brandt otrzymał substancję, która wzbudzała wielkie zainteresowanie, głównie dlatego że świeciła w ciemności. W ten sposób został odkryty fosfor biały. Dziś wiemy, że fosfor tworzy jeszcze odmiany: czerwoną, fioletową i czarną. Odmiany te różnią się nie tylko niektórymi właściwościami fizycznymi, ale również aktywnością chemiczną. Najbardziej aktywna jest odmiana biała, a całkowicie bierna chemicznie jest odmiana czarna.

Film dostępny na portalu epodreczniki.pl
Odmiany alotropowe fosforu
Mniej znanymi pierwiastkami występującymi w postaci odmian alotropowych są: arsen, antymon, cyna, mangan, selen, uran, żelazo.
Podsumowanie
Występowanie pierwiastka w odmianach różniących się właściwościami to alotropia.
Grafit, diament, fullereny i grafen to odmiany alotropowe węgla.
Grafit ma strukturę warstwową. Jest miękki, dobrze przewodzi prąd elektryczny i ciepło. Jest też odporny na wysokie temperatury oraz mało aktywny chemicznie.
W sieci krystalicznej diamentu każdy atom węgla jest połączony wiązaniami o identycznej długości z czterema innymi atomami tego pierwiastka. Diament jest bardzo twardy, nie przewodzi prądu elektrycznego, ale dobrze przewodzi ciepło. Po oszlifowaniu daje wielobarwne efekty świetlne. Jest bardzo mało aktywny chemicznie.
Fullereny to cząsteczkowa odmiana węgla. Wykazują właściwości nadprzewodzące i półprzewodnikowe oraz większą aktywność chemiczną w porówaniu do grafitu.
Grafen to warstwa grafitu o grubości jednego atomu. Jest materiałem bardzo wytrzymałym i elastycznym, najlepiej przewodzącym prąd elektryczny, a po przyłączeniu atomów wodoru staje się izolatorem.
Odmiany alotropowe węgla znajdują wiele ważnych zastosowań, m.in. w elektronice, medycynie, przemyśle.
Oficjalne odkrycie nanorurek węglowych przypisuje się Japończykowi – Sumio Iijimie, który w 1991 roku ogłosił ich istnienie. Wyjaśnij, czym są te struktury i do czego już zostały wykorzystywane. Co to są nanocebulki?
Nanotechnologia to technologia i produkcja bardzo małych przedmiotów na poziomie najmniejszych cząstek materii. Przyjęło się zaliczać do nanotechnologii działania na cząsteczkach mniejszych niż 100 nm. Nanos w języku greckim znaczy karzeł. Natomiast w systemie metrycznym przedrostek nano odnosi się do jednej miliardowej części. Tak więc nanometr to miliardowa część metra, co jest równe w przybliżeniu stutysięcznej części średnicy ludzkiego włosa. Oblicz, jaką średnicę ma włos ludzki w metrach. Jaką grubość miałby włos, gdyby powiększyć go 1000 razy?
Słowniczek
zjawisko występowania tego samego pierwiastka chemicznego w kilku odmianach, które różnią się między sobą strukturą krystaliczną lub liczbą atomów w cząsteczce, co powoduje ich odmienne właściwości
minerał, odmiana alotropowaodmiana alotropowa węgla
minerał, odmiana alotropowaodmiana alotropowa węgla będąca najtwardszą znaną substancją występującą w przyrodzie
cząsteczki węgla składające się z parzystej liczby atomów tworzące zamkniętą, pustą w środku bryłę
forma alotropowegoforma alotropowego węgla o płaskiej strukturze grubości jednego atomu
odmiany tego samego pierwiastka, różniące się sposobem rozmieszczenia atomów w przestrzeni lub liczbą atomów w cząsteczce, w związku z czym różnią się właściwościami
Zadania
Uzupełnij luki w tekście, przeciągając elementy z listy.
niski, 621, 0,2, Koh-I-Noor, wysoki, karbon, 0,154, Cullinan, karbonado, 3106, 1,54, 2
Największy znaleziony dotąd diament nazywa się ..................... Jego masa wynosiła przed oszlifowaniem .................... karatów. Karat metryczny to .................... grama. Czarne diamenty nazywają się ..................... Oszlifowane diamenty mają .................... współczynnik załamania światła. Odległości pomiędzy atomami węgla w sieci krystalicznej diamentu wynoszą .................... nm.
Zaznacz, które zdania są prawdziwe, a które fałszywe.
| Prawda | Fałsz | |
| Diament to najtwardsza substancja ze wszystkich substancji naturalnych. | □ | □ |
| Grafit jest substancją aktywną chemicznie. | □ | □ |
| W graficie każdy atom węgla jest połączony mocnymi wiązaniami kowalencyjnymi z czterema innymi atomami węgla. | □ | □ |
| Grafen to warstwa grafitu o grubości jednego atomu. | □ | □ |
| Fosfor biały to odmiana alotropowa fosforu, która jest silnie trująca. | □ | □ |
| Odmiana siarki trwała w warunkach laboratoryjnych to siarka rombowa. | □ | □ |
Gęstość grafitu wynosi . Oblicz jaką objętość będzie miał grafitowy przedmiot o masie 9 gramów.
Uzupełnij puste miejsca w zdaniach, wybierając brakujące elementy z listy.
diament, grafit, diament, fullereny, fullereny, grafen, fullereny, grafen, grafit, diament, grafen, diament, grafen, fullereny, grafit, grafit
1). Odmiana alotropowa węgla, która przewodzi ciepło, ale nie przewodzi prądu elektrycznego to ...................
2). .................. jest znakomitym przewodnikiem ciepła, bardzo dobrze przewodzi prąd elektryczny, a może również w odpowiednich warunkach zachowywać się jak izolator.
3). Odmianą węgla, która dobrze przewodzi prąd elektryczny i ciepło jest ...................
4). Odmiana alotropowa węgla, która wykazuje właściwości nadprzewodzące i półprzewodnikowe to ...................
Uzupełnij zdania, wstawiając we właściwe miejsca nazwy odmian alotropowych węgla.
Odmiana węgla, która służy do produkcji farb antykorozyjnych to ............. Do produkcji twardościomierzy jest stosowany ............... Bandaże stanowiące barierę nie do przebycia dla mikrobów mogą być produkowane z ............... Ze względu na dobre właściwości smarne ............ jest stosowany m.in. do produkcji suchego smaru.