Laboratorium kontroli jakości leków
MED.09. Sporządzanie i wytwarzanie produktów leczniczych oraz prowadzenie obrotu produktami leczniczymi, wyrobami medycznymi, suplementami diety i środkami spożywczymi specjalnego przeznaczenia żywieniowego oraz innymi produktami dopuszczonymi do obrotu w aptece na podstawie przepisów prawa - Technik farmaceutyczny 321301
Prezentacja poszczególnych procesów analitycznych
FILM EDUKACYJNY
Spis treści
Prezentacja poszczególnych procesów analitycznychPrezentacja poszczególnych procesów analitycznych
Miareczkowanie w środowisku niewodnymMiareczkowanie w środowisku niewodnym
Miareczkowanie alkacymetryczne odwrotneMiareczkowanie alkacymetryczne odwrotne
Metoda spektrofotometryczna VISMetoda spektrofotometryczna VIS
Schemat spektrofotometru klasycznegoSchemat spektrofotometru klasycznego
Metoda chromatografii cienkowarstwowej (TLC)Metoda chromatografii cienkowarstwowej (TLC)
Oznaczenia graniczne zanieczyszczeń - chlorkiOznaczenia graniczne zanieczyszczeń - chlorki
Oznaczanie właściwości podłoży o charakterze tłuszczów - liczba kwasowaOznaczanie właściwości podłoży o charakterze tłuszczów - liczba kwasowa
Prezentacja poszczególnych procesów analitycznych

Film dostępny pod adresem /preview/resource/R7kTb48nU0Sfq
Film prezentujący poszczególne procesy analityczne.
Powrót do spisu treściPowrót do spisu treści
Miareczkowanie w środowisku niewodnym
Mechanizm reakcji oznaczania soli sodowej kwasu benzoesowego w środowisku niewodnym:
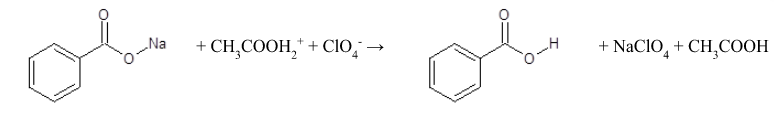
Warunek stechiometrii
kwasu nadchlorowego soli sodowej kwasu benzoesowego .
Przykładowe obliczenia
Oznaczanie acydymetryczne soli sodowej kwasu benzoesowego:
Rozpuścić substancji w bezwodnego kwasu octowego -proc., ogrzewając, jeżeli to konieczne, do temp. .
Ochłodzić.
Miareczkować kwasem nadchlorowym , używając jako wskaźnika roztworu fioletu krystalicznego w bezwodnym kwasie octowym. Punkt końcowy miareczkowania: zmiana zabarwienia roztworu z fioletowego na niebieskie.
Dane:
odważka: ,
objętość zużytego mianowanego roztworu kwasu nadchlorowego: ,
miano zużytego mianowanego roztworu kwasu nadchlorowego: .
Obliczenia:
soli sodowej kwasu benzoesowego
Obliczenie zawartości kwasu benzoesowego:
Powrót do spisu treściPowrót do spisu treści
Miareczkowanie alkacymetryczne odwrotne
Mechanizm reakcji miareczkowania alkacymetrycznego odwrotnego dla kwasu acetylosalicylowego:
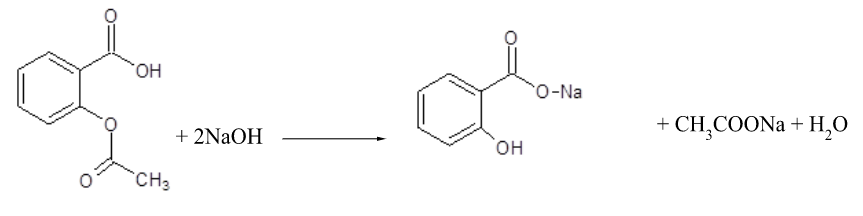
Warunek stechiometrii
roztworu wodorotlenku sodu kwasu acetylosalicylowego .
Przykładowe obliczenia
Oznaczanie alkacymetryczne kwasu acetylosalicylowego
W kolbie z doszlifowanym korkiem rozpuścić substancji w etanolu (-proc.). Dodać roztworu wodorotlenku sodu . Kolbę zamknąć i odstawić na godz. Miareczkować kwasem solnym , używając jako wskaźnika roztworu fenoloftaleiny OD. Punkt końcowy miareczkowania: do odbarwienia roztworu.
Dane:
odważka: ,
objętość mianowanego roztworu wodorotlenku sodu dodanego w nadmiarze: ,
objętość zużytego mianowanego roztworu kwasu solnego na odmiareczkowanie użytego w nadmiarze wodorotlenku sodu : ,
objętość zużytego mianowanego roztworu kwasu solnego na zmiareczkowanie próby ślepej: .
Obliczenia:
roztworu wodorotlenku sodu kwasu acetylosalicylowego .
Odjąć objętość mianowanego wodorotlenku sodu zużytą na odmiareczkowanie nadmiaru wodorotlenku sodu w próbie badanej od objętości mianowanego roztworu wodorotlenku sodu zużytego na zmiareczkowanie próby ślepej.
kwasu acetylosalicylowego
Obliczenie zawartości kwasu acetylosalicylowego w odważce:
Powrót do spisu treściPowrót do spisu treści
Metoda spektrofotometryczna VIS
Prawo Lamberta i Beera
Istnieje proporcjonalna zależność pomiędzy stężeniem, grubością warstwy absorbującej i absorbancją:
,
gdzie
— absorbcja właściwa,
— stężenie ,
— grubość warstwy .
Aparatura do pomiaru absorpcji w metodzie spektrofotometrycznej w świetle widzialnym:
kuwety kwarcowe ,
spektrofotometr UV/VIS.

Powrót do spisu treściPowrót do spisu treści
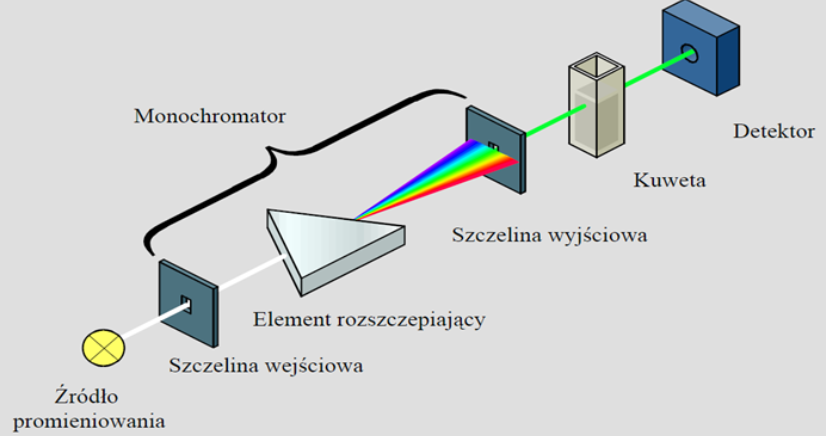
Schemat spektrofotometru klasycznego
Monochromator znajduje się przed próbką i przez próbkę przepuszcza się sukcesywnie kolejne wiązki światła monochromatycznego.
Przykładowe obliczenia
Odważyć fenobarbitalu, dodać metanolu, mieszać do rozpuszczenia substancji i uzupełnić metanolem do (roztwór ). Do kolbek stożkowych przenieść roztworu , następnie dodać metanolowego roztworu octanu kobaltu , metanolowego roztworu butyloaminy , zmieszać i zmierzyć absorbancję w warstwie przy długości fali równej wobec metanolu (absorbancja roztworu wynosi ). Równolegle wykonać oznaczenie substancji porównawczej, używając -proc. etanolowego roztworu fenobarbitalu (absorbancja roztworu wynosi ).
Dokonać obliczeń z wykorzystaniem wzoru:
,
gdzie
— wartość absorbancji badanego roztworu,
— wartość absorbancji roztworu substancji porównawczej,
— stężenie roztworu substancji porównawczej podane w procentach,
— objętość roztworu substancji badanej,
— odważka substancji badanej.
Dane:
— ,
— ,
— ,
— ,
— .
Dane podstawiamy do wzoru.
Powrót do spisu treściPowrót do spisu treści
Metoda chromatografii cienkowarstwowej (TLC)
Współczynnik opóźnienia
Podstawowym parametrem w chromatografii cienkowarstwowej, który określa położenie substancji na chromatogramie, jest współczynnik opóźnienia . Jest to stosunek drogi migracji substancji () do drogi przebytej przez fazę ruchomą ().
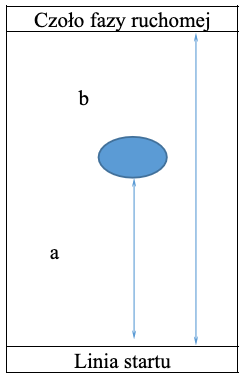
Pomiar współczynnika opóźnienia
Współczynnik opóźnienia przyjmuje wartości od do . Jeśli , oznacza to, że substancja w danym układzie chromatograficznym pozostaje na starcie, gdyż zbyt silnie oddziałuje z fazą stacjonarną i nie ma oddziaływań z fazą ruchomą. Z kolei świadczy o tym, że substancja nie oddziałuje z fazą stacjonarną i wędruje z czołem rozpuszczalnika. Optymalna wartość współczynnika powinna zawierać się w przedziale . Wówczas warunki chromatograficzne są najbardziej stabilne. Współczynnik opóźnienia jest charakterystyczny dla danej substancji w danych warunkach chromatograficznych (temperatura, wilgotność, naświetlenie słoneczne, wysycenie komory chromatograficznej) i może służyć do jej identyfikacji. Wartość współczynnika , podobnie jak innych parametrów retencji, zależy od rodzaju substancji, rodzaju fazy ruchomej i fazy stacjonarnej, a także nasycenia komory i temperatury.
Obliczanie współczynnika opóźnienia
Otrzymane wartości: droga migracji substancji badanej wynosi , droga przebyta przez fazę ruchomą wynosi . Obliczanie współczynnika opóźnienia z wykorzystaniem wzoru:
,
gdzie
— droga migracji substancji badanej,
— droga przebyta przez fazę ruchomą.
Obliczenia:
Powrót do spisu treściPowrót do spisu treści
Oznaczenia graniczne zanieczyszczeń — chlorki

Analiza wyników
Obserwację próbek przeprowadza się w świetle dziennym, po umieszczeniu ich na czarnym tle.
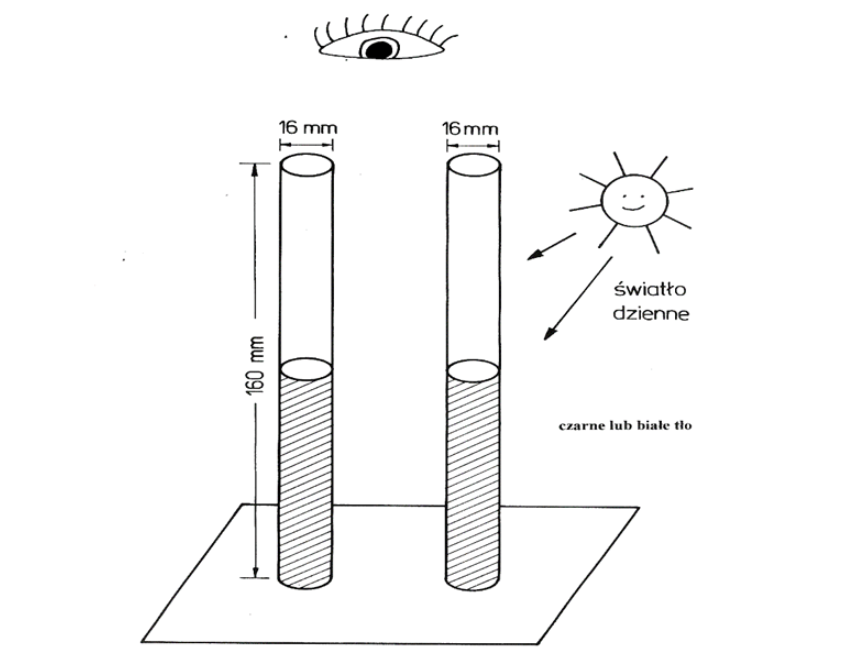
Powrót do spisu treściPowrót do spisu treści
Oznaczanie właściwości podłoży o charakterze tłuszczów — liczba kwasowa
Liczba kwasowa jest to liczba wyrażająca ilość wodorotlenku potasu, w miligramach, wymagana do zobojętnienia wolnych kwasów obecnych w substancji o charakterze tłuszczów. Jest obliczana wg wzoru:
,
gdzie
— liczba kwasowa,
— objętość zużytego wodorotlenku potasu,
— odważka.
Przykładowe obliczenia
Do kolby stożkowej o pojemności z doszlifowanym korkiem odważyć około oleju kakaowego, dodać cylindrem mieszaniny etanol — eter etylowy , uprzednio zobojętnionej mianowanym roztworem wodorotlenku potasu wobec fenoloftaleiny i rozpuścić (ogrzewając na łaźni wodnej). Roztwór miareczkować mianowanym roztworem wodorotlenku potasu , stosując fenoloftaleinę jako wskaźnik, do różowego zabarwienia utrzymującego się co najmniej sekund.
Dane:
odważka: ,
objętość zużytego mianowanego roztworu wodorotlenku potasu: .
Obliczenia:
Potwierdzanie tożsamości metamizolu sodowego
Dla metamizolu sodowego wykonujemy następujące reakcje chemiczne z:
jodobizmutanem potasu (odczynnik Dragendorffa),
nadtlenkiem wodoru,
azotanem srebra,
azotynem sodu,
kwasem chromotropowym,
piroantymonianem potasu.
Powrót do spisu treściPowrót do spisu treści
