Przeczytaj
Kiedy sól przewodzi prąd elektryczny?
Koniec wieku przyniósł wiele dowodów na to, że roztwory wielu związków nieorganicznych (np. soli) przewodzą prąd elektryczny. Związki te nazywano elektrolitamielektrolitami. W jaki sposób można wyjaśnić to zjawisko? Czy jedynie roztwory soli są zdolne do przewodzenia prądu elektrycznego?
Przeprowadzono doświadczenie, w którym badano zdolność chlorku sodu (tzw. soli kuchennej) do przewodzenia prądu elektrycznego. Spójrz na poniższą ilustrację i określ, w której zlewce (-) analizowano zdolność do przewodzenia prądu przez: wodny roztwór , stały krystaliczny , stopiony . Następnie zapisz wnioski z doświadczenia.
Przeprowadzono doświadczenie, w którym badano zdolność chlorku sodu (tzw. soli kuchennej) do przewodzenia prądu elektrycznego. Są trzy elektrolizery. Elektrody, anoda i katoda, zanurzone w jednym tym samym naczyniu, w obwód włączona jest żarówka oraz baterie. W pierwszym elektrolizerze znajdują się kryształy chlorku sodu . Żarówka nie świeci. W drugim, stopiony chlorek sodu . Żarówka świeci, a aniony chlorkowe dążą do anody, zaś kationy sodowe do katody. W trzecim elektrolizerze znajduje się wodny roztwór chlorku sodu . Żarówka świeci. Aniony chlorkowe poruszają się w kierunku anody, zaś kationy sodowe, w kierunku katody. Określ, w której zlewce (-) analizowano zdolność do przewodzenia prądu przez: wodny roztwór , stały krystaliczny , stopiony . Następnie zapisz wnioski z doświadczenia.
Dlaczego sól kuchenna w postaci kryształów nie przewodzi prądu elektrycznego, a jej roztwór lub forma stopiona przewodzi?
Stały
Kryształy składają się z naładowanych różnoimiennie jonów dodatnich (kationów) i ujemnych (anionów), które zajmują określone położenia w strukturze sieci krystalicznej i w stanie stałym nie mogą ich opuszczać (chociaż mogą wykonywać drgania). Siłą utrzymującą sieć krystaliczną razem są oddziaływania elektrostatyczne wiązania jonowegowiązania jonowego. Sieć krystaliczna nie zawiera więc ruchliwych jonów, zdolnych do poruszania się pomiędzy elektrodami i przewodzenia prądu elektrycznego. Z tego względu nie obserwujemy zaświeconej żarówki.
Stopiony
W czasie ogrzewania stałego chlorku sodu, dochodzi do jego stopienia – sieć krystaliczna rozpada się i jony, które zajmowały do tej pory określone położenia w sieci krystalicznej, mogą poruszać się swobodnie w stanie ciekłym.
Kiedy w ciekłym, czyli stopionym chlorku sodu umieścimy elektrody i podłączymy je do źródła energii, to przez niego zacznie przepływać prąd elektryczny. Aniony chlorkowe będą zbliżać się do anody (elektrody dodatniej), oddając jej elektrony i ulegając utlenieniu.
Anoda (+):
Z kolei do katody (elektrody ujemnej) zbliżać się będą kationy sodu i będą ulegać na tej elektrodzie redukcji, pobierając z niej elektrony.
Katoda (-):
Procesowi przepływu prądu przez stopioną sól towarzyszą zatem efekty chemiczne – na anodzie wydziela się gazowy chlor, a na katodzie metaliczny sód. Proces ten nazywamy elektrolizą.
Równanie sumaryczne elektrolizy:
Roztwór wodny
W roztworze wodnym chlorek sodu ulega dysocjacji elektrolitycznej i rozpada się na jony dodatnie (kationy) i jony ujemne (aniony). Proces dysocjacji elektrolitycznejdysocjacji elektrolitycznej można przedstawić równaniem:
Podczas rozpuszczania stałego chlorku sodu, jego sieć krystaliczna zostaje rozerwana, a poszczególne jony, solawatowane (otaczane) przez cząsteczki wody, mogą swobodnie poruszać się w roztworze. Roztwór taki przewodzi zatem prąd elektryczny. Co istotne, w roztworze wodnym mamy do czynienia z tzw. „podwójnym prądem”. Aniony poruszają się w przeciwnym kierunku niż kationy, a pola elektryczne różnoimiennie naładowanych jonów oddziałują na siebie.
Elektoliza roztworu chlorku sodu prowadzi do otrzymania gazowych produktów. Na anodzie (elektrodzie dodatniej) zachodzi proces utlenienia anionów chlorkowych, czego produktem jest gazowy chlor.
Anoda (+):
Natomiast, na katodzie (elektrodzie ujemnej) zachodzi proces redukcji wody, w wyniku którego otrzymywany jest gazowy wodór.
Katoda (-):
W procesie elektrolizy wodnego roztowu chlorku sodu otrzymuje się zatem gazowy chlor i wodór oraz zdysocjowany wodorotlenek sodu.
Równanie sumaryczne elektrolizy:
Większość soli w ciele stałym nie przewodzi prądu elektrycznego. Istnieje jednak grupa stałych soli, które charakteryzują się wysokim przewodnictwem jonowym. Są to tzw. przewodniki superjonowe, których przewodnictwo może być nawet tak duże, jak roztworów wodnych elektrolitów.
Jak wiadomo, w ciele stałym soli ruch jonów (prócz drgań wokół położenia równowagi) jest niemożliwy – są one bowiem uwięzione w sieci krystalicznej. Wprawdzie w kryształach przewodników superjonowych występują również wiązania jonowe, jednak dzięki tzw. defektom sieci krystalicznej jony mogą się poruszać. Do przewodników superjonowych zalicza się m.in. jodek srebra w temperaturze powyżej 420 K (faza beta), w którym jony srebra mogą swobodnie przemieszczać się między większymi jonami jodkowymi.
Przewodniki superjonowe są wykorzystywane m.in. w konstrukcji ogniw paliwowych.
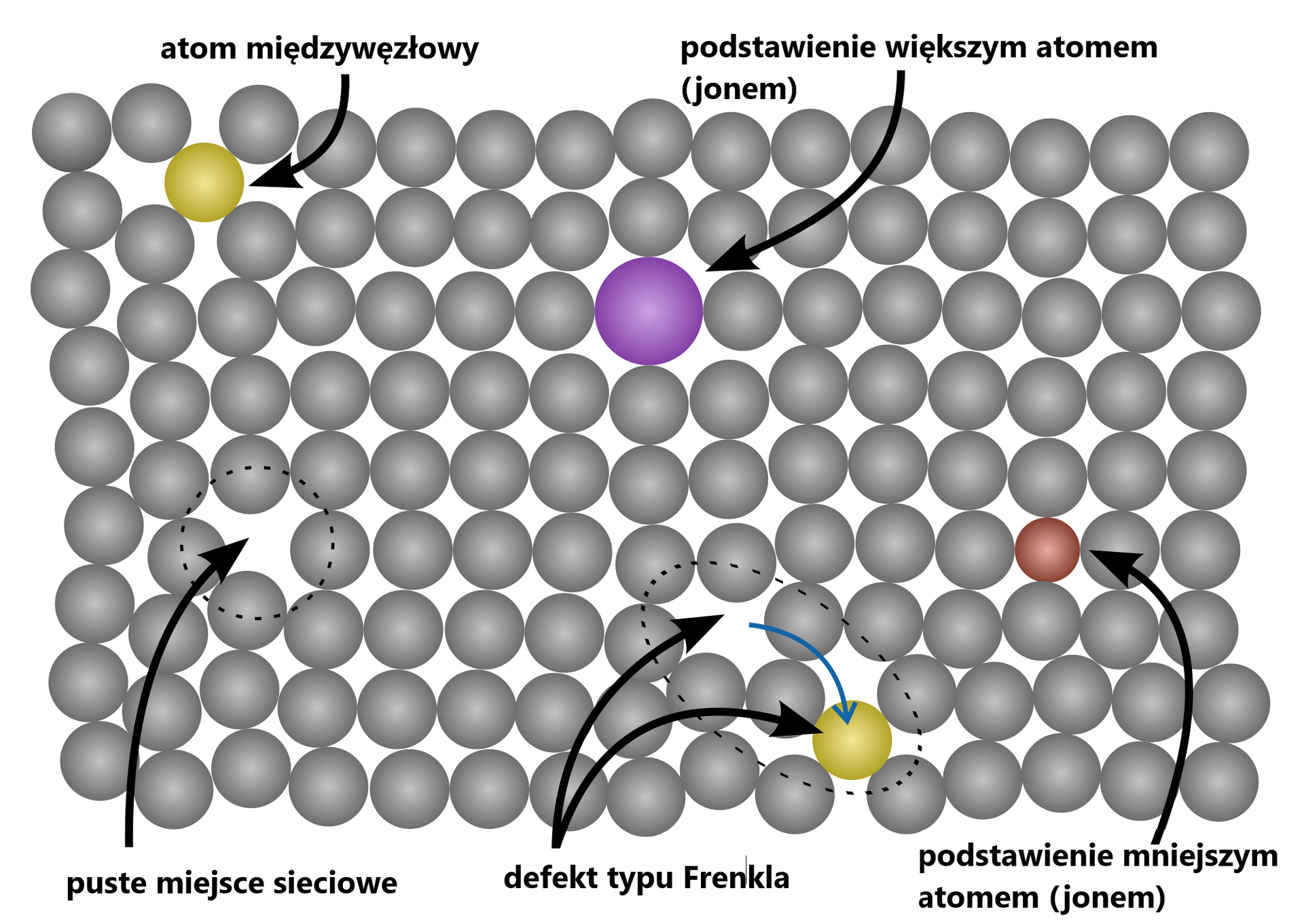
Większość soli w stanie stałym praktycznie nie przewodzi prądu elektrycznego. Dobrym przewodnictwem elektrycznym cechują się za to roztwory wodne soli oraz sole w postaci stopionej, z uwagi na obecność ruchliwych jonów.
Słownik
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) związek chemiczny, który ulega procesowi rozpadu na jony pod wpływem wody i jest zdolny do przewodzenia prądu elektrycznego; gdy jest całkowicie zdysocjowany, mówimy o elektrolicie mocnym
elektrostatyczne oddziaływanie między przeciwnie naładowanymi jonami, powstające wskutek przeniesienia elektronu (elektronów) z atomu pierwiastka mniej elektroujemnego do atomu pierwiastka bardziej elektroujemnego
(łac. dissociatio „rozdzielenie”) proces rozpadu związków chemicznych (kwasów, wodorotlenków, soli) w roztworach, na dodatnio i ujemnie naładowane cząstki, tj. jony, pod wpływem działania rozpuszczalnika
Bibliografia
Bieniek G., Chemia doświadczenia chemiczne w zadaniach. Trening przed maturą, Kraków 2007.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002.
Encyklopedia PWN
Jagodziński P., Wolski R., Aspekty Metodyczne eksperymentów chemicznych. Szkoła ponadgimnazjalna. Nowa podstawa programowa, cz. 2, Warszawa 2013.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.