Przeczytaj
Półogniwo zbudowane jest z przewodnika elektronowegoprzewodnika elektronowego, który zanurzony jest w przewodniku jonowym (najczęściej to roztwór odpowiedniego elektrolituelektrolitu). Na granicy zetknięcia ze sobą przewodnika elektronowego z roztworem elektrolitu występuje różnica potencjałów elektrochemicznych nazywana potencjałem półogniwa. Wartość potencjału półogniwa zależy od rodzaju przewodnika elektronowego, stężenia jonów potencjałotwórczych (w przypadku gazów od ciśnienia) oraz temperatury.
Jak definiuje się potencjał standardowy półogniwa?
Potencjał standardowy półogniwa oznacza się jako: lub . To potencjał półogniwa, w którym przewodnik elektronowy zanurzony jest w roztworze zawierającym jony potencjałotwórcze o stężeniu , a gazy są pod ciśnieniem w temperaturze (), mierzonym względem standardowego półogniwa wodorowego.
Standardowe półogniwo wodorowe () składa się z blaszki platynowej Pt pokrytej czernią platynową, która jest zanurzona w roztworze zawierającym jony o stężeniu . Ponadto, blaszka Pt jest opłukiwana gazowym wodorem pod ciśnieniem w temperaturze .
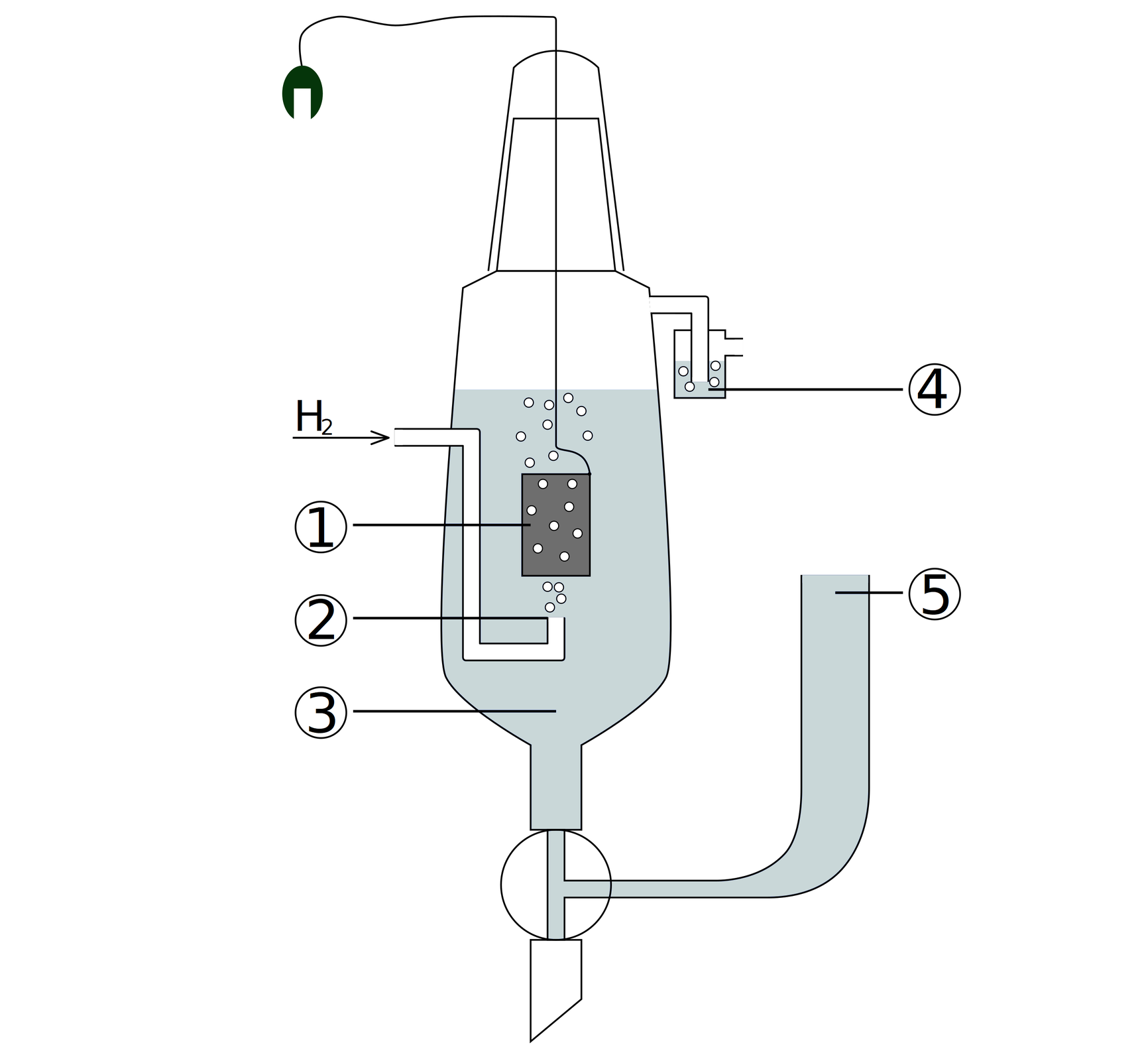
1 – blaszka platynowa pokryta czernią platynową
2 – rurka doprowadzająca pęcherzyki wodoru
3 – roztwór zawierający jony
4 – płuczka blokująca dostęp powietrza
5 – zbiornik z zapasem elektrolitu
Półogniwo to zapisujemy w następujący sposób:
Półogniwo wodorowe wykorzystywane jest do wyznaczania potencjałów standardowych innych półogniw. Przyjmuje się, że potencjał standardowy półogniwa wodorowego w każdej temperaturze wynosi zero.
Jednostką potencjału standardowego półogniwa jest wolt .
Potencjały standardowe półogniw nie mają własnych, bezwzględnych wartości. Mogą być one zmierzone tylko względem umownie przyjętego układu odniesienia, któremu jest przypisany potencjał równy . Zatem potencjał standardowy półogniwa można także zdefiniować jako siłę elektromotoryczną ogniwa () zbudowanego z danego półogniwa (tego, którego potencjał chcemy wyznaczyć) oraz półogniwa wodorowego. Czyli jest to różnica potencjału między badanym półogniwem i półogniwem wodorowym.
Potencjały standardowe półogniw są zebrane w tablicach fizykochemicznych.
Półogniwo (schemat) | Reakcja przebiegająca w półogniwie | |
|---|---|---|
Tabela potencjałów standardowych półogniw w temperaturze .
Indeks dolny /Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Wydawnictwo Naukowe PWN, Warszawa oraz L. Jones, P. Atkins, Chemia ogólna: cząsteczki, materia, reakcje, tłum. J. Kuryłowicz, Wydawnictwo Naukowe PWN, Warszawa ./ Indeks dolny koniec/Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Wydawnictwo Naukowe PWN, Warszawa oraz L. Jones, P. Atkins, Chemia ogólna: cząsteczki, materia, reakcje, tłum. J. Kuryłowicz, Wydawnictwo Naukowe PWN, Warszawa ./
Znak i wartość potencjału standardowego półogniwa określają zdolność do samorzutnego przebiegu reakcji redukcjiredukcji w danym półogniwie. Im niższa wartość potencjału standardowego półogniwa tym większa jest zdolność redukująca tego półogniwa.
Ujemna wartość potencjału standardowego półogniwa względem standardowego półogniwa wodorowego oznacza, że forma zredukowana wykazuje większą zdolność do oddawania elektronów (czyli do utleniania sięutleniania się) niż atomy wodoru. W ogniwie zbudowanym z półogniwa o ujemnym potencjale standardowym i półogniwa wodorowego, to właśnie półogniwo o ujemnym potencjale standardowym jest anodąanodą. Na przykład: na anodzie zachodzi reakcja utleniania metalu do kationu, a na półogniwie wodorowym zachodzi reakcja redukcji jonów do wodoru.
Im bardziej ujemny potencjał standardowy półogniwa, tym postać zredukowana jest silniejszym reduktoremreduktorem.
Dodatnia wartość potencjału standardowego półogniwa względem standardowego półogniwa wodorowego oznacza, że forma zredukowana wykazuje mniejszą zdolność do oddawania elektronów (czyli do utleniania się) niż atomy wodoru. W ogniwie zbudowanym z półogniwa o dodatnim potencjale standardowym i półogniwa wodorowego, to właśnie półogniwo o dodatnim potencjale standardowym jest katodąkatodą. Na przykład: na katodzie zachodzi reakcja redukcji kationu do metalu, a na półogniwie wodorowym zachodzi reakcja utleniania wodoru do jonów .
Im bardziej dodatni potencjał standardowy półogniwa, tym postać utleniona jest silniejszym utleniaczemutleniaczem – łatwiej dochodzi do reakcji redukcji.
Jak obliczyć potencjał standardowy półogniwa?
Aby wyznaczyć potencjał standardowy półogniwa należy zbudować ogniwo zawierające dane ogniwo oraz półogniwo wodorowe. Jeżeli w półogniwie wodorowym zachodzi reakcja redukcji to jest wtedy katodą (dodatni biegun ogniwa).
Jeżeli w półogniwie wodorowym zachodzi reakcja utleniania to jest wtedy anodą (ujemny biegun ogniwa).
Następnie za pomocą voltomierza mierzy się siłę elektromotoryczną takiego ogniwa.
Obliczmy potencjał standardowy półogniwa cynkowego .
W tym celu należy zbudować ogniwo składające się z półogniwa cynkowego oraz półogniwa wodorowego, a następnie zmierzyć siłę elektromotoryczną ogniwa.
Po podłączeniu do woltomierza półogniwa wodorowego jako katody, a półogniwa cynkowego jako anody, zmierzona siła elektromotoryczna tego ogniwa wyniosła (warunki standardowe).
tego ogniwa to różnica standardowych potencjałów półogniwa wodorowego i cynkowego.
Zatem:
Wynika z tego, że potencjał standardowy półogniwa cynkowego wynosi .
Schemat tego ogniwa jest następujący:
W tym ogniwie anodą (ma znak ujemny) jest półogniwo cynkowe, a katodą (ma znak dodatni) jest półogniwo wodorowe. Na anodzie zachodzi reakcja utleniania, a na katodzie reakcja redukcji.
Obliczmy potencjał standardowy półogniwa miedziowego .
W tym celu należy zbudować ogniwo składające się z półogniwa miedziowego oraz półogniwa wodorowego, a następnie zmierzyć siłę elektromotoryczną ogniwa.
Schemat tego ogniwa jest następujący:
W tym ogniwie anodą (ma znak ujemny) jest półogniwo wodorowe, a katodą (ma znak dodatni) jest półogniwo miedziowe. Na anodzie zachodzi reakcja utleniania, a na katodzie reakcja redukcji.
Po podłączeniu do woltomierza półogniwa wodorowego jako anody, a półogniwa miedziowego jako katody, zmierzona siła elektromotoryczna tego ogniwa wyniosła (warunki standardowe).
tego ogniwa to różnica standardowych potencjałów półogniwa miedziowego i wodorowego.
Zatem:
Wynika z tego, że potencjał standardowy półogniwa miedziowego wynosi .
Skonstruowano ogniwo z półogniwa cynkowego i miedzianego. Schemat tego ogniwa jest następujący:
Standardowa siła elektromotoryczna ogniwa () wynosi , a potencjał standardowy półogniwa miedziowego wynosi . Oblicz potencjał standardowy półogniwa cynkowego .
W tym ogniwie anodą (ma znak ujemny) jest półogniwo cynkowe, a katodą (ma znak dodatni) jest półogniwo miedziowe. Na anodzie zachodzi reakcja utleniania, a na katodzie reakcja redukcji.
tego ogniwa to różnica standardowych potencjałów półogniwa miedziowego i cynkowego.
Potencjał standardowy półogniwa cynkowego wynosi .
Wynika z tego, że znając standardową siłę elektromotoryczną ogniwa i potencjał standardowy jednego półogniwa można obliczyć potencjał standardowy drugiego półogniwa.
Słownik
przewodnik, który wykazuje przewodnictwo elektronowe, którego nośnikiem ładunku elektrycznego są elektrony; do przeowdników elektronowych zaliczamy m.in. metale
półogniwo, na którym zachodzi reakcja utleniania; w ogniwie ma znak ujemny
substancja, która za pośrednictwem jonów przewodzi prąd elektryczny
półogniwo, na którym zachodzi reakcja redukcji; w ogniwie ma znak dodatni
przyjmowanie elektronów przez jony lub atomy pierwiastków, w wyniku czego dochodzi do obniżenia stopnia utlenienia
atom, jon lub cząsteczka, które w reakcji redoks są donorem elektronu (elektronów)
pojęcie umowne, określające liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomowi pierwiastka chem., wchodzącego w skład określonego związku, gdyby cząsteczki tego związku miały budowę jonową
atom, jon lub cząsteczka, które w reakcji redoks są akceptorem elektronu (elektronów)
oddawanie elektronów przez jony lub atomy pierwiastków, w wyniku czego dochodzi do podwyższenia stopnia utlenienia