Przeczytaj
O reakcjach litowców z tlenem
Litowce są bardzo reaktywnymi metalami. Ze względu na położenie w układzie okresowym, są reduktorami – w reakcjach chemicznych oddają swój jedyny elektron walencyjny, przechodząc na stopień utlenienia. Niska elektroujemność litowców sprawia, że typowe ich związki wykazują charakter jonowy.
Wysoka reaktywność litowców znajduje potwierdzenie w produktach reakcji tych metali z tlenem – na powietrzu pokrywają się szybko warstwą tlenku (lit), nadtlenkunadtlenku (sód) lub ponadtlenkuponadtlenku (od potasu do cezu). Jon ponadtlenkowy powstaje w wyniku redukcji cząsteczki tlenu jednym elektronem. Do litowców zalicza się lit, sód, potas, rubid, cez i frans.
Otrzymany jon ponadtlenkowy posiada nieparzystą liczbę elektronów walencyjnych – – co powoduje, że jest rodnikiem. Struktura elektronowa tego jonu może zostać opisana jako hybryda rezonansowa dwóch struktur, przedstawionych na poniższym rysunku:
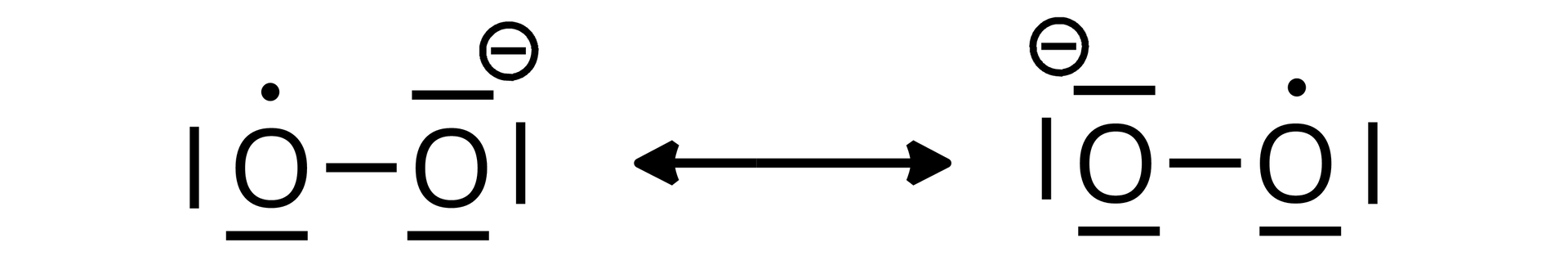
Długość wiązania łączącego obydwa atomy tlenu w jonie ponadtlenkowym wynosi (pikometrów, ). Jest to wartość pośrednia między długością wiązania podwójnego w cząsteczce a długością pojedynczego wiązania w jonie nadtlenkowym :
Drobina | Długość wiązania |
|---|---|
Na podstawie wzoru elektronowego oraz długości wiązań można określić wiązanie w jonie ponadtlenkowym, jako wykazujące charakter pośredni między wiązaniem pojedynczym a podwójnym.
Znane są ponadtlenki litowców i berylowców. Spośród nich wyróżniamy żółty , brązowy oraz żółtozielony . Ponadtlenki cięższych litowców i berylowców są trwalsze od odpowiedników dla lżejszych pierwiastków – np. ponadtlenek sodu ulega rozkładowi w temperaturze powyżej , ponadtlenek magnezu jest stabilny poniżej , natomiast ponadtlenku litu nie udało się otrzymać.
Oprócz litowców i berylowców znane są także ponadtlenki czwartorzędowych soli amoniowych – ponadtlenek tetrametyloamoniowy oraz ponadtlenek tetraeetyloamoniowy. Posiadają one niską temperaturę topnienia oraz są barwne.
Ze względu na swoje silnie utleniające właściwości, znalazły zastosowanie m.in. jako źródło tlenu na okrętach podwodnych. W reakcji z wodą następuje wydzielenie tlenu:
Powstający nadtlenek wodoru ulega rozkładowi, z wydzieleniem tlenu w środowisku zasadowym:
A to sumarycznie daje równanie:
Słownik
związek chemiczny, zawierający jon ; w wodzie ulega dysproporcjonowaniu do tlenu i nadtlenku
związek chemiczny, zawierający jon , w przypadku związków jonowych, lub ugrupowanie (w przypadku związków kowalencyjnych)
reakcja chemiczna, w której ta sama substancja jest zarówno utleniaczem, jak i reduktorem
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1997 i wyd. następne.