Przeczytaj
W jaki sposób podzielony jest układ okresowy pierwiastków?
Układ okresowy podzielony jest na bloki: , , i . Pierwiastki bloku należą do grup –.

Pierwiastki bloku wykazują właściwości pośrednie pomiędzy pierwiastkami bloku i . Metale znajdujące się w grupie i mają właściwości zbliżone do metali alkalicznychmetali alkalicznych. Mogą zapalać się na powietrzu. Wraz ze wzrostem numeru grupy reaktywność pierwiastków zaczyna maleć aż do grupy , gdzie znajdują się metale szlachetnemetale szlachetne. W grupie reaktywność metali zaczyna wzrastać, jednakże ich reaktywność nie jest tak wysoka, jak reaktywność metali alkalicznych. Ich właściwości są zbliżone do metali z bloku układu okresowego.
Metale bloku wykazują typowe właściwości metaliczne, to znaczy posiadają połysk, dobrze przewodzą ciepło oraz prąd elektryczny, są również kowalne i wytrzymałe mechanicznie.
Właściwości fizyczne pierwiastków z bloku
Temperatury topnienia, wrzenia oraz gęstość
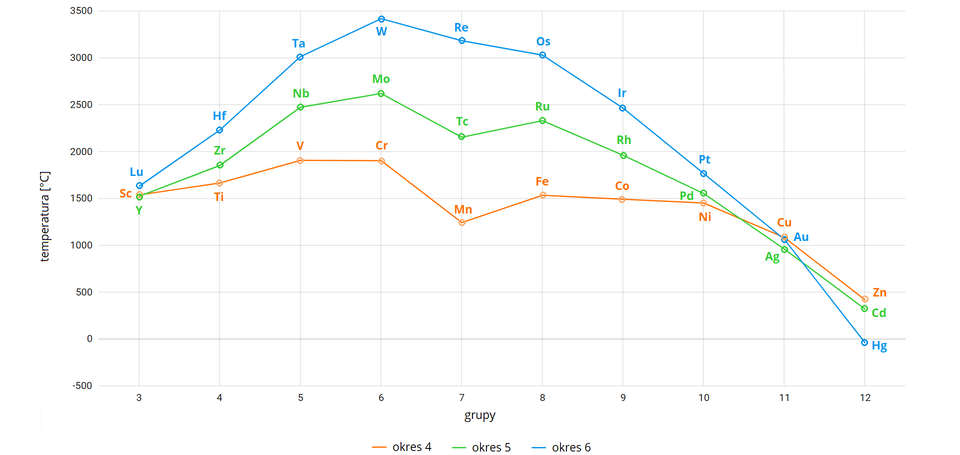
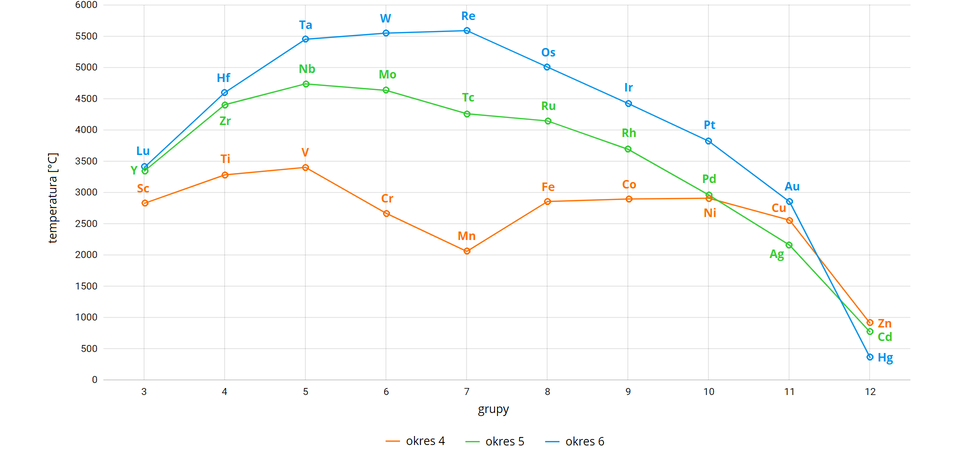
Analizując powyższe wykresy, możemy zauważyć, że w dół grup, to jest od do , rosną temperatury topnienia i wrzenia pierwiastków. Takiego trendu nie obserwuje się dla grup: , i .
Najwyższe temperatury topnienia wykazują pierwiastki okresu układu okresowego: wolfram (), ren () oraz osm (). Temperatura topnienia tych pierwiastków jest najwyższa w układzie okresowym. Jednocześnie można zauważyć, że najniższe temperatury topnienia wykazują wspomniane powyżej pierwiastki grupy (cynk, kadm oraz rtęć), a dla rtęci temperatura topnienia jest tak niska (), że w temperaturze pokojowej metal ten występuje w postaci ciekłej. Wynika to z całkowicie wypełnionej powłoki , a co za tym idzie, orbitale nie mogą brać udziału w tworzeniu wiązań metal–metal.

Rtęć zyskała swoją popularność za sprawą wykorzystania tego ciekłego metalu w tradycyjnych termometrach. Termometr rtęciowy jest zbudowany z wąskiej, szklanej rurki, ze skalą temperatury oraz zbiorniczkiem na ciecz u dołu. Zbiorniczek ten jest wypełniony rtęcią. Wraz ze wzrostem temperatury ciecz się rozszerza (zwiększa swoją objętość), przez co jest wypychana w górę rurki. Z poziomu cieczy odczytywana jest bezpośrednio wartość temperatury. Ze względu na szklaną obudowę, termometr taki było bardzo łatwo rozbić, a w konsekwencji narazić się na toksyczne działanie rtęci. Z tego powodu termometr rtęciowy został na mocy dyrektywy unijnej wycofany ze sprzedaży.
grupa | grupa | grupa | grupa | grupa | grupa | grupa | grupa | grupa | grupa |
skand | tytan | wanad | chrom | mangan | żelazo | kobalt | nikiel | miedź | cynk |
itr | cyrkon | niob | molibden | technet | ruten | rod | pallad | srebro | kadm |
lutet | hafn | tantal | wolfram | ren | osm | iryd | platyna | złoto | rtęć |
Charakterystyczną cechą metali bloku jest ich wysoka gęstość. Wyjątek stanowią: skand (), itr () oraz tytan (). Pozostałe pierwiastki mają gęstość powyżej . Najwyższą gęstością w układzie okresowym charakteryzuje się osm (), iryd () oraz platyna (). Tak duże wartości gęstości spowodowane są gęstym upakowaniem atomów w strukturze krystalicznej.
Wyznacz masy sześcianów o długości krawędzi równej , wykonanych ze skandu i z osmu.
Wyznacz masy sześcianów o długości krawędzi równej , wykonanych ze skandu i z osmu.

Wysoka temperatura topnienia została wykorzystana w żarówkach. Cienki wolframowy drucik umieszczany jest w szklanej bańce wypełnionej gazem szlachetnym – argonem, domieszkowanym azotem. Pod wpływem prądu nagrzewa się do temperatury –, wskutek czego rozgrzany metal zaczyna wydzielać światło.
Barwa metali bloku
Zdecydowana większość metali w świetle widzialnym ma połyskliwy, jasnoszary kolor, różniący się w niektórych przypadkach tylko odcieniem tej szarości. Dzieje się tak dlatego, że metale zazwyczaj bardzo dobrze odbijają wszystkie długości fal z zakresu światła widzialnego (światło odbite ma więc taki sam kolor, jak światło padające).
Złoto oraz miedź różnią się tym, że nie odbijają efektywnie fal z krótkofalowego zakresu widma (o długości poniżej ). Z tego powodu fioletowe i niebieskie światło nie odbija się od tych metali. Światłu odbitemu brakuje niebieskiej i fioletowej składowej, stąd nasze oko widzi ten efekt jako żółty (złoto) bądź pomarańczowy (miedź). Przyczyną takiego zachowania jest struktura elektronowa atomów tych metali.
Przewodnictwo elektryczne
Metale bloku wykazują się dobrym przewodnictwem elektrycznym. Najlepsze właściwości przewodzące prąd elektryczny mają przedstawiciele jedenastej grupy układu okresowego – miedziowce. Miedź, srebro oraz złoto wykazują dobre właściwości przewodnictwa elektrycznego ze względu na obecność elektronów o dużej ruchliwości, które znajdują się na niezapełnionej podpowłoce – konfiguracja każdego pierwszego stanu wzbudzonego atomów tych pierwiastków to . Pozostałe metale w grupie również przewodzą prąd elektryczny, jednakże jest to spowodowane niecałkowicie zapełnioną podpowłoką , w której to elektrony są mniej ruchliwe, niż te znajdujące się na podpowłokach .
Elektroujemność
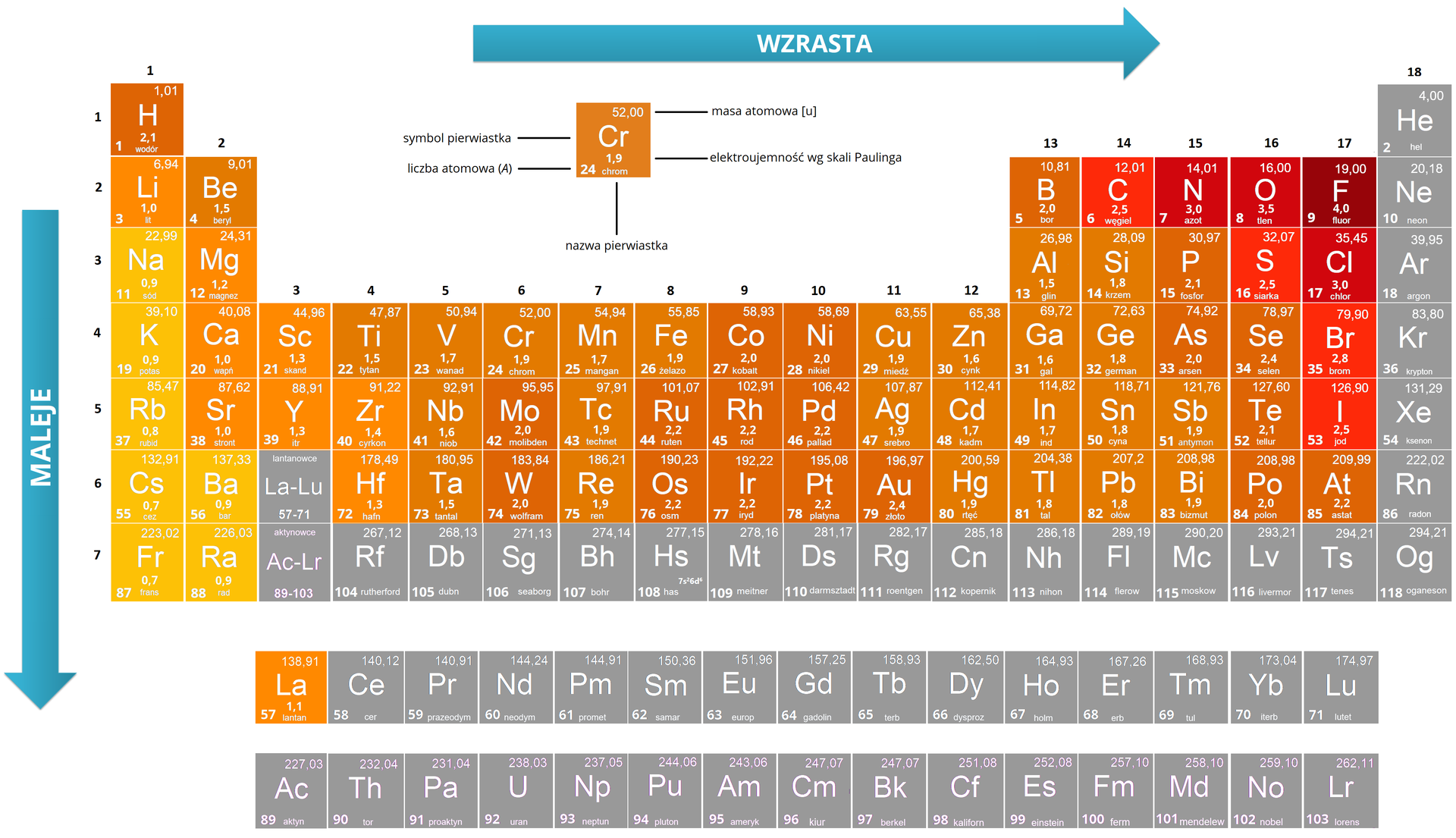
Ogólny trend dla wszystkich poznanych pierwiastków układu okresowego jest taki, że wraz ze wzrostem liczby atomowej elektroujemność w grupie maleje, wzrasta natomiast w okresie. W bloku dzieje się tak dokładnie dla grup od do . Jednak w przypadku metali przejściowych występują liczne odstępstwa od tej reguły. Na przykład dla grup od do . elektroujemność ma tendencję wzrostową wraz ze wzrostem liczby atomowej.
Reaktywność
Większość z metali znajdujących się w bloku układu okresowego wykazuje ujemne potencjały standardowepotencjały standardowe, to znaczy w reakcjach z kwasami nieutleniającymi wypierają wodór z kwasu. Jednak pierwiastki należące do grupy układu okresowego (miedź, srebro, złoto oraz platyna, rtęć i ren) wykazują dodatnie potencjały standardowe, to znaczy nie reagują z kwasami nieutleniającymi, reagując tylko z kwasami utleniającymikwasami utleniającymi.
Złoto reaguje z wodą królewskąwodą królewską. W źródłach można znaleźć różne opisy zachodzenia tej reakcji, jednak aktualnie najpowszechniejszym z nich jest opis, w którym to kwas azotowy() utlenia złoto, w wyniku czego powstają jony , mogące wchodzić w reakcje z kwasem chlorowodorowym. Sumaryczny zapis tej reakcji wygląda następująco:
Ponadto pierwiastki bloku charakteryzuje inertnośćinertność chemiczna względem warunków atmosferycznych oraz tlenu (z wyjątkiem itru). Pierwiastki te są trwałe na powietrzu, ale pod wpływem tlenu pokrywają się szczelną warstewką tlenku, który nie pozwala na dalszą reaktywność. Zjawisko to nazywane jest pasywacjąpasywacją.
Podsumowanie
Pierwiastki bloku charakteryzują wysokie temperatury topnienia oraz dobre przewodnictwo cieplne i elektryczne. Właściwości pierwiastków zmieniają się wraz z położeniem w grupie, a co za tym idzie, wraz z zapełnianiem podpowłoki kolejnymi elektronami. Dzięki swoim właściwościom pierwiastki bloku znajdują szerokie spektrum zastosowań.
Słownik
pierwiastki pierwszej grupy układu okresowego; wykazują wysoką reaktywność
metale odporne chemiczne. Do grupy metali szlachetnych zalicza się na przykład złoto, srebro oraz platynę
potencjał elektrody znajdującej się w stanie standardowym; jest to miara reaktywności metali, im bardziej ujemny, tym metal aktywniejszy
kwasy będące silnymi utleniaczami, to znaczy w wyniku reakcji chemicznej zwiększają stopień utlenienia pierwiastka wchodzącego z nim w reakcję
obojętność względem danych warunków
pokrywanie się metalu szczelną, cienką warstewką tlenku, co zapobiega jego dalszemu utlenianiu
(łac. aqua regia – oznacza dosłownie wodę królewską) mieszanina stężonych kwasów – solnego (chlorowodorowego) i azotowego() w stosunku , a więc objętości stężonego kwasu chlorowodorowego i objętość stężonego kwasu azotowego(). Woda królewska wykazuje silne właściwości utleniające, przez co może roztwarzać większość metali w układzie okresowym już w warunkach temperatury pokojowej
Bibliografia
Atkins P., Jones L., Podstawy chemii fizycznej, Warszawa 2009.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2007.
Pajdowski L., Chemia ogólna, Warszawa 2002.