Przeczytaj
Alkohole monohydroksylowe pierwszorzędowe
Alkohole pierwszorzędowe reagują z manganianem() potasu w środowisku kwasowym, np. kwasu siarkowego(), w analogiczny sposób jak z dichromianem() potasu w środowisku kwasowym. Zatem utleniają się do kwasów karboksylowych, natomiast manganian() potasu redukuje się do siarczanu() manganu().
Reakcja ta zachodzi dwuetapowo, gdzie w pierwszym etapie zachodzi utlenianie alkoholu do aldehydu:

Powstały aldehyd jest nietrwały w warunkach reakcji i łatwo utlenia się do kwasu karboksylowego, co stanowi drugi etap reakcji:

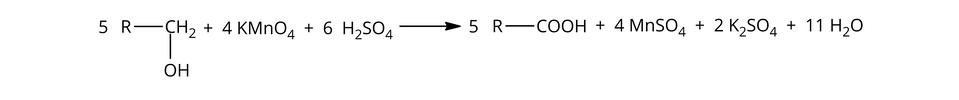
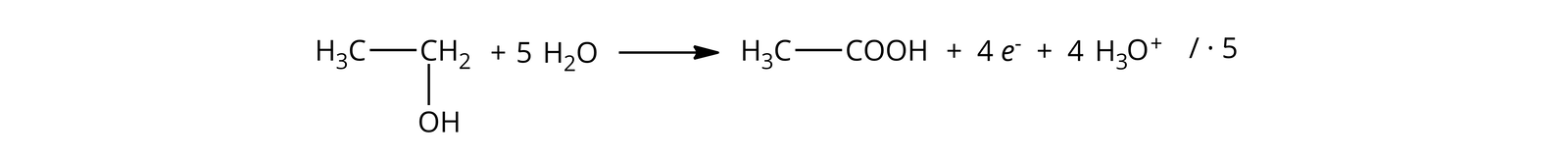
Ostatecznie, reakcję utleniania monohydroksylowych alkoholimonohydroksylowych alkoholi pierwszorzędowych do kwasów karboksylowych można zapisać następującym równaniem:
Obserwując przebieg reakcji, widzimy, że fioletowy roztwór manganianu() potasu odbarwia się, co wynika z redukcji jonów manganianowych() do kationów manganu().

Przykładowo, etanol reaguje z manganianem() potasu w środowisku kwasu siarkowego(), w wyniku czego powstaje kwas octowy, siarczan() manganu(), siarczan() potasu i woda, zgodnie z zapisem cząsteczkowym równania reakcji chemicznej:
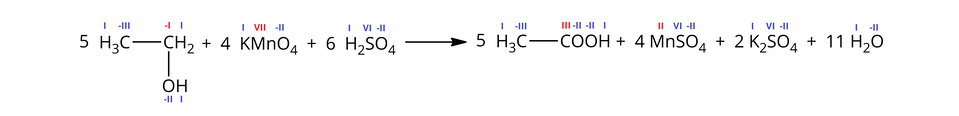
Z uwagi na to, że zarówno manganian() potasu, jak i kwas siarkowy() ulegają w wodzie dysocjacji, można zapisać równanie tej reakcji w formie jonowej:
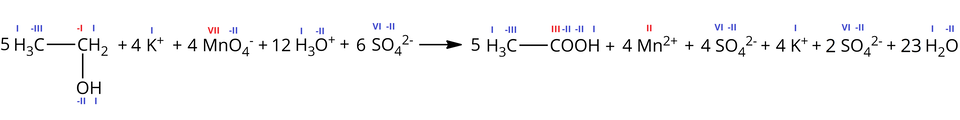
Z kolei po odjęciu stronami powtarzających się reagentów, otrzymujemy zapis jonowy skrócony, który w sposób przejrzysty ukazuje zmianę stopni utlenienia oraz wymianę ładunków między atomami biorącymi udział w tej reakcji:
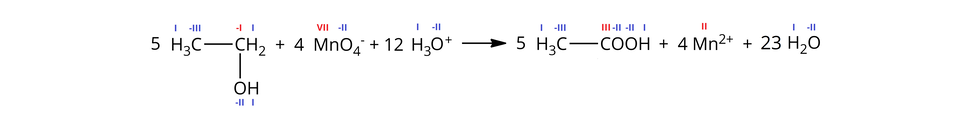
W powyższej reakcji nastąpiło utlenienie atomu węgla w grupie (stopień utlenienia: ) do atomu węgla w grupie karboksylowej (stopień utlenienia: ) oraz redukcja anionu manganianowego() (stopień utlenienia atomu manganu: ) do kationu manganu() (stopień utlenienia atomu manganu: ).
Współczynniki stechiometryczne uzupełniono, posługując się bilansem elektronowo‑jonowym:
Równanie reakcji redukcji:

Równanie reakcji utleniania:
Alkohole monohydroksylowe drugorzędowe
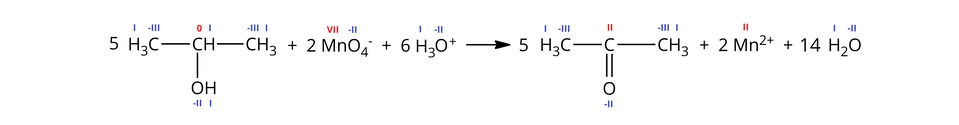
Alkohole drugorzędowe reagują z manganianem() potasu w środowisku kwasowym, np. kwasu siarkowego(), w analogiczny sposób jak z dichromianem() potasu w środowisku kwasowym. Zatem utleniają się do ketonów, natomiast manganian() potasu redukuje się do siarczanu() manganu(), zgodnie ze schematycznym zapisem równania reakcji chemicznej:
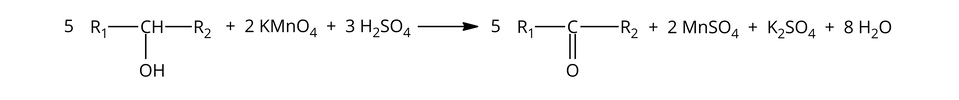
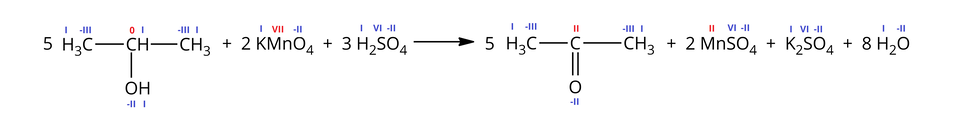
Podobnie jak w przypadku alkoholi pierwszorzędowych, fioletowy roztwór (manganianu() potasu) odbarwia się w wyniku zachodzenia reakcji. Przykładowo propan--ol reaguje z manganianem() potasu w środowisku kwasu
siarkowego(), w wyniku czego powstaje propan--on, siarczan() manganu(), siarczan() potasu i woda, zgodnie z zapisem cząsteczkowym równania reakcji chemicznej:
Z uwagi na zachodzący proces dysocjacji manganianu() potasu i kwasu siarkowego(), można zapisać powyższe równanie w formie jonowej:
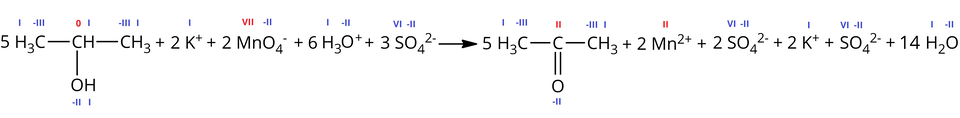
A po skróceniu powtarzających się składników, otrzymujemy zapis jonowy skrócony:
W powyższej reakcji nastąpiło utlenienie atomu węgla w grupie (stopień utlenienia: ) do atomu węgla w grupie karbonylowej (stopień utlenienia:
) oraz redukcja anionu manganianowego() (stopień utlenienia atomu manganu: ) do kationu manganu() (stopień utlenienia atomu manganu: ).
Współczynniki stechiometryczne uzupełniono, posługując się bilansem elektronowo‑jonowym:
Równanie reakcji redukcji:

Równanie reakcji utleniania:

Alkohole monohydroksylowe trzeciorzędowe
Utlenianie alkoholi trzeciorzędowych nie zachodzi lub prowadzi do rozpadu cząsteczek na mniejsze fragmenty.
Alkohole polihydroksylowe
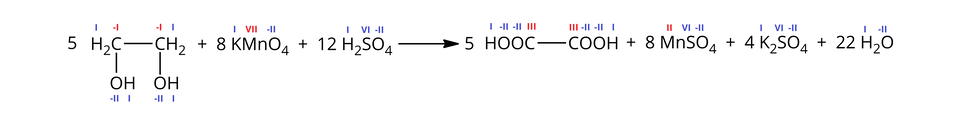
Alkohole polihydroksylowe również reagują z manganianem() potasu w środowisku kwasu siarkowego(), w analogiczny sposób jak alkohole pierwszo- i drugorzędowe, zależnie od tego, czy grupa hydroksylowa w danym alkoholu polihydroksylowymalkoholu polihydroksylowym zlokalizowana jest przy -rzędowym lub -rzędowym atomie węgla. Reakcji utleniania alkoholi polihydroksylowych również towarzyszy odbarwienie roztworu jonów manganianowych(). Przykładem jest reakcja chemiczna etano-,-diolu z manganianem() potasu w środowisku kwasu siarkowego(), w wyniku czego powstaje kwas szczawiowy, siarczan() manganu(), siarczan() potasu i woda. Poniżej przedstawiono równanie reakcji w formie cząsteczkowej:
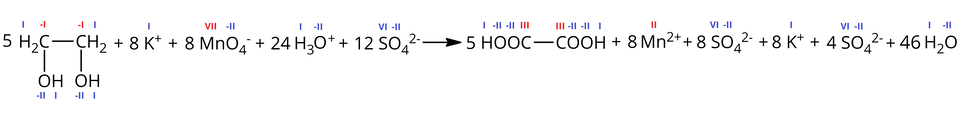
A z racji zachodzącego procesu dysocjacji kwasu siarkowego() i manganianu() potasu, można zapisać je także w formie jonowej:
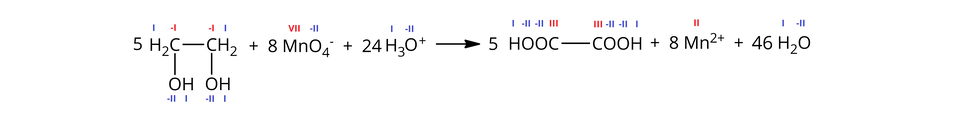
A po uproszczeniu powtarzających się po obydwu stronach reagentów również w formie jonowej skróconej:
W powyższej reakcji nastąpiło utlenienie dwóch atomów węgla w grupie (stopień utlenienia: ) do atomu węgla w grupie karboksylowej (stopień utlenienia: ) oraz redukcja anionu manganianowego() (stopień utlenienia atomu manganu: ) do kationu manganu() (stopień utlenienia atomu manganu: ).
Współczynniki stechiometryczne uzupełniono, posługując się bilansem elektronowo‑jonowym:
Równanie reakcji redukcji:

Równanie reakcji utleniania:

Manganian() potasu stosowany jest często w mieszaninach pirotechnicznych jako źródło tlenu. Dodanie gliceryny (glicerolu) powoduje samoistne rozpoczęcie widowiskowej reakcji. Glicerol działa w roli reduktora, powodującego wydzielanie nadmanganianu tlenu, natomiast tlen utlenia glicerynę. Ogólny wzór reakcji:

Słownik
alkohol zawierający jedną grupę hydroksylową ()
związek organiczny zawierający grupę karboksylową ()
kwas octowy , bezbarwna ciecz o charakterystycznym zapachu
związek organiczny zawierający grupę karbonylową połączoną z dwoma takimi samymi lub różnymi grupami, powstający przez utlenianie alkoholu drugorzędowego
aceton , lotna ciecz o ostrym zapachu
kwas szczawiowy , związek organiczny, bezbarwna substancja krystaliczna o działaniu trującym
alkohol zawierający kilka grup hydroksylowych ()
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Kaznowski K., Chemia. Vademecum maturalne, Warszawa 2016.