Przeczytaj
Trudno przecenić znaczenie związków koordynacyjnychzwiązków koordynacyjnych w otaczającym nas świecie. Związki te biorą udział w reakcjach fotosyntezy, transporcie tlenu w organizmach żywych czy w gospodarce jonów , , , . Katalizują wiele procesów biochemicznych i chemicznych, poza tym odgrywają również istotną rolę w chemii analitycznej. Służą do wykrywania, rozdzielania, zatężania lub maskowania niektórych jonów.
Zastosowania związków koordynacyjnych
Ekstrakcja metali
Metale szlachetne, takie jak srebro i złoto, są wydobywane z rudy poprzez tworzenie związków kompleksowych cyjanku.
Analiza jakościowa i ilościowa
Tworzenie związków koordynacyjnych ma ogromne znaczenie w identyfikacji większości jonów nieorganicznych oraz rozdzieleniu jonów, np.:
Jony tworzą bardziej stabilne kompleksy z ligandami cyjankowymi niż jony . Poddając mieszaninę oraz działaniu , wytrąci się tylko , a nie . W ten sposób jon można łatwo wykryć i oddzielić od jonów .
Dimetyloglioksym (DMG) używany jest do wykrywania jonów i . DMG tworzy barwne osady związków kompleksowych z tymi jonami.

Do wykrywania jonów kobaltu(II) stosuje się jony tiocyjanianowe (jony rodankowe), które tworzą z nimi niebieskie rozpuszczalne związki kompleksowe. Jest to tzw. reakcja Vogla.

Do wykrywania jonów żelaza(III) stosuje się jony tiocyjanianowe (rodankowe), które tym razem tworzą rozpuszczalne związki kompleksowe o czerwonobrunatnej barwie:

Znaczenie biologiczne
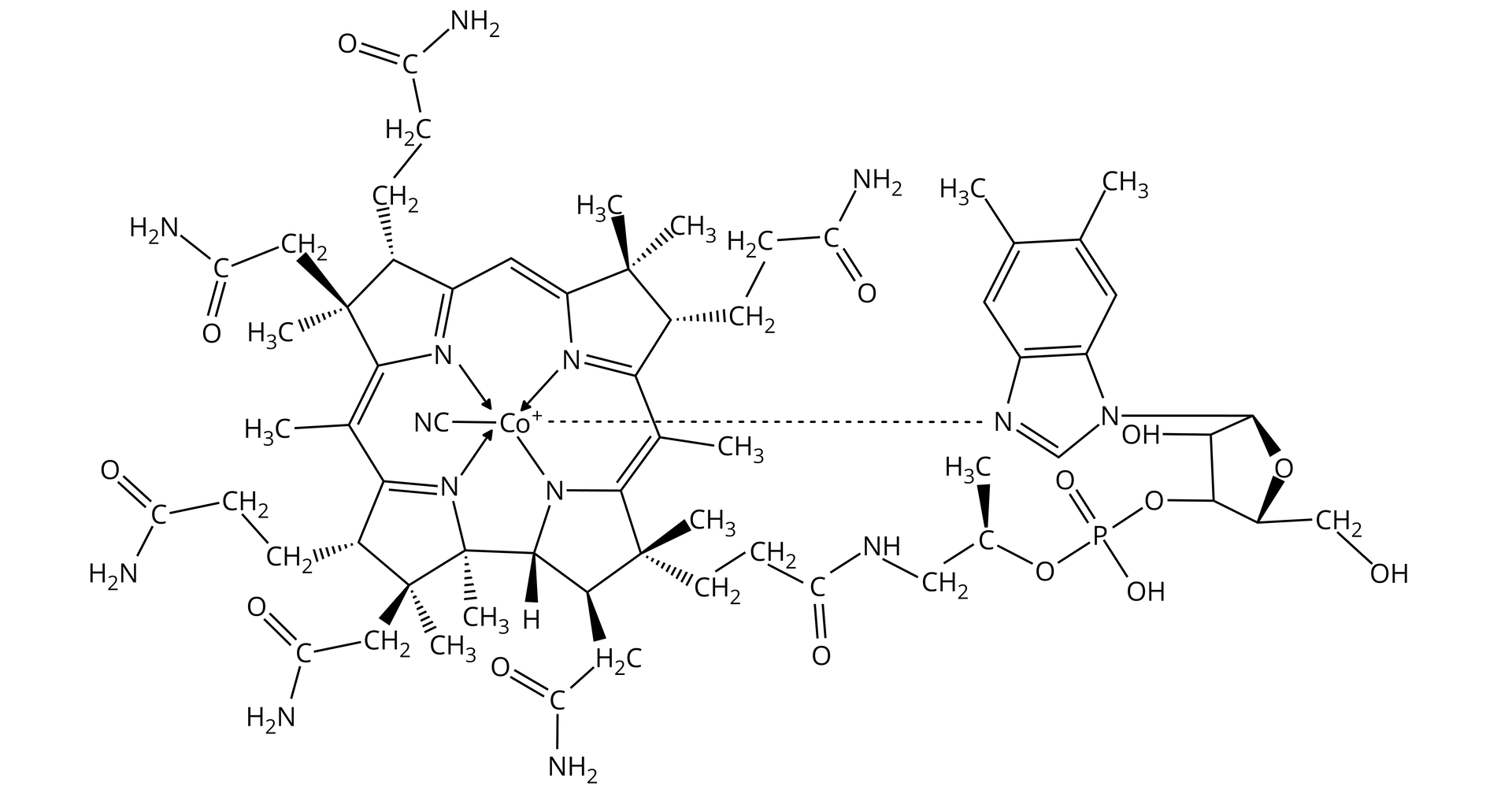
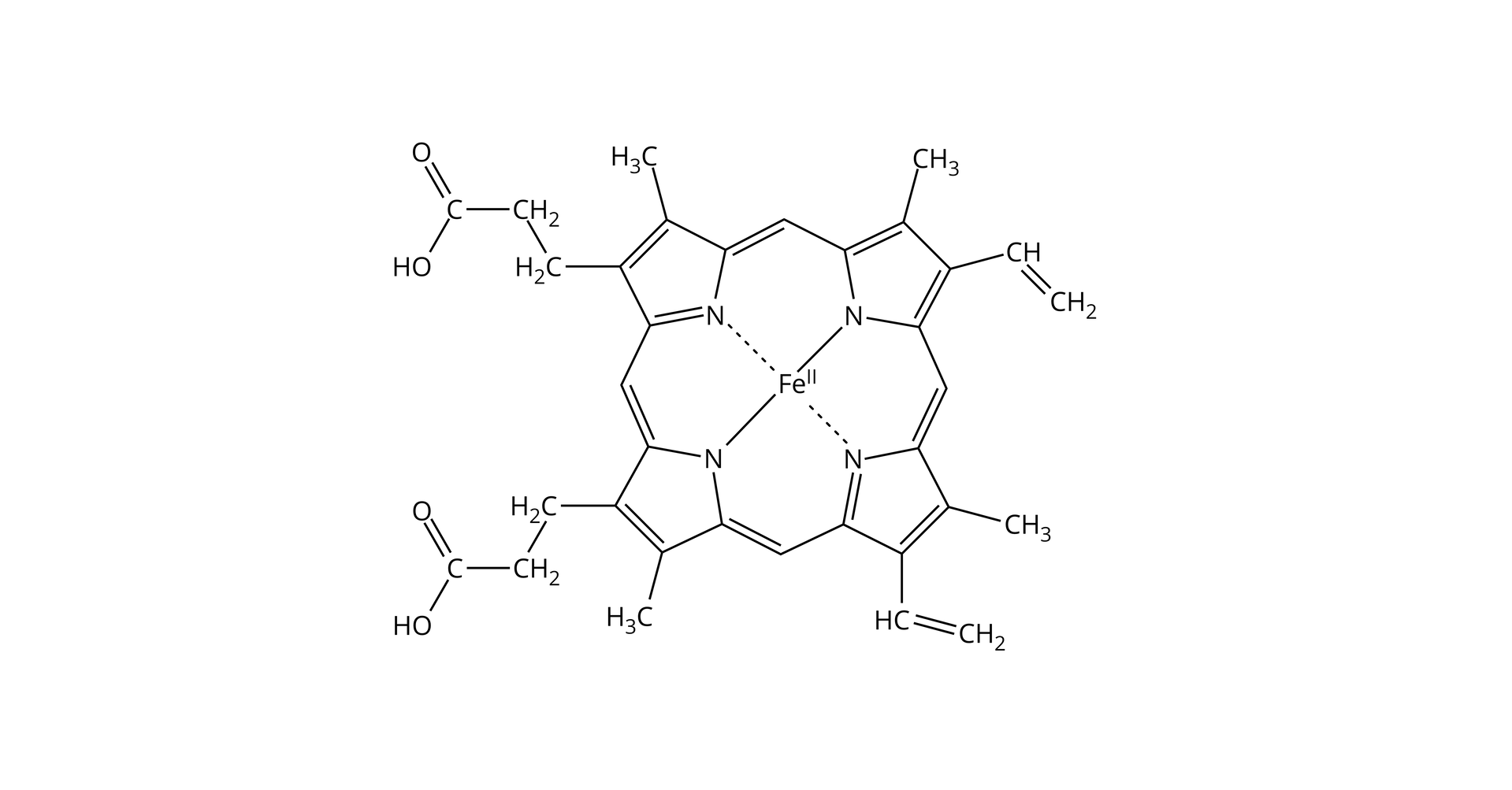
Związki koordynacyjne pełnią ważną rolę zarówno u roślin, jak i zwierząt czy ludzi. Przykładem może być chlorofil‑A (zawiera jon magnezu), witamina B12 (zawiera jon kobaltu(III)) czy czerwony barwnik krwi – hem, który jest związkiem koordynacyjnym żelaza(II), pełniącym funkcję nośnika tlenu.
Medycyna
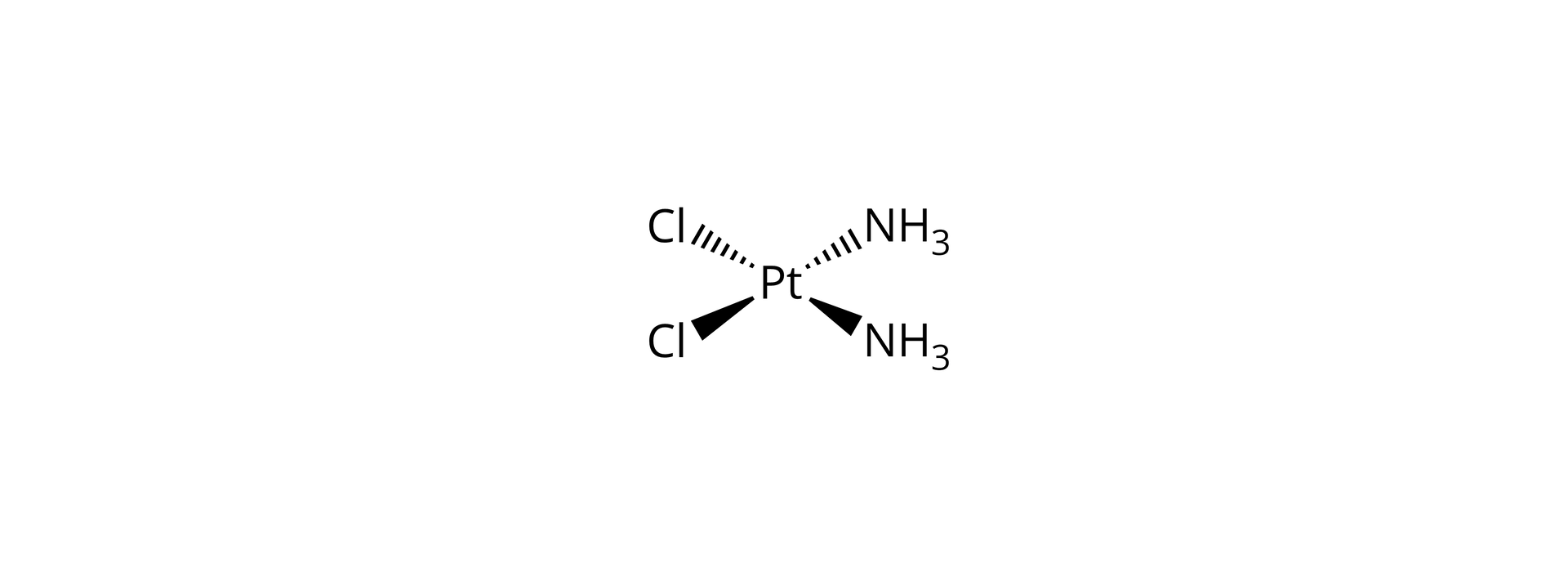
Działanie cisplatyny polega na jej wiązaniu się do DNA komórek nowotworowych. Tworzenie tych wiązań uniemożliwia replikację DNA i podział komórki. Wywiera też wpływ na funkcje metaboliczne, uruchamiając proces apoptozy komórki.

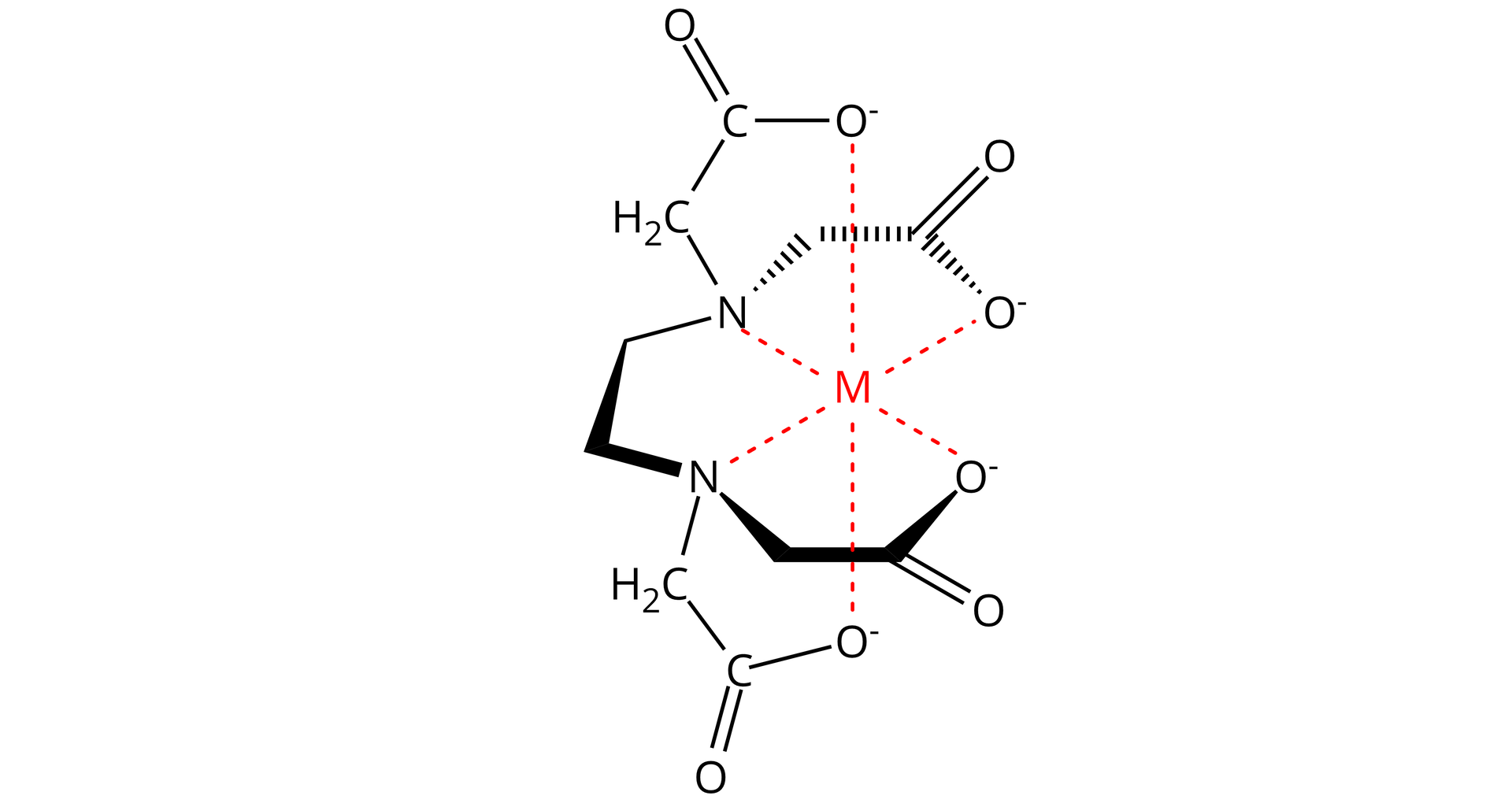
Z kolei EDTA (kwas (etylenodiamino)tetraoctowy) jest stosowany w leczeniu zatrucia jonami ołowiu czy rtęci. Tworzy bowiem z jonami tych metali bardzo trwałe związki kompleksowe, dzięki czemu zapobiega ich negatywnemu oddziaływaniu na organizm i umożliwia ich usunięcie z organizmu wraz z moczem.
Ważnym zastosowaniem EDTA jest maskowanie jonów metali. Maskowanie polega niejako na „ukryciu obecności danego jonu w roztworze”. Jony niektórych metali (na przykład: bizmutu, chromu(III), cynku, cyrkonu, glinu, kadmu, kobaltu, magnezu, miedzi, niklu, ołowiu, toru, wanadu, żelaza(III)) po związaniu z ligandem chelatowym EDTA tworzą na tyle trwałe związek koordynacyjny, że pozostają nieczułe na wpływ innych odczynników. Pozwala to na wykonanie innych reakcji chemicznych w takim roztworze, które można prowadzić tak, jakby jonu maskowanego w roztworze po prostu nie było.
Twardość wody
EDTAEDTA jest szeroko stosowanym czynnikiem kompleksującym wiele kationów metali , , , zwykle w postaci soli disodowej, ze względu na jej większą rozpuszczalność w wodzie. Również twardość wody można wyznaczać, stosując EDTA. Podczas miareczkowania twardej wody jony wapnia i magnezu tworzą stabilne związki kompleksowe z ligandem EDTA.
Barwniki handlowe
Błękit pruski, czyli , używany jest jako dodatek do tuszy, kosmetyków i farb. Można go spotkać w wielu dziełach sztuki. Po raz pierwszy otrzymany przez alchemika i farbiarza Deisbacha w 1704 r. w Berlinie. Jak datę rozpoczęcia stosowania przez artystów uznaje się rok 1724.

Przykład dzieła, w którym można napotkać Błękit pruski, to „María de los Dolores Collado y Echagüe, duquesa de Bailén” Vincenta Palmaroliego.

Słownik
związki koordynacyjne lub związki kompleksowe to związki, w których atom metalu lub jon metalu jest związany przy pomocy wiązań koordynacyjnych z obojętnymi lub ujemnie naładowanymi cząstkami nazywanymi ligandami

kwas wersenowy, kwas edetynowy, komplekson II; łac. Acidum edeticum; organiczny związek chemiczny; kwas polikarboksylowy i jednocześnie alfa‑aminokwas; z mocnymi wodorotlenkami tworzy sole: werseniany; jest szeroko stosowanym czynnikiem kompleksującym wiele kationów metali
kopalina użyteczna będąca źródłem metali oraz niektórych niemetali
cecha wody, na którą wpływa obecność soli mineralnych
proces polegający na wiązaniu obcych jonów lub związków chemicznych w trwałe związki koordynacyjne (kompleksowe) za pomocą odpowiednich odczynników kompleksujących (odczynników maskujących) albo przeprowadzeniu pierwiastka na inny stopień utlenienia (zmianie ładunku jonu)
związki kompleksowe, w których ligandy zajmują więcej niż jedno miejsce koordynacyjne
Bibliografia
Kaczyński J., Czaplicki A., Chemia ogólna, Warszawa 1974.
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 1987.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.