Przeczytaj
Do nauki rysowania wzorów strukturalnychwzorów strukturalnych potrzebna jest wiedza na temat tego, czym one są i w jaki sposób możemy je uzyskać. Znane Ci wzory sumaryczne związków pozwalają na ustalenie składu pierwiastkowego związków (np. , ), ale nie dostarczają informacji na temat wzajemnego połączenia ze sobą atomów lub jonów, dlatego można je otrzymać ze wzorów strukturalnych. Podczas rysowania wzoru strukturalnego tlenkówtlenków istotne są poniższe informacje:
znajomość odpowiednich symboli pierwiastków tworzących dany tlenek;
znajomość charakteru wiązań pomiędzy atomami tlenu i drugiego pierwiastka – tu pomocne może być np. wyznaczanie różnicy elektroujemności między atomami, gdzie większa różnica będzie sugerować większe prawdopodobieństwo występowania wiązania jonowego.
Stopnie utlenienia pierwiastków w tlenkach
Czym jest stopień utlenienia?
Stopień utlenieniaStopień utlenienia to pojęcie umowne (zapisywane zazwyczaj cyfrą rzymską). W przypadku pierwiastka danego związku chemicznego, będzie to liczba dodatnich lub ujemnych ładunków elementarnych, jakie przypisalibyśmy atomom tego pierwiastka, gdyby wszystkie wiązania utworzone przez atom były jonowe.
Dwupierwiastkowe związki tlenu z atomami innych pierwiastków, w których tlen występuje na stopniu utlenienia, nazywane są tlenkami.
Należy również pamiętać, że suma stopni utlenienia wszystkich atomów wchodzących w skład tlenku równa jest zero.
W poniższej tabeli zaprezentowane zostały maksymalne stopnie utlenienia pierwiastków grup głównych w ich związkach z tlenem.
Numer grupy | Maksymalny stopień utlenienia pierwiastka w związkach z tlenem |
|---|---|
Poniższa tabela przedstawia przykładowe wzory tlenków różnych pierwiastków oraz ich stopnie utlenienia.
Nazwa systematyczna tlenku | Wzór sumaryczny tlenku | Stopień utlenienia pierwiastka względem tlenu |
|---|---|---|
Tlenek sodu | ||
Tlenek litu | ||
Tlenek wapnia | ||
Tlenek magnezu | ||
Tlenek skandu() | ||
Tlenek tytanu() | ||
Tlenek wanadu() | ||
Tlenek chromu() | ||
Tlenek manganu() | ||
Tlenek żelaza() | ||
Tlenek kobaltu() | ||
Tlenek niklu() | ||
Tlenek miedzi() | ||
Tlenek cynku | ||
Tlenek glinu | ||
Tlenek węgla() | ||
Tlenek węgla() | ||
Tlenek ołowiu() | ||
Tlenek ołowiu() | ||
Tlenek azotu() | ||
Tlenek azotu() | ||
Tlenek azotu() | ||
Tlenek siarki() | ||
Tlenek siarki() | ||
Tlenek chloru() | ||
Tlenek chloru() | ||
Tlenek chloru() |
Dla niektórych pierwiastków, np. dla żelaza i ołowiu, oprócz tlenków prostych (z jednym stopniem utlenienia dla metalu), występują również tlenki mieszane, w których część atomów znajduje się na innym stopniu utlenienia niż pozostałe atomy tego pierwiastka. Do przykładów takich tlenków należą: – tlenek żelaza() diżelaza(), w którym żelazo występuje na stopniach utlenienia i ; – tlenek diołowiu() ołowiu() z dwoma stopniami utlenienia: i dla ołowiu.
Jak narysować wzór strukturalny tlenku? Schemat działań
Aby prawidłowo zapisać wzór strukturalny tlenku, należy określić, jaki rodzaj wiązań występuje pomiędzy atomami tlenu i drugiego pierwiastka. Tutaj pomocne mogą okazać się poniższe wskazówki:
czy drugi pierwiastek jest niemetalem – w tym wypadku mamy zawsze do czynienia ze związkiem kowalencyjnym;
jeśli drugi pierwiastek jest metalem występującym w tlenkach na jednym stopniu utlenienia, a różnica elektroujemności między danym pierwiastkiem a tlenem jest większa od , to z reguły mamy do czynienia ze związkiem jonowym;
jeśli drugi pierwiastek jest metalem występującym w tlenkach na jednym stopniu utlenienia, a różnica elektroujemności między danym pierwiastkiem a tlenem jest mniejsza od , to z reguły mamy do czynienia ze związkiem kowalencyjnym – ta i powyższa reguła dotyczą przede wszystkim metali z bloku i ;
jeśli drugi związek jest metalem mogącym występować w tlenkach na różnych stopniach utlenienia, wtedy dla tlenków metali na niższych stopniach utlenienia będzie to związek jonowy, z kolei wraz ze wzrostem stopnia utlenienia metalu charakter wiązania staje się coraz bardziej kowalencyjny (dla metali na , i wyższych stopniach utlenienia ich tlenki są związkami kowalencyjnymi) – ta reguła znajduje zastosowanie przede wszystkim w przypadku metali z bloku .
We wzorach strukturalnych, do narysowania wiązań kowalencyjnych pomiędzy atomami posługujemy się kreskami (które łączą dwa atomy pierwiastków), jedna kreska oznacza jedno wiązanie. Inna zasada tworzenia wzorów strukturalnych obowiązuje dla tlenków o wiązaniach jonowych, które tworzą kryształy jonowe (np.: , , , , , , , , , , , , ).
Tlenki kowalencyjne
Omówmy najpierw wzory tlenków o wiązaniach atomowych i atomowych spolaryzowanych, posługując się poniższym wzorem cząsteczki wody:
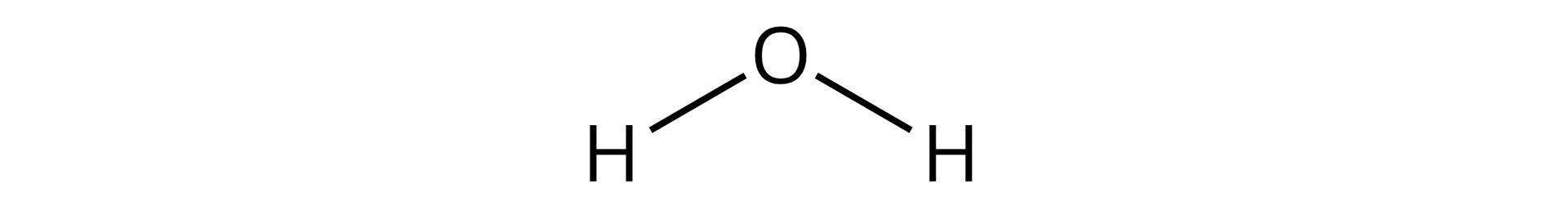
stopień utlenienia wodoru wynosi , na potwierdzenie czego zauważamy, że każdy atom wodoru tworzy po jednym wiązaniu, i tak:
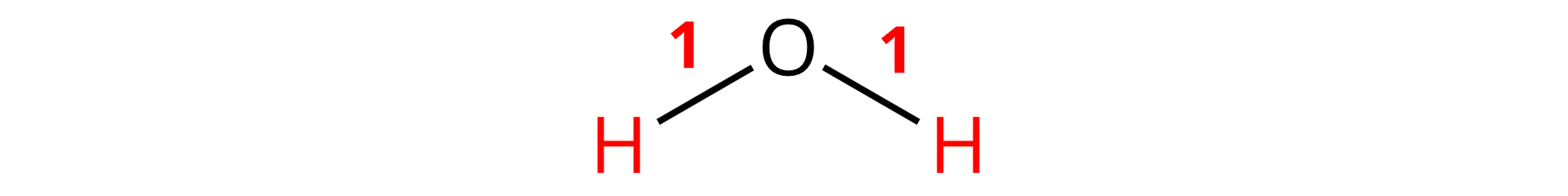
Analizując ten sam przykład pod względem atomu tlenu:
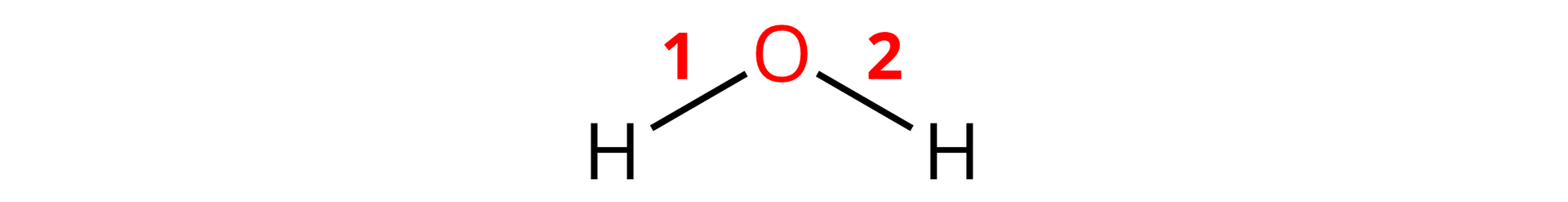
stopień utlenienia tlenu wynosi , zauważamy, że obecny w tej cząsteczce jeden atom tlenu tworzy dwa wiązania. Dla wodoru i metali grupy stopień utlenienia w tlenkach zawsze wynosi . Jednak istnieją pierwiastki, które mogą wykazywać różne stopnie utlenienia.
Tlenki jonowe
Wzory tlenków o wiązaniach jonowych rysujemy, wykorzystując do tego celu wzory Lewisa, w których wprowadzamy symbol pierwiastka i kropki, reprezentujące elektrony walencyjne tego atomu pierwiastka. Przykładowo:
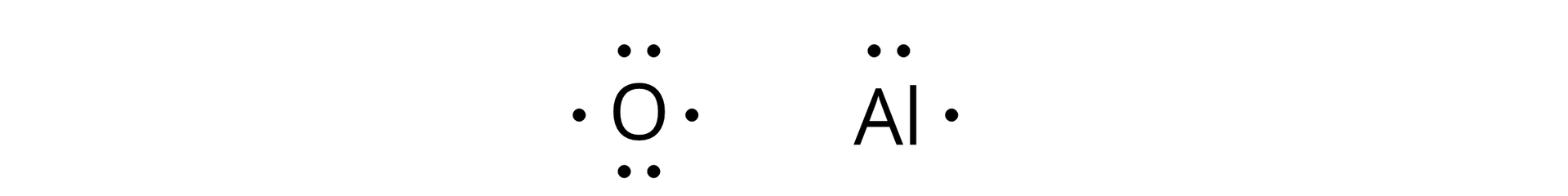
Para kropek symbolizuje dwa sparowane elektrony, natomiast pojedyncza – elektron niesparowany na orbitalu. Aby narysować wzór związku jonowego, należy przenieść elektrony będące przy symbolu atomu metalu do atomu niemetalu, uzupełniając w ten sposób jego powłokę walencyjną. Na koniec należy dopisać ładunki jonów równe liczbie przeniesionych elektronów przy symbolach atomów pierwiastków.

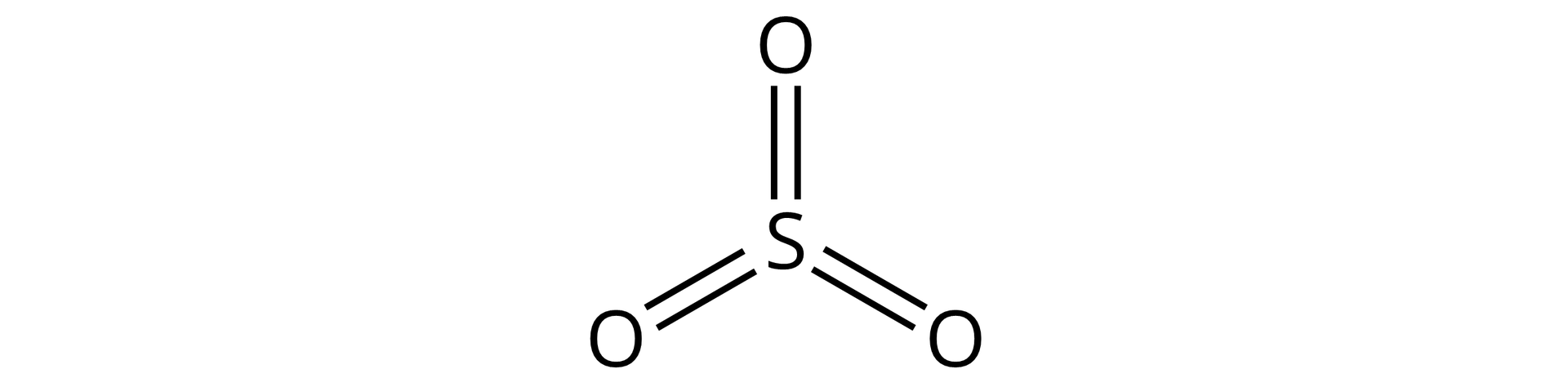
Narysuj wzór strukturalny tlenku siarki().
Dla pierwiastków z parzystym stopniem utlenienia należy narysować wszystkie kreski od jednego atomu pierwiastka, grupując je parami:
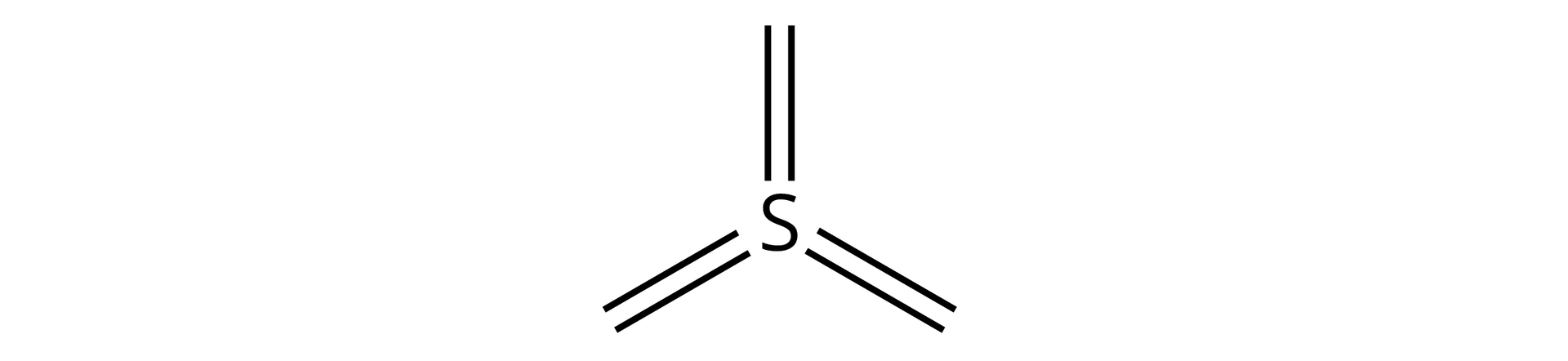
a następnie umieścić przy nich atomy tlenu, i tak:
Narysuj wzór strukturalny tlenku chloru().
Dla pierwiastków o nieparzystym stopniu utlenienia należy odpowiednią liczbę wiązań narysować od dwóch atomów tego pierwiastka, grupując część parami, a dwa pojedyncze wiązania skierować w jedno miejsce:
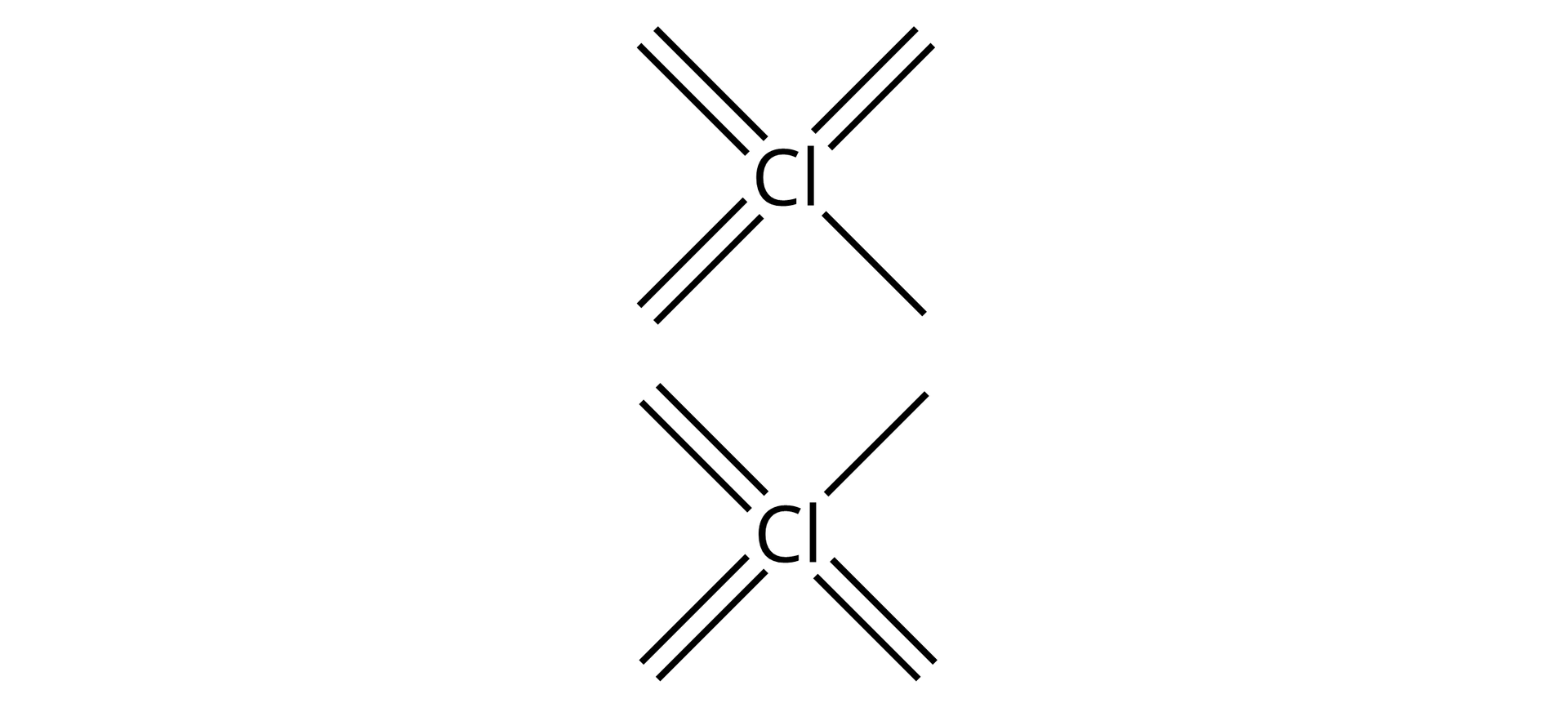
po czym umieścić przy nich atomy tlenu, a mianowicie:
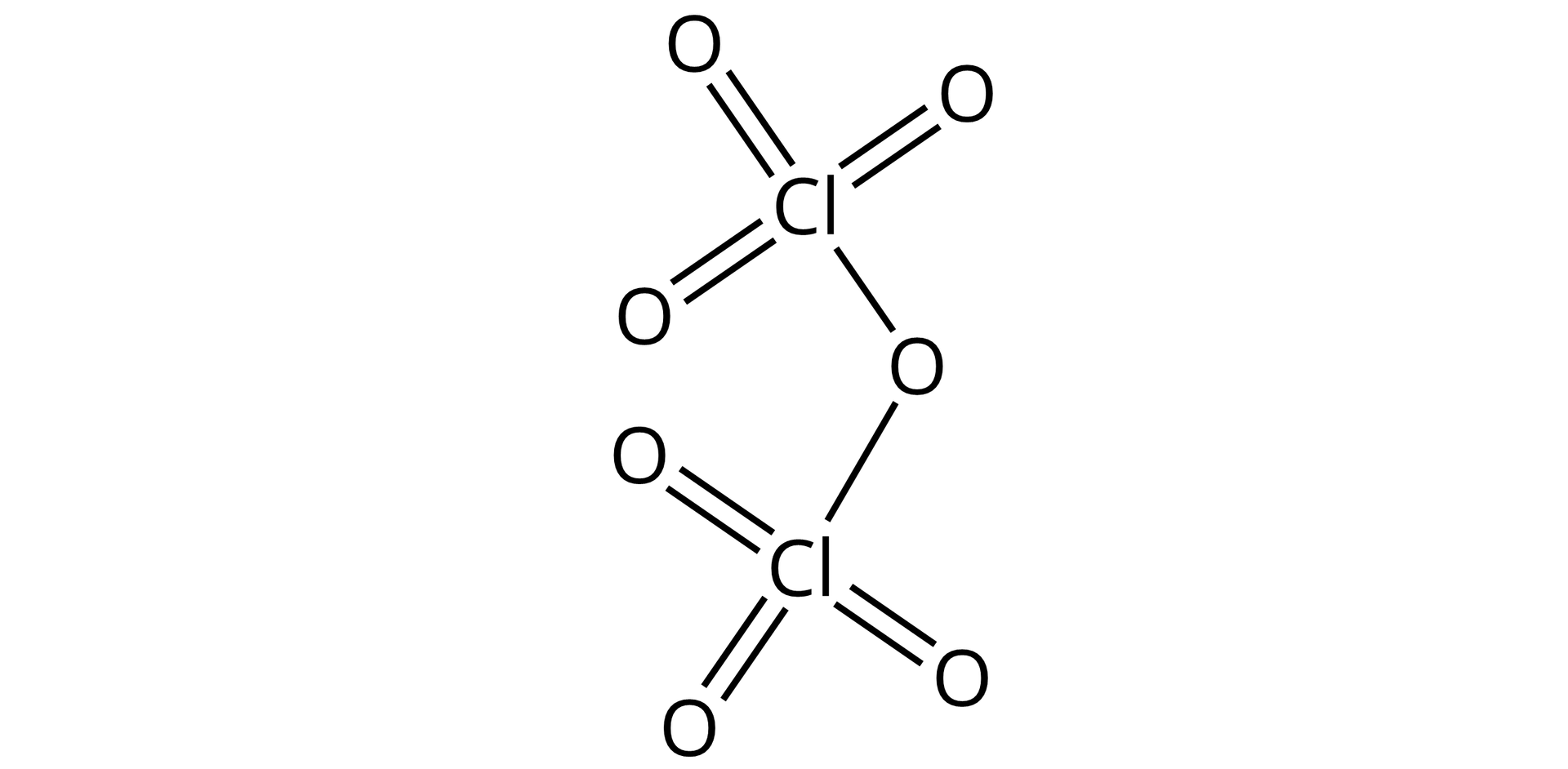
W przedstawionej poniżej tabeli skompletowano przykłady wzorów strukturalnych tlenków o różnych stopniach utlenienia pierwiastków względem tlenu. Aby w prosty sposób narysować wzór strukturalny tlenku dla innego pierwiastka, wystarczy w odpowiednim wzorze zastąpić symbol pierwiastka.
Wzór strukturalny | Stopień utlenienia | Rodzaj związku |
|---|---|---|
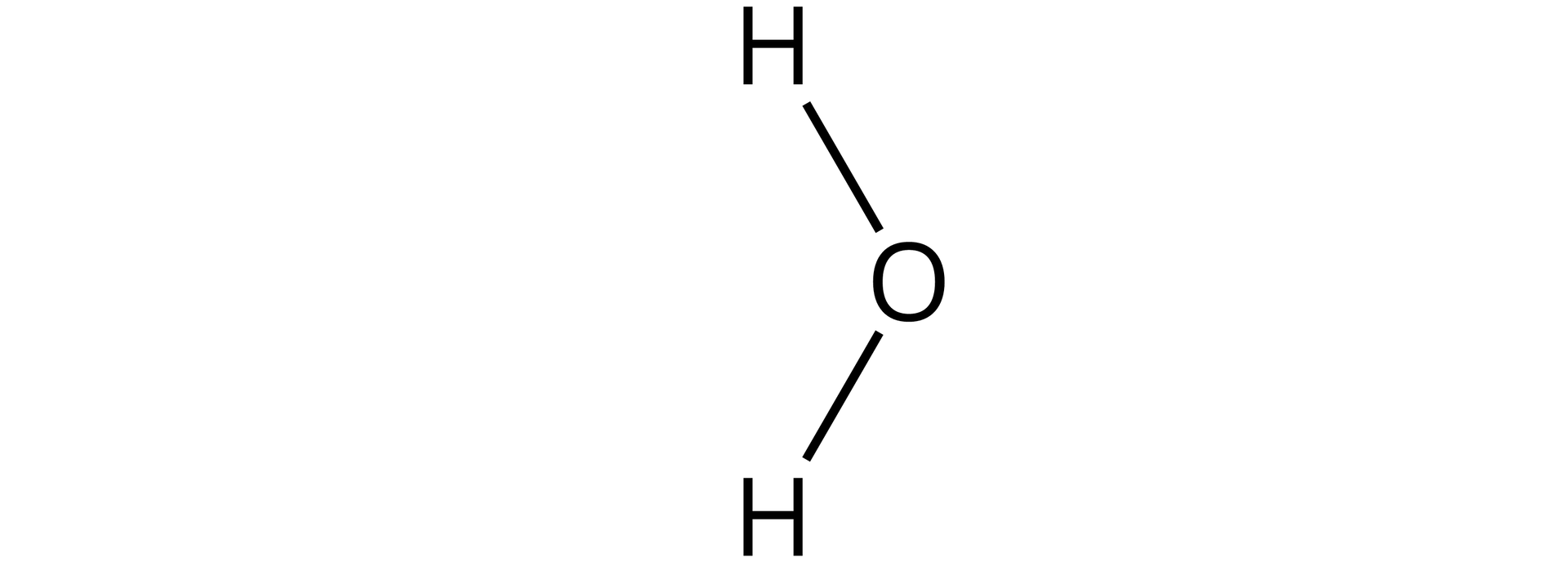 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kowalencyjny | |
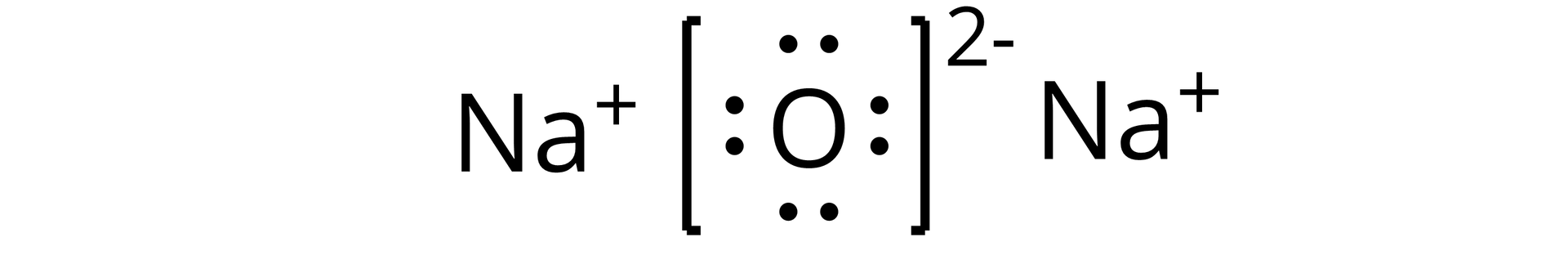 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | jonowy | |
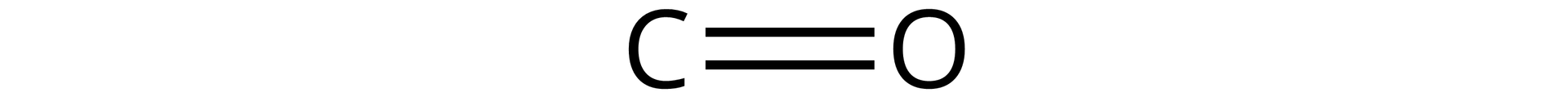 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kowalencyjny | |
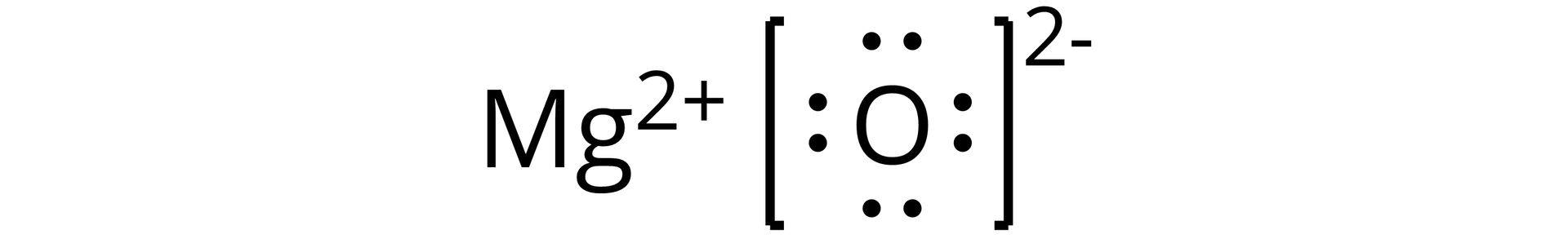 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | jonowy | |
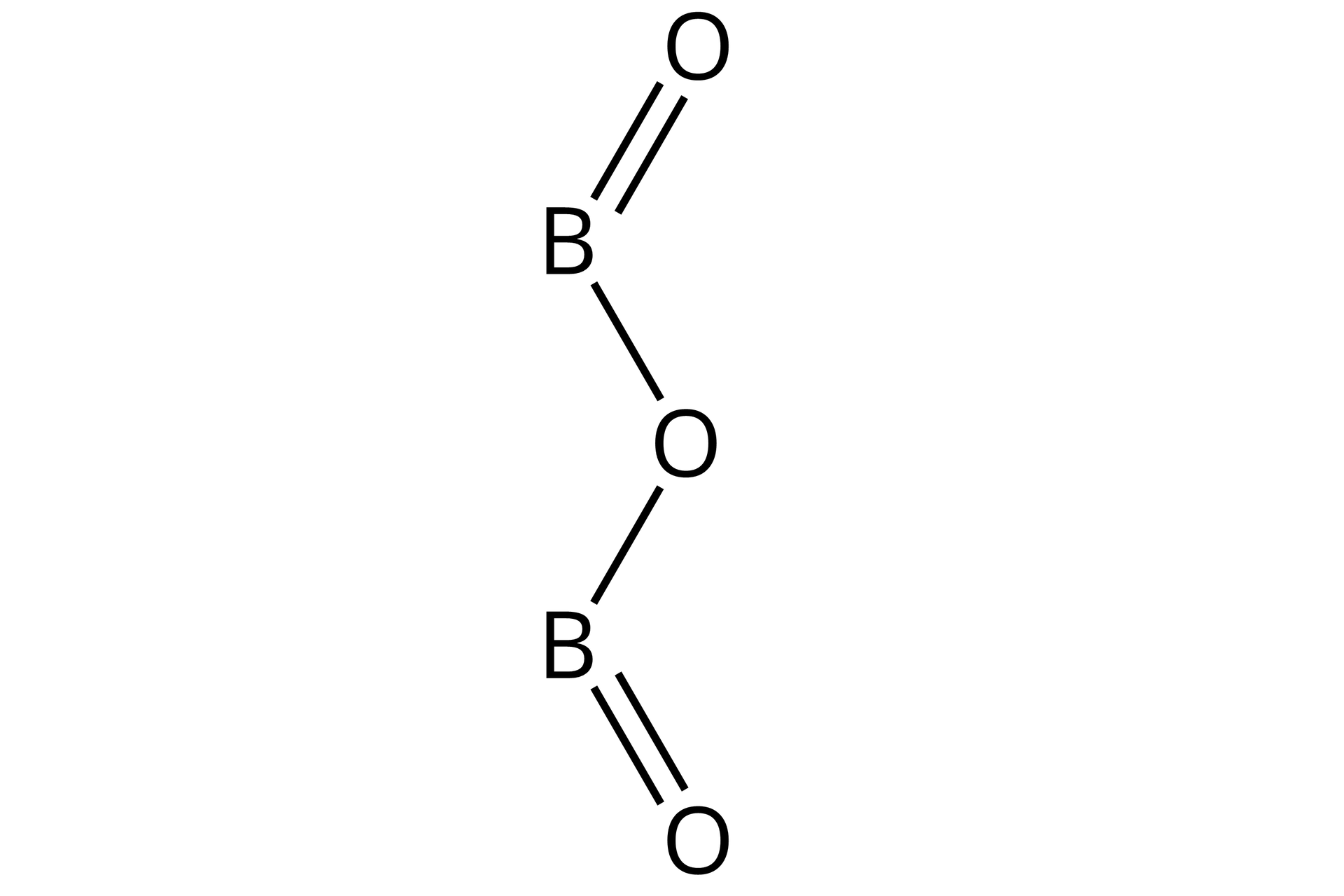 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kowalencyjny | |
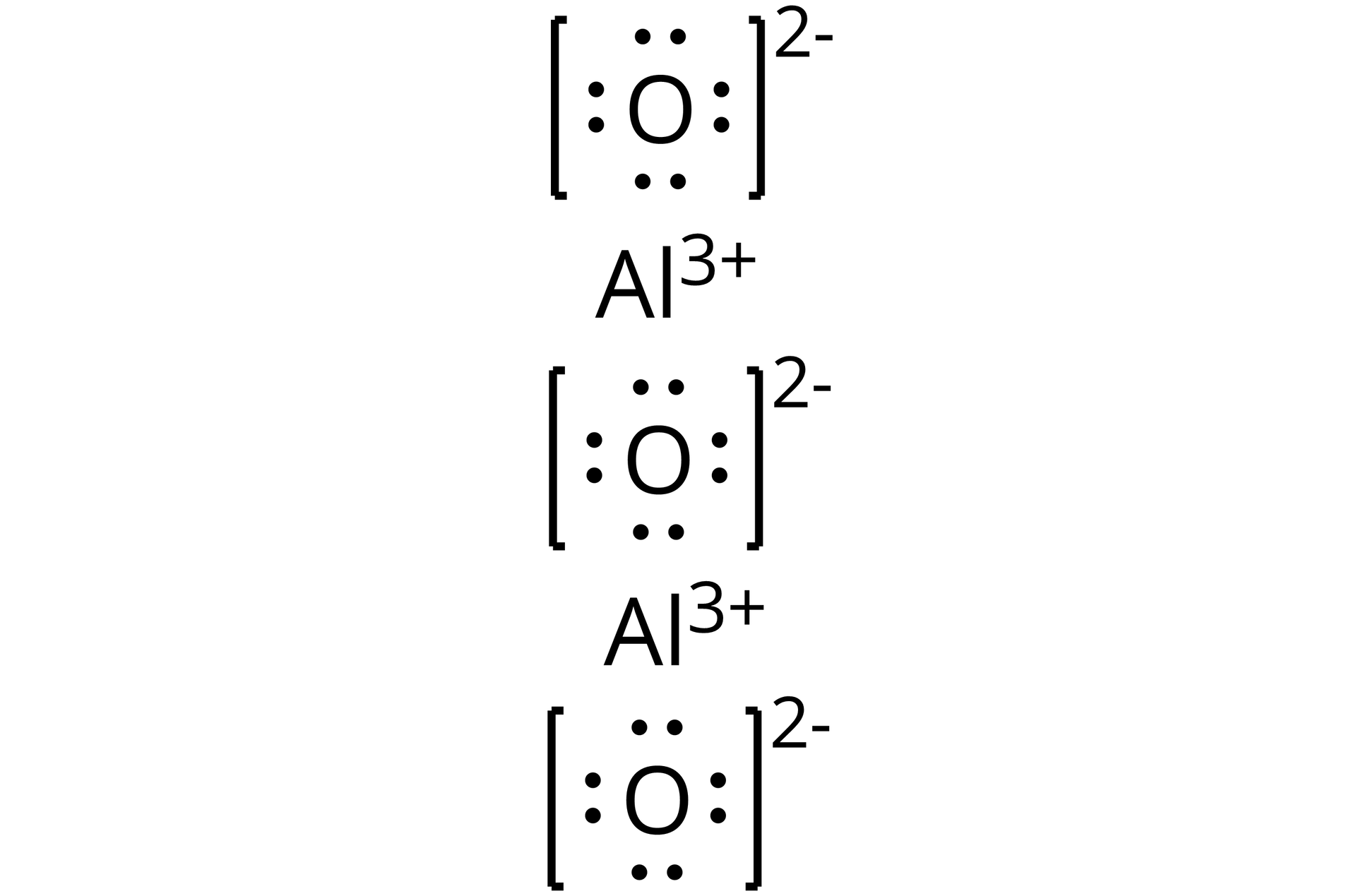 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | jonowy | |
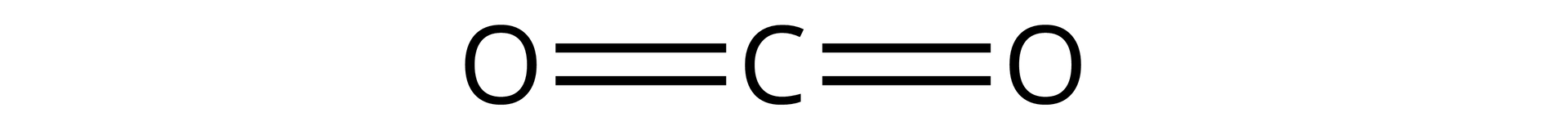 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kowalencyjny | |
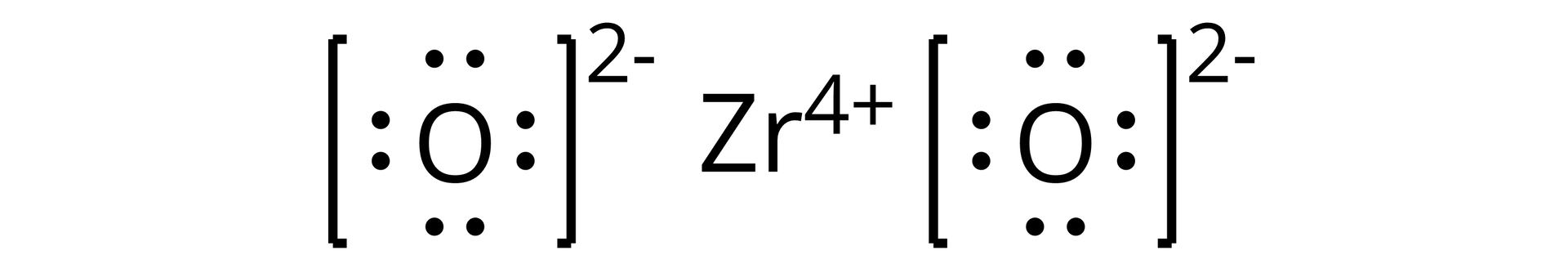 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | jonowy | |
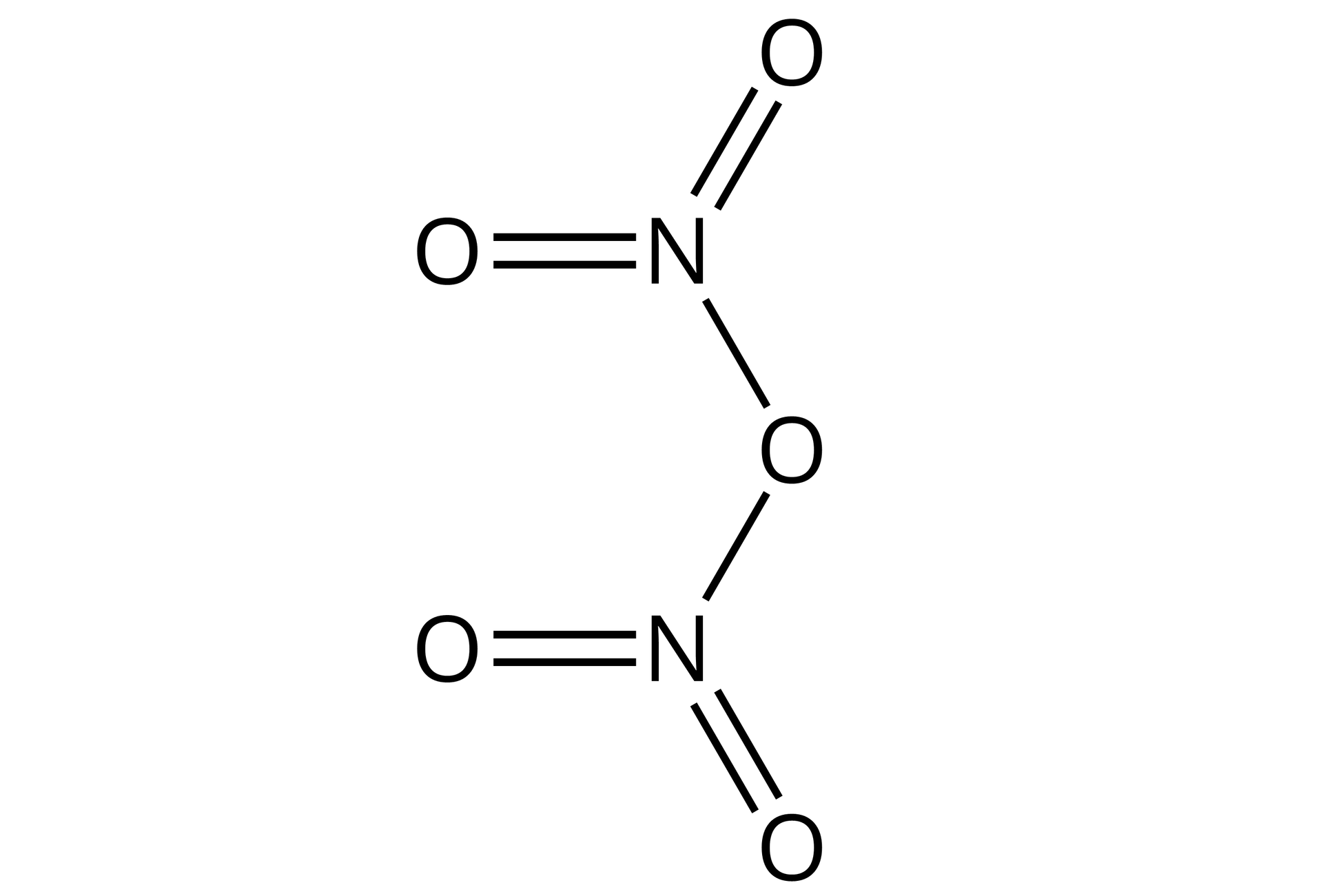 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kowalencyjny | |
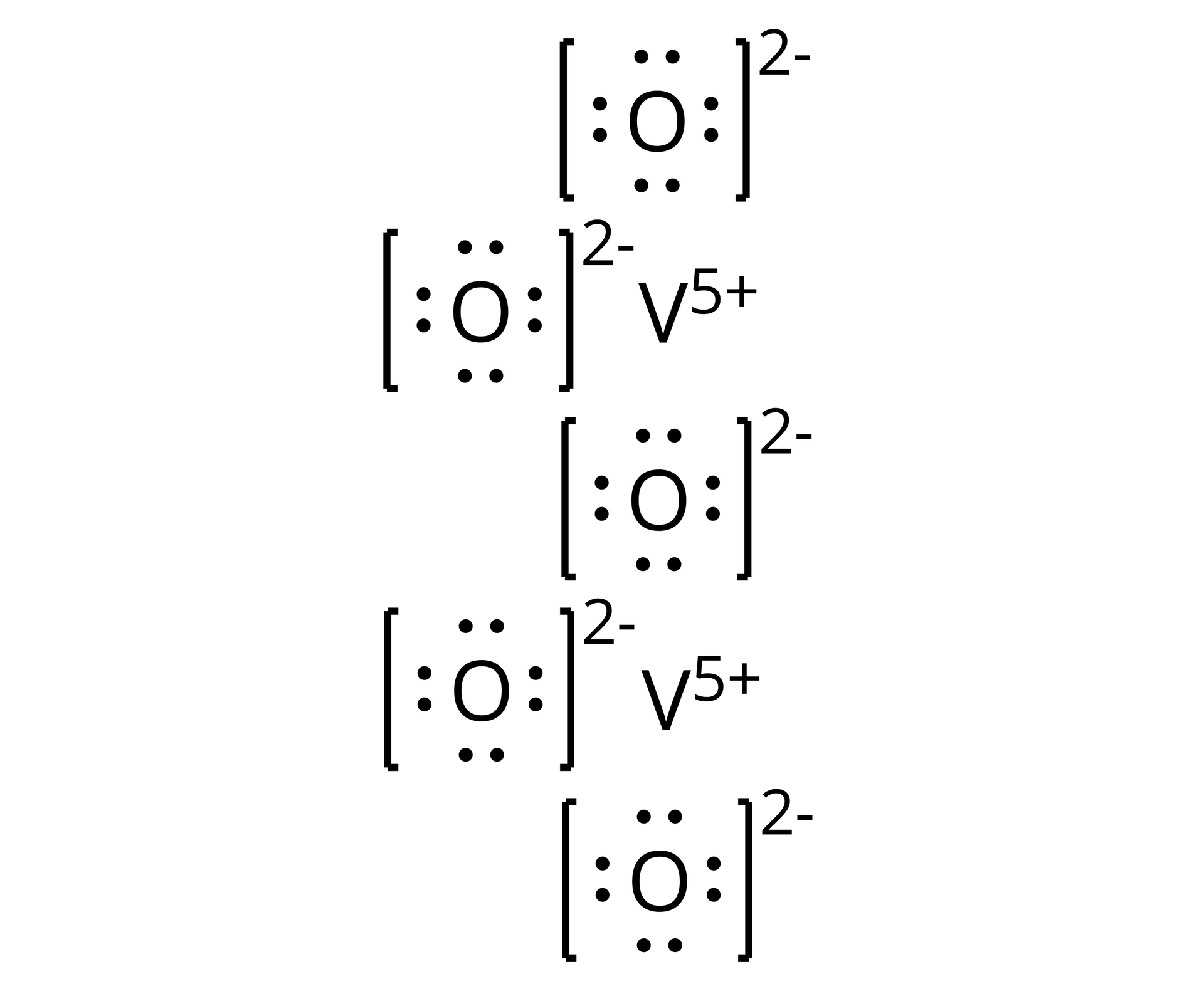 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | jonowy | |
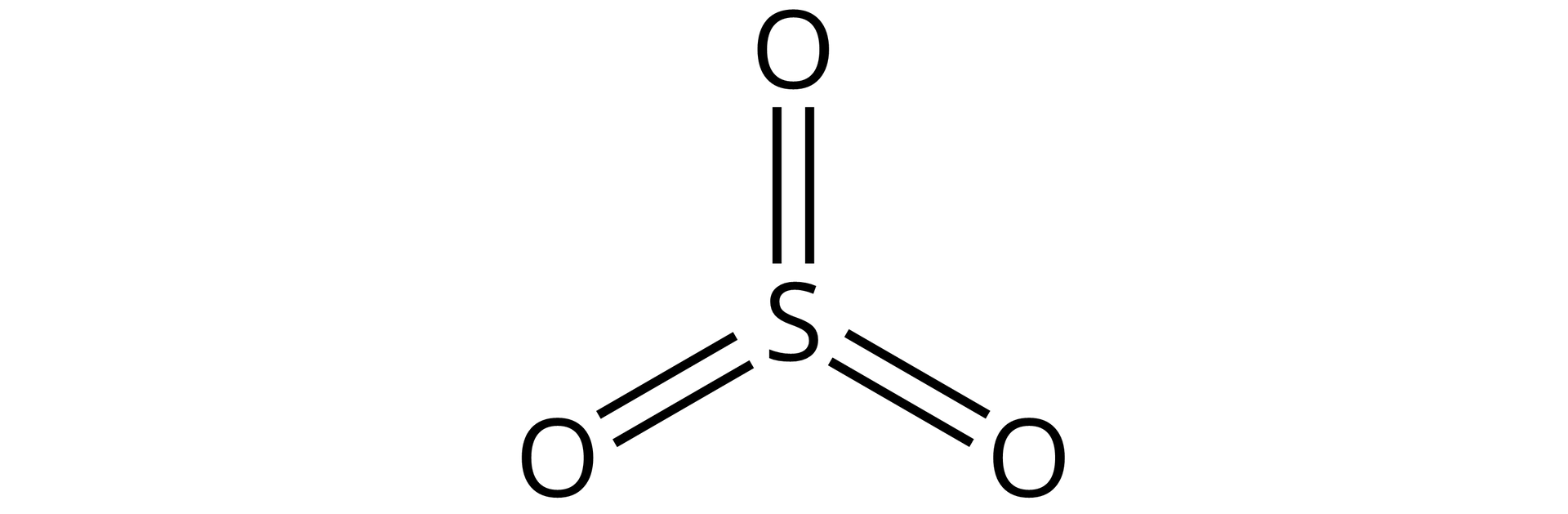 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kowalencyjny | |
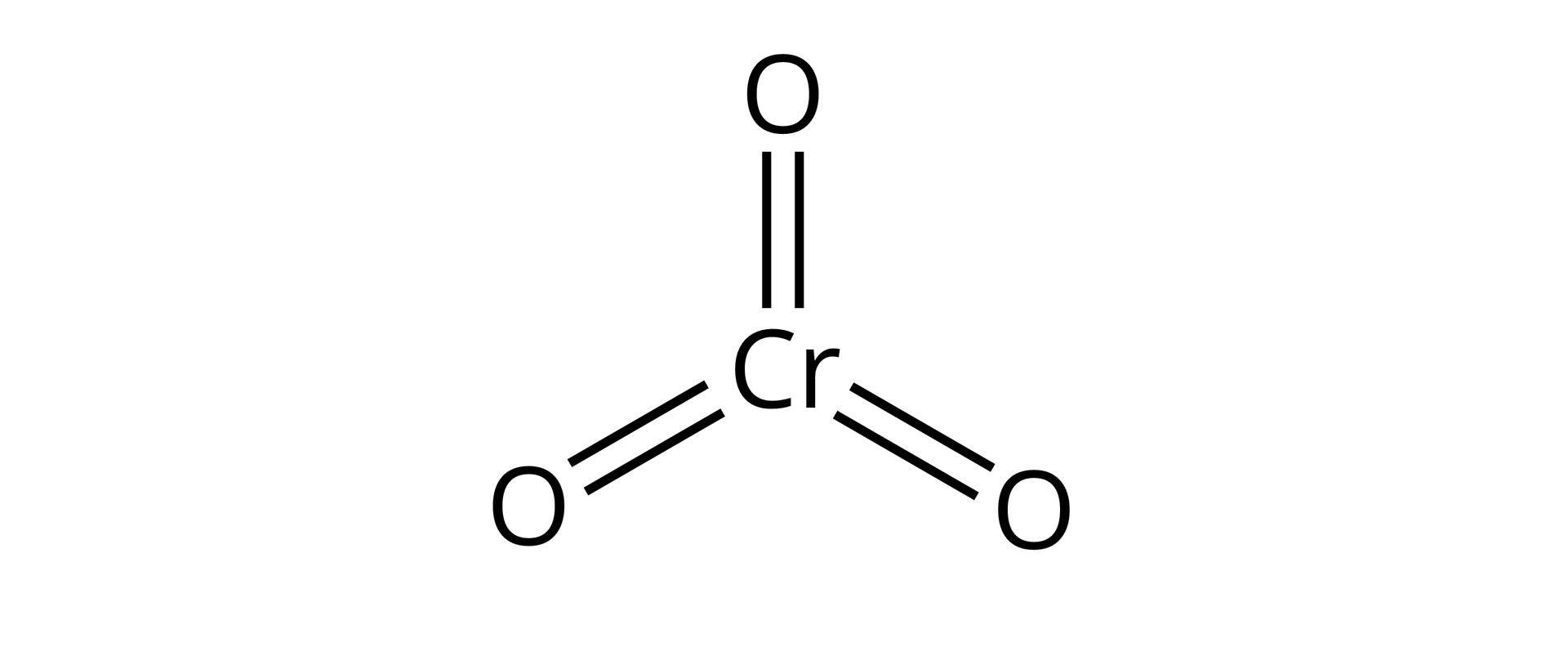 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | jonowy | |
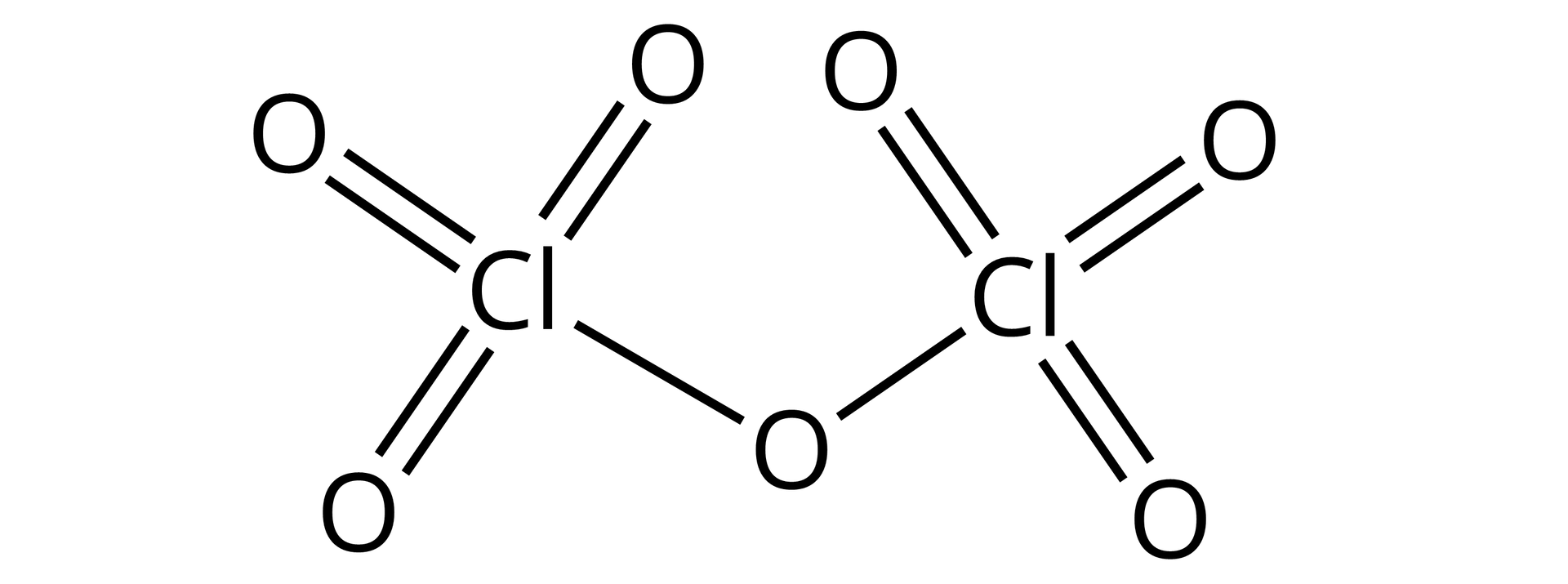 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kowalencyjny | |
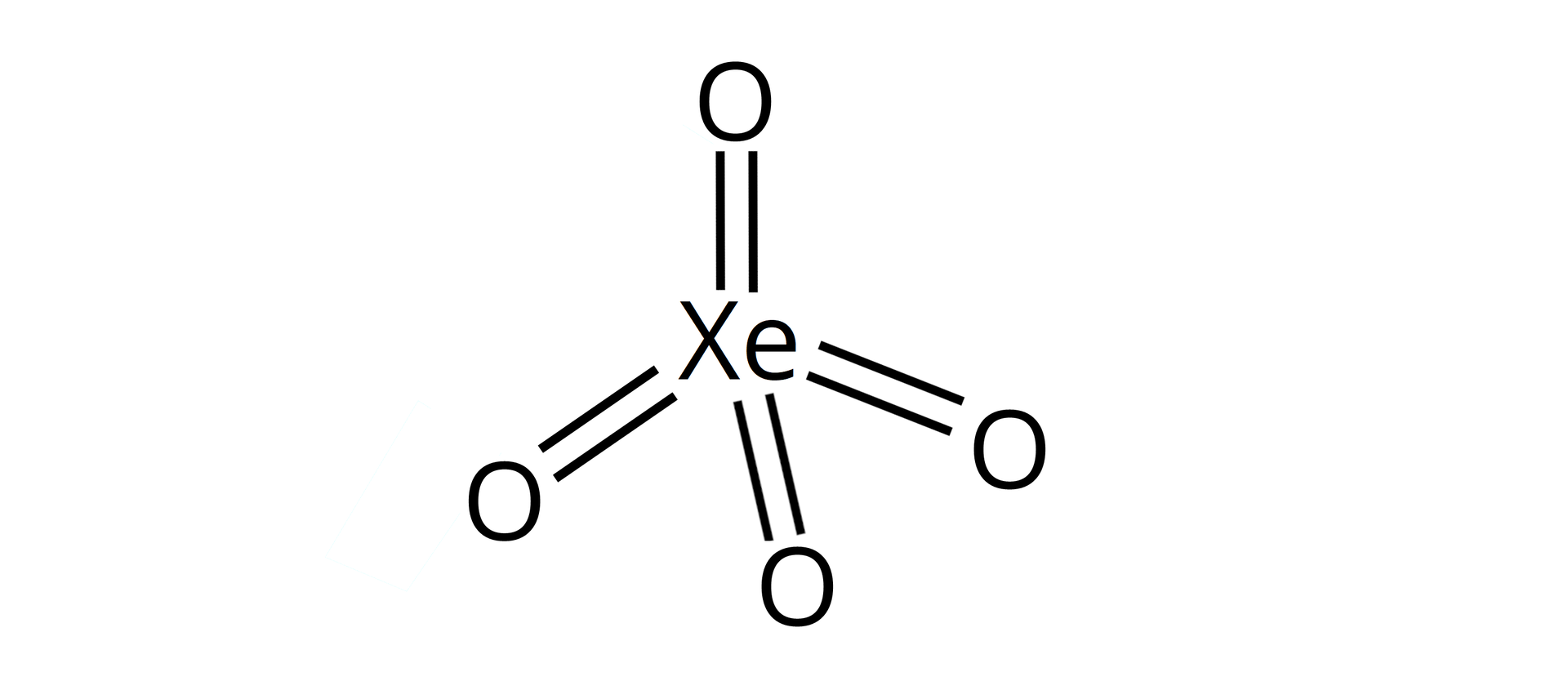 Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0. | kowalencyjny |
Słownik
nieorganiczne związki chemiczne, będące dwupierwiastkowymi związkami tlenu, w których tlen występuje na -II stopniu utlenienia; najczęściej powstają na skutek reakcji pierwiastków z tlenem, tj. utlenianie, spalanie oraz w wyniku rozkładu związków zawierających tlen
liczba dodatnich lub ujemnych ładunków elementarnych, jakie można przypisać atomom pierwiastka danego związku chemicznego, gdyby wszystkie wiązania utworzone przez atom były jonowe
pozwala na określenie poszczególnych połączeń składu jakościowego i ilościowego w danym związku chemicznym
Bibliografia
Lipiec T., Szmal Z. S., Chemia analityczna z elementami analizy instrumentalnej, s. 376–378, Warszawa 1976, wyd. 4.
Minczewski J., Marczenko Z., Chemia analityczna. T.2. Chemiczne metody analizy ilościowej, Warszawa 2011, wyd. 10.
Lamsal C., Electronic, thermoelectric and optical properties of vanadium oxides: VOIndeks dolny 22, VIndeks dolny 22OIndeks dolny 33 and VIndeks dolny 22OIndeks dolny 55, Digital Commons of New Jersey Institute of Technology.