Przeczytaj
Reakcje utleniania i redukcji
Reakcje utleniania‑redukcji (reakcje redoks) to takie, w których dochodzi do zmiany stopnia utlenienia atomu w danym reagencie. W celu wyjaśnienia, czym jest reakcja utleniania‑redukcji, zdefiniujmy najpierw oddzielnie proces utleniania i proces redukcji.
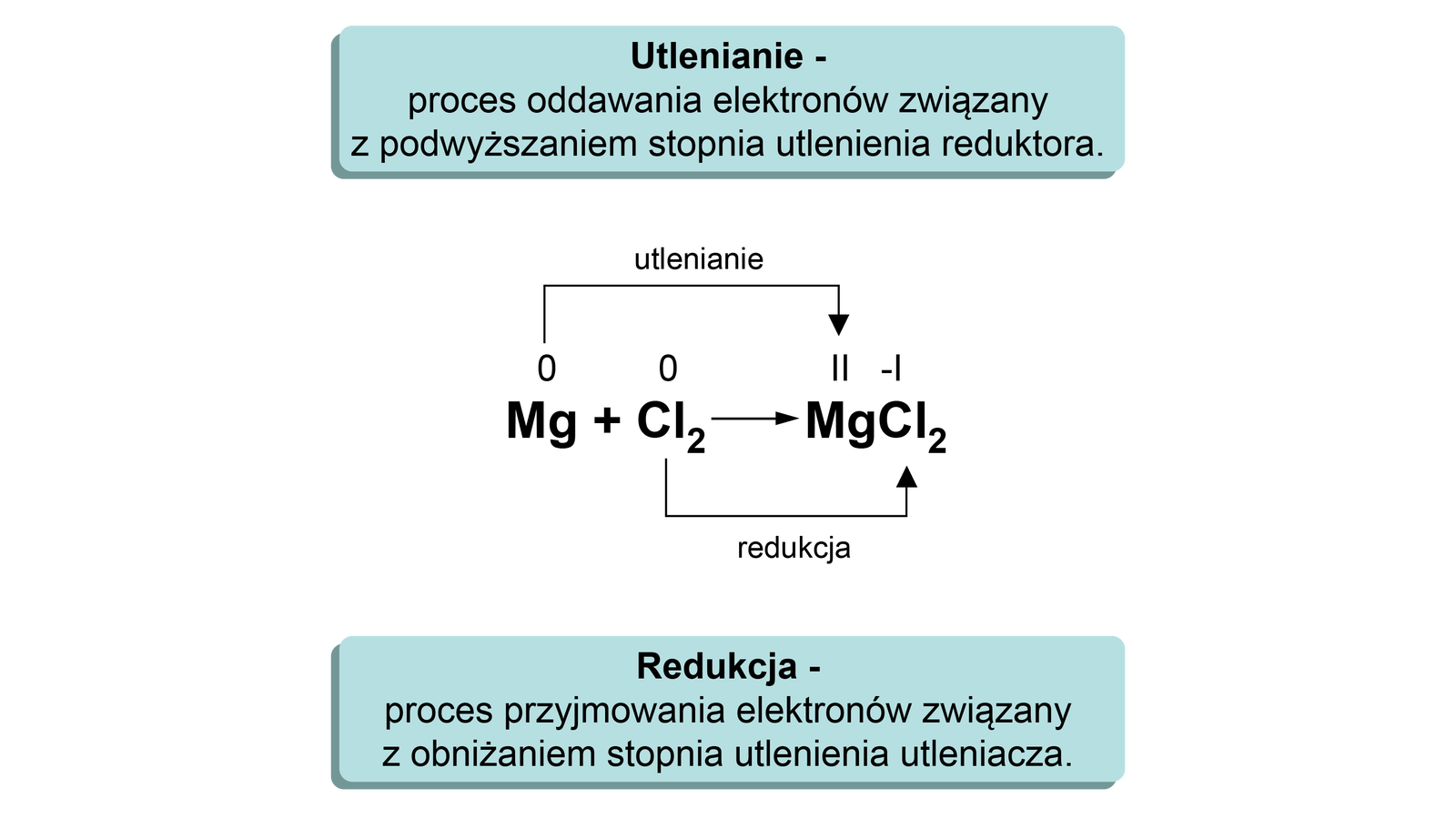
Jak zmieniają się stopnie utlenienia atomów pierwiastków chemicznych w reakcji syntezy chlorku magnezu?
Analizę problemu postawionego w pytaniu warto rozpocząć od określenia stopni utlenienia atomów w poszczególnych reagentach. Równanie można zatem zapisać w postaci:
Z równania wynika, że atom magnezu podwyższył swój stopień utlenienia z do , natomiast atom chloru obniżył swój stopień utlenienia z do -. Zapiszmy teraz schematy procesów utleniania i redukcji:
W każdej reakcji utleniania‑redukcji liczba elektronów oddanych w procesie utleniania musi być równa liczbie elektronów pobranych w procesie redukcji. Jest to tzw. bilans elektronowy reakcji. Bilans ten, równy sumie elektronów pobranych i oddanych, powinien wynosić zero.
Z zapisów tych wynika, że:
1. W procesie utleniania reduktorreduktor () zwiększył swój stopień utlenienia (z na ) i oddał (dwa) elektrony.
2. W procesie redukcji utleniaczutleniacz () obniżył swój stopień utlenienia (z na -) i przyjął (jeden) elektron.
Wymiana elektronów w omawianej reakcji zachodzi pomiędzy reduktorem, który oddaje elektrony, a pobierającym elektrony utleniaczem. Reakcje te nie mogą przebiegać niezależnie, ponieważ elektrony oddane (przez atomy magnezu) w reakcji utlenianiareakcji utleniania są pobrane (przez atomy chloru) w reakcji redukcjireakcji redukcji.
Reakcje dysproporcjonowania i synproporcjonowania
Wśród reakcji redoks można wyróżnić dwa specjalne typy reakcji:
1. Reakcja dysproporcjonowania (dysmutacji) jest szczególnym rodzajem reakcji utleniania‑redukcji, w której atomy tego samego pierwiastka (na tym samym stopniu utlenienia) jednocześnie ulegają procesowi utlenianiautleniania oraz redukcjiredukcji, np.:
atomy są równocześnie utleniaczemutleniaczem i reduktoremreduktorem.
atomy są równocześnie utleniaczem i reduktorem.
Analizując powyższe przykłady, można zauważyć, że reakcje dysproporcjonowania zachodzą, gdy atom pierwiastka może występować na co najmniej trzech różnych stopniach utlenieniastopniach utlenienia oraz gdy związek, w którym atom pierwiastka występuje na pośrednim stopniu utlenienia, jest mniej trwały od związków pierwiastka, w których ten pierwiastek występuje na pozostałych stopniach utlenienia.
2. Reakcja synproporcjonowania jest reakcją utleniania‑redukcji, w której atomy tego samego pierwiastka z dwóch różnych stopni utlenieniastopni utlenienia przechodzą na jeden wspólny, np.:
Charakterystyczne cechy utleniaczy i reduktorów
Utleniacze | Reduktory |
|---|---|
mają właściwości utleniające | mają właściwości redukujące |
mają możliwość obniżenia stopnia utlenienia | mają możliwość podwyższenia stopnia utlenienia |
przykłady: , , , | przykłady: , , , , , |
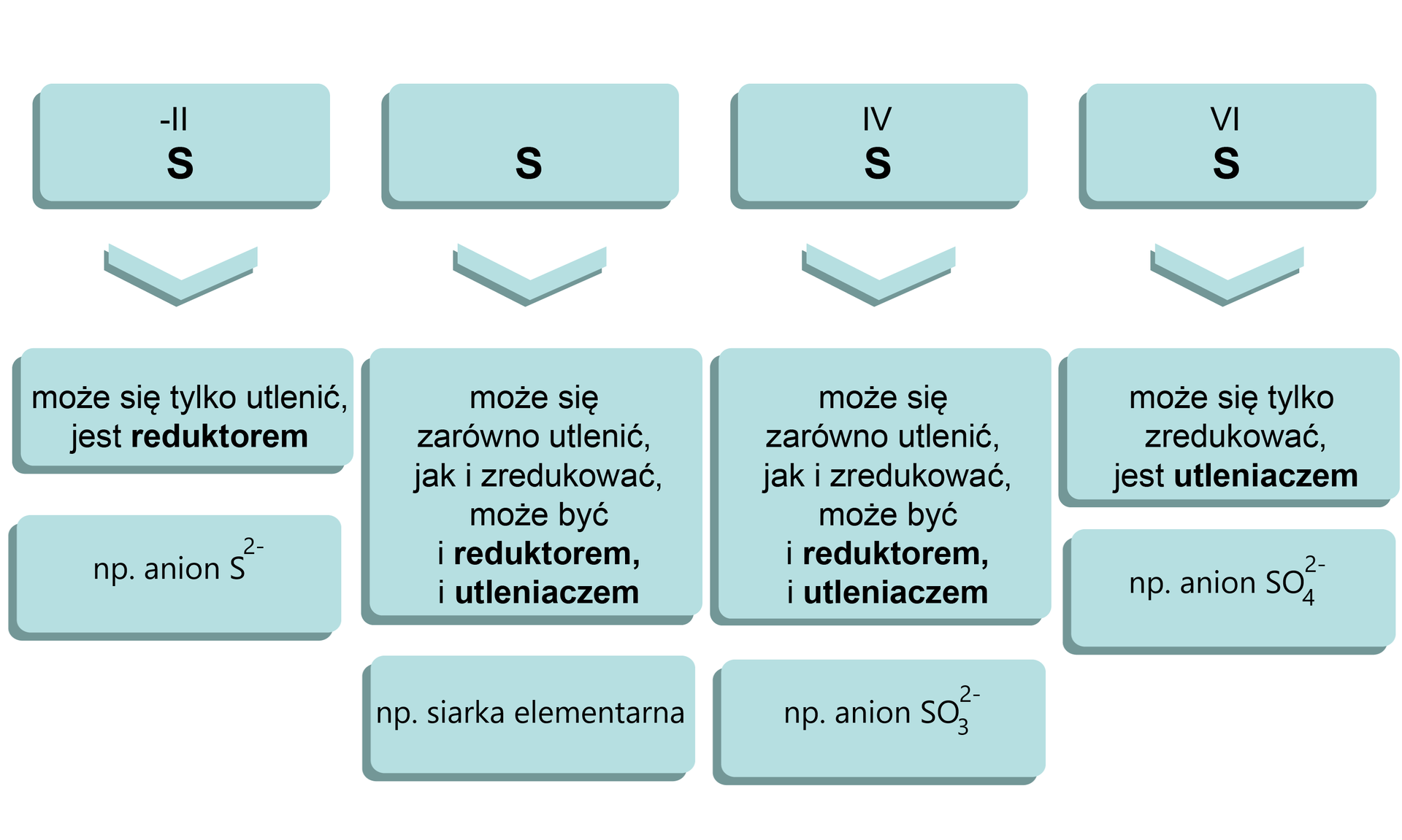
Przeanalizuj znane Ci indywidua chemiczne zawierające siarkę i zastanów się, w których z nich siarka może ulegać utlenieniu, a w których redukcji.
Słownik
ładunek, jaki zgromadziłby się na atomie danego pierwiastka wchodzącego w skład związku chemicznego, przy założeniu, że wszystkie wiązania chemiczne w związku mają charakter wiązań jonowych
atom, jon lub cząsteczka, które w reakcji redoks są donorem elektronu (elektronów)
atom, jon lub cząsteczka, które w reakcji redoks są akceptorem elektronu (elektronów)
proces przyjmowania elektronów, związany z obniżaniem stopnia utlenienia utleniacza
proces oddawania elektronów, związany z podwyższaniem stopnia utlenienia reduktora
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Greenwood N. N., Earnshaw A., Chemistry of the Elements, 2nd edition, Oxford 1997,
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum - poziom podstawowy i rozszerzony, Warszawa - Bielsko‑Biała 2010.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, tłum. A. Dworak, Warszawa 2014.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 2, Warszawa 2016.