Przeczytaj
Addycja fluorowcowodorów do alkinów
AlkinyAlkiny są podatne na reakcje addycjiaddycji, ze względu na występowanie wiązania potrójnego pomiędzy atomami węgla, w którego skład wchodzi jedno mocne wiązanie typu oraz dwa słabe, łatwe do rozerwania wiązania typu . Dzięki temu alkiny są związkami reaktywnymi chemicznie. Jedną z reakcji addycji jest przyłączenie fluorowcowodorów, czyli związków typu , gdzie to najczęściej atom chloru lub bromu. Alkiny reagują więc z chlorowodorem lub bromowodorem, dając odpowiednio nasycone lub nienasycone halogenopochodne węglowodorów. Są to reakcje, które mogą, w zależności od ilości użytego halogenowodoru, prowadzić do otrzymania różnych produktów.
W reakcji addycji mola cząsteczek powstaje halogenopochodna alkenu, natomiast ich nadmiar prowadzi do powstania dihalogenopochodnej alkanu.
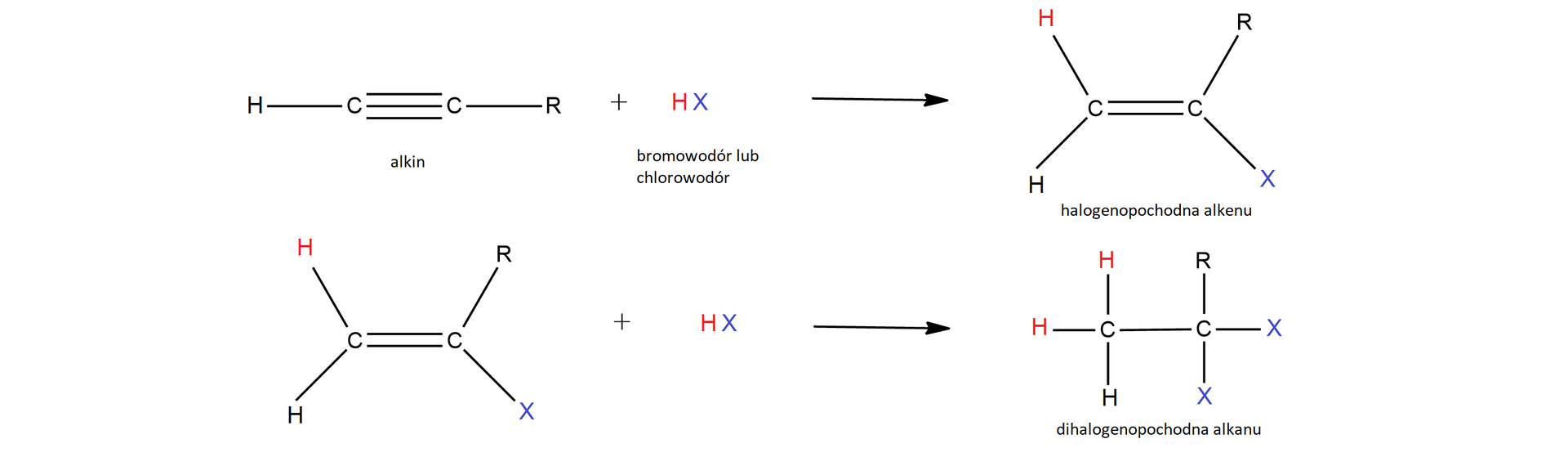
Ogólne równanie reakcji addycji moli cząsteczek do mola cząsteczek alkinu, posiadającego wiązanie potrójne przy terminalnym (skrajnym) atomie węgla, można zapisać w następujący sposób:

Reakcje te zachodzą zgodnie z regułą Markownikowa, dotyczącą addycji czynników do cząsteczek niesymetrycznych węglowodorów nienasyconych, czyli alkenów i alkinów. Reguła ta mówi, że atom , czyli atom fluorowca, przyłączy się do tego atomu węgla związanego wiązaniem wielokrotnym, który połączony jest z mniejszą liczbą atomów wodoru. Natomiast atom wodoru przyłączany jest do tego atomu węgla, który pierwotnie połączony był z większą liczbą atomów wodoru.
Poniżej przedstawiono równanie reakcji addycji cząsteczki bromowodoru do cząsteczki propynu, czyli niesymetrycznego alkinu.
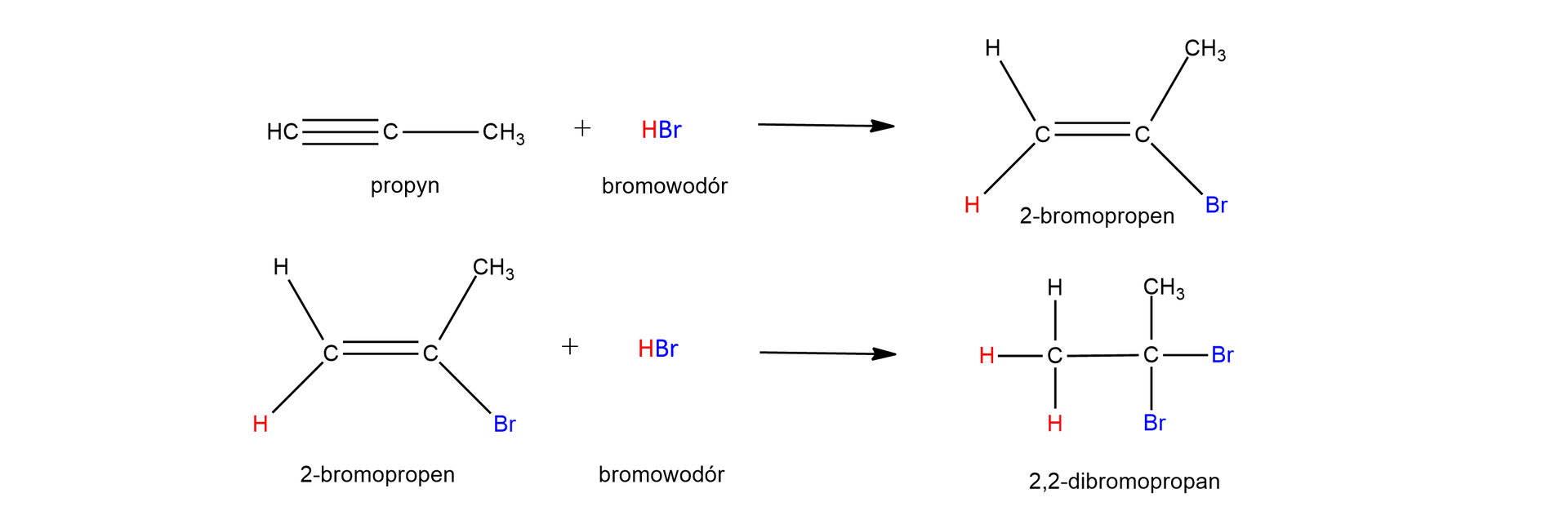
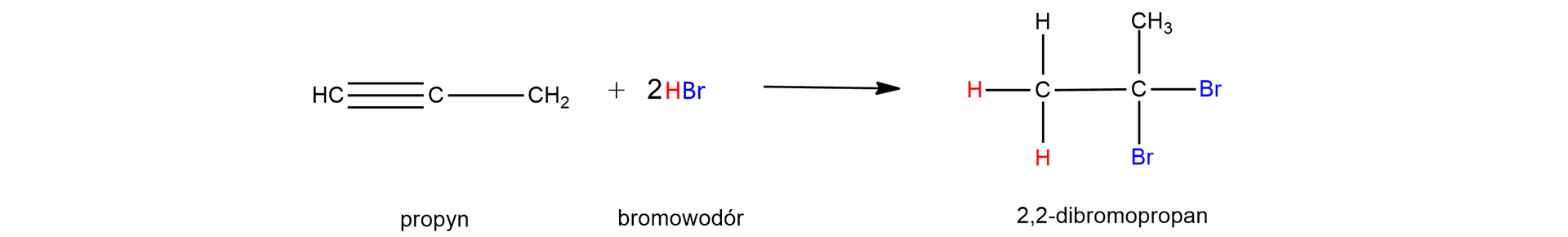
Równanie tej reakcji można zapisać w jednym etapie, uwzględniając stosunek molowy reagentów jako :
Jaki jest mechanizm reakcji addycji fluorowcowodorów do alkinów?
W cząsteczkach fluorowcowodorów występuje wiązanie kowalencyjne spolaryzowane. W związku z tym na atomie wodoru występuje cząstkowy ładunek dodatni, a na atomie fluorowca – cząstkowy ładunek ujemny, tak jak na poniższym przykładzie cząsteczki chlorowodoru.
Para elektronów w cząsteczce alkinu atakuje dodatni biegun cząsteczki chlorowodoru, zrywając wiązanie pomiędzy atomem wodoru i chloru (rozpad heterolityczny wiązaniarozpad heterolityczny wiązania) i odpychając jednocześnie anion chlorkowy. Elektrony, tworzące wiązanie , tworzą teraz dodatkową wolną parę elektronową anionu chlorkowego.
ElektrofilElektrofil, czyli , przyłącza się do do atomu węgla przy wiązaniu potrójnym, który jest połączony z większą ilością atomów wodoru, tworząc karbokation, czyli kation organiczny, w którym atom węgla ma deficyt elektronów i tworzy się na nim ładunek dodatni (). Jest więc to atak elektrofilowy. Karbokation to produkt przejściowy, który w dalszej kolejności jest atakowany przez nukleofilnukleofil, czyli . Następuje więc atak nukleofilowy. Para elektronowa anionu chlorkowego, atakując pośredni karbokation, tworzy nowe wiązanie . Tworzy się zatem chlorowy produkt addycji, posiadający elektrony wiązania podwójnego (). Produkt ten nadal posiada elektrony , w związku z tym przy wystarczającej ilości chlorowodoru może nastąpić drugi etap addycji, analogiczny do pierwszego. Elektrony wiązania atakują dodatni biegun cząsteczki chlorowodoru i następuje przyłączenie odczynnika elektrofilowego – do atomu węgla połączonego z większą ilością atomów wodoru. Tworzy się wówczas karbokation alkilowy (), do którego przyłącza się anion chlorkowy, tworząc chlorek alkilowy, czyli produkt całkowitej addycji chlorowodoru do alkinu (). Addycja chlorowodoru zachodzi więc zgodnie z mechanizmem elektrofilowym, gdyż obecność czynnika elektrofilowego warunkuje przebieg reakcji.
Poniżej przedstawiono ogólny mechanizm addycji elektrofilowej dla terminalnego alkinu, tj. takiego, który wiązanie potrójne posiada przy pierwszym atomie węgla.
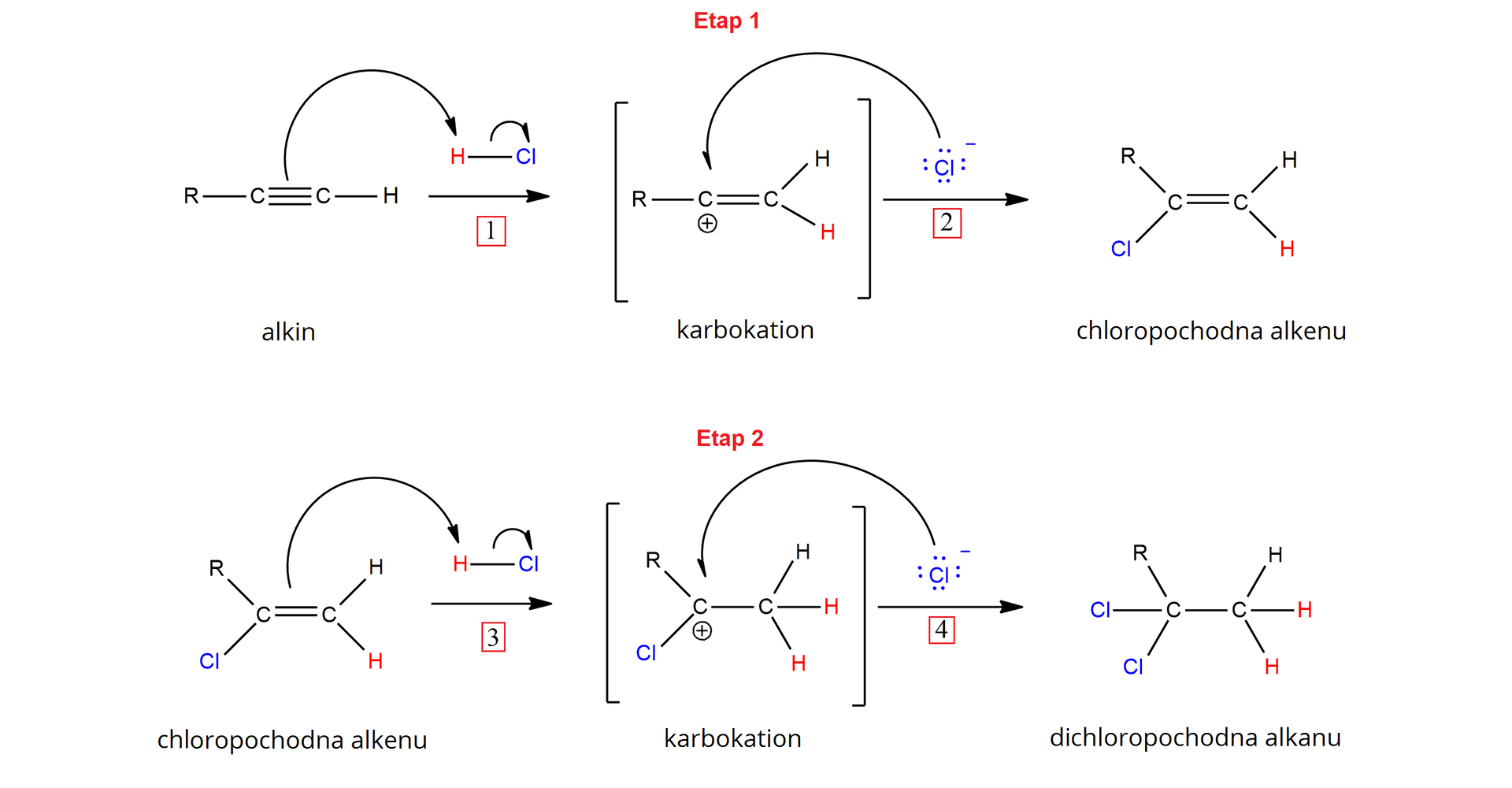
Należy pamiętać, że kierunek reakcji addycji jest determinowany przez szybkość tworzenia produktów przejściowych, czyli karbokationów, oraz ich trwałość.

-rzędowy (), -rzędowy ().
Dlatego innym sposobem wyjaśnienia reguły Markownikowa jest stwierdzenie, że w reakcji addycji głównym produktem przejściowym jest wyżej rzędowy karbokation, ponieważ powstaje szybciej i jest trwalszy.
Słownik
alifatyczne węglowodory nienasycone o wzorze ogólnym , których cząsteczki zawierają jedno wiązanie potrójne między atomami węgla
reakcja addycji, czyli łączenia, w której związek, posiadający niedomiar elektronów (elektrofil), przyłącza się do związku chemicznego, zawierającego nadmiar elektronów bez powstawania produktów ubocznych
indywiduum chemiczne obdarzone ładunkiem dodatnim (w reakcji bromowania jest to , w reakcji nitrowania – , w reakcji chlorowania – , w reakcji metylowania – itd.)
indywiduum chemiczne obdarzone ładunkiem ujemnym (np. , , ) lub cząsteczka obojętna, posiadająca wolne pary elektronowe (np. , , )
rozerwanie wiązania kowalencyjnego w cząsteczce związku, którego efektem jest powstanie dwóch jonów: dodatniego i ujemnego
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.