Przeczytaj
Co określa liczba atomowa?
Popatrz na fragment układu okresowego dotyczącego wodoru. Jakie informacje możesz z niego odczytać?
Zapoznaj się z opisem fragmentu układu okresowego dotyczącego wodoru. Dowiedz się, jakie informacje można z niego odczytać.
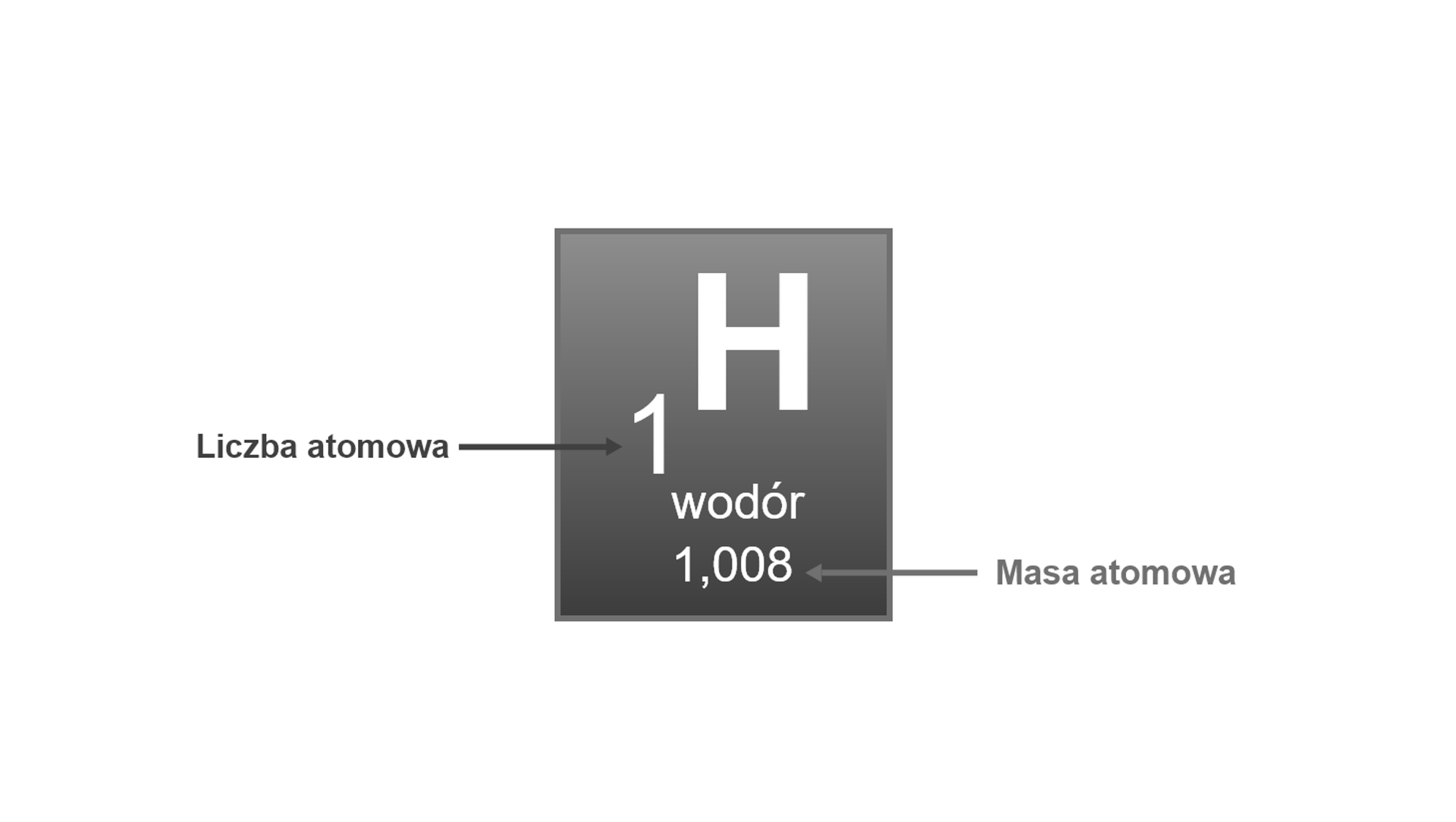
Liczba atomowa danego pierwiastka informuje nas o:
miejscu danego pierwiastka w układzie okresowym;
ilości protonów w jądrze;
ilości elektronów w chmurze elektronowej atomu pierwiastka.
Pamiętaj jednak, że z układu okresowego nie odczytasz, ile neutronów ma dany atom, ponieważ o przynależności atomu do danego pierwiastka decyduje liczba protonów w jądrze atomowym (liczba atomowa). W definicji pierwiastka nie ma określonej liczby neutronów, dlatego też atomy danego pierwiastka mogą różnić się liczbą neutronów w jądrze.
Liczba masowa jest sumą nukleonów, czyli sumą protonów i neutronów w jądrze atomu.
Masa atomowa (względna) wyrażana jest w jednostce zwanej unitem. Unit () równoważny jest masy atomu węgla . Wartość odpowiada .
Czy wszystkie atomy wodoru są tak samo zbudowane?
W przypadku wodoru występują trzy rodzaje atomów; atomów wodoru posiada w jądrze tylko – ich liczba masowa wynosi . Za pomocą symboli zapisujemy ten atom jako , czasami dla atomów tej odmiany wodoru stosuje się nazwę protprot. Natomiast atomów wodoru ma w jądrze i – ich liczba masowa wynosi . Atomy te nazywa się „ciężkim wodorem” lub deuteremdeuterem. Mają one nawet swój symbol chemiczny , ale stosuje się też zapis lub wodór–. Śladowe ilości atomów wodoru mają w jądrze i – ich liczba masowa wynosi . Atomy te nazywa się trytemtrytem, a ich symbol chemiczny to lub stosuje się zapis , wodór–. Na ilustracji poniżej przedstawiono rodzaje atomu wodoru.

Atomy, które mają taką samą liczbę protonów w jądrze, ale różną liczbę neutronów, nazywamy izotopamiizotopami. Nazwa ta pochodzi z greckiego (izo „taki sam”, topos „miejsce”), ponieważ atomy izotopów zajmują to samo miejsce w układzie okresowym.
Izotop | |||
|---|---|---|---|
Nazwa | Prot | Deuter | Tryt |
Symbol |
Jakimi właściwościami różnią się izotopy danego pierwiastka?
Izotopy tego samego pierwiastka mają zbliżone własności fizyczne. Jednak im większa jest różnica mas atomowych izotopów (co ma miejsce np. w przypadku wodoru), tym większe mogą być różnice ich własności fizycznych. Izotopy nie różnią się właściwościami chemicznymi.
Należy pamiętać, że aby badać zmiany stanów skupienia czy gęstości, musi występować pewien zbiór atomów czy też izotopów. Niemożliwe jest badanie właściwości dla pojedynczego nuklidu.
Izotopy danego pierwiastka mogą się różnić:
temperaturą wrzenia;
temperaturą topenienia;
temperaturą sublimacji;
gęstością.
Czy znasz wyżej wymienione pojęcia? Sprawdź się, podając definicję, a następnie, odsłaniając kolejne karty.
| temperatura wrzenia |
|
| temperatura topnienia |
|
| temperatura sublimacji |
|
| gęstość |
|
Izotopy wodoru różnią się liczbą nukleonów. Różnica mas pomiędzy izotopami wodoru jest bardzo duża – atom deuteru ma masę dwukrotnie większą od masy atomu protu, a tryt – aż trzykrotnie. Wpływ zmiany masy atomowej na właściwości tych izotopów zamieszczono w tabeli poniżej.
Izotop | Symbol | Temperatura topnienia | Temperatura wrzenia |
|---|---|---|---|
Prot | |||
Deuter | |||
Tryt |
Źródło: Bielański A, Podstawy Chemii Nieorganicznej, t. 2, Warszawa 2010.
Cząsteczki ciężkiej wody () mają masę cząsteczkową większą o od cząsteczek wody , co powoduje jej większą gęstość. Dzięki tej właściwości można oddzielać wodę ciężką od „zwykłej” poprzez wirowanie.
Parametr | |||
|---|---|---|---|
Temperatura | |||
Temperatura | |||
Gęstość (, ) | |||
[w ] |
Źródło: Martin Chaplin, Water Properties (including isotopologues), dostępny w internecie: www1.lsbu.ac.uk [dostęp 3.08.2019].
Ciężka woda występuje naturalnie w przyrodzie. W normalnej wodzie znajduje się ok. wody ciężkiej. W tych stężeniach jest nieszkodliwa dla organizmów, jednak badania eksperymentalne wykazały, że wysokie stężenia mogą prowadzić do bezpłodności, a nawet śmierci organizmów żywych.
Większość pierwiastków ma kilka izotopów, ale istnieją również takie, które mają tylko jeden stabilny izotop.
- Nazwa kategorii: pierwiastki posiadające[br]jeden stabilny izotop
- Nazwa kategorii: fluor
- Nazwa kategorii: sód
- Nazwa kategorii: glin
- Nazwa kategorii: fosfor
- Nazwa kategorii: skand
- Nazwa kategorii: mangan
- Nazwa kategorii: kobalt
- Nazwa kategorii: arsen
- Nazwa kategorii: itr
- Nazwa kategorii: niob
- Nazwa kategorii: jod
- Nazwa kategorii: cez
- Nazwa kategorii: bizmut
- Nazwa kategorii: rod
- Nazwa kategorii: złoto
- Nazwa kategorii: beryl
- Nazwa kategorii: prazeodym
- Nazwa kategorii: protaktyn
- Nazwa kategorii: terb
- Nazwa kategorii: holm
- Nazwa kategorii: tul Koniec elementów należących do kategorii pierwiastki posiadające[br]jeden stabilny izotop
- Elementy należące do kategorii pierwiastki posiadające[br]jeden stabilny izotop
-
pierwiastki posiadające[br]jeden stabilny izotop
-
fluor
-
sód
-
glin
-
fosfor
-
skand
-
mangan
-
kobalt
-
arsen
-
itr
-
niob
-
jod
-
cez
-
bizmut
-
rod
-
złoto
-
beryl
-
prazeodym
-
protaktyn
-
terb
-
holm
-
tul
-
Słownik
nazwa izotopu wodoru, który posiada jeden proton w jądrze atomowym
nazwa izotopu wodoru; w jądrze atomu ma jeden proton i jeden neutron; został odkryty w r. przez H. C. Urey'a, chemika z Uniwersytetu Columbia – za to odkrycie otrzymał nagrodę Nobla z chemii w r.; występuje naturalnie w ilości ok. atomu na atomów protu (wodoru zwykłego, )
nazwa izotopu wodoru; w jądrze atomu ma jeden proton i dwa neutrony
atomy tego samego pierwiastka chemicznego, mające jednakową liczbę protonów, lecz różne liczby neutronów
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 2012.
Drabik L., Sobol E., Słownik języka polskiego, Warszawa 2007.
Loretta J., Atkins P. W., Laverman L., Chemia ogólna, Warszawa 2020.