Przeczytaj
Nadmanganiany
Manganiany znane również pod nazwą nadmanganiany, to sole kwasu manganowego . Sole te, w warunkach normalnych, występują w postaci ciemnofioletowych kryształów, o charakterystycznym, metalicznym połysku. Jednym z najpopularniejszych manganianów jest manganian potasu, który uważany jest za bardzo silny utleniacz, stosowany w chemii nieorganicznej i organicznej. Jego wodny roztwór przyjmuje intensywną barwę fioletową.
Manganian potasu jest wykorzystywany m.in. do laboratoryjnego otrzymywania tlenu
oraz do otrzymywania gazowego chloru:
Właściwości utleniające
Manganian potasu, jako jeden z najsilniejszych utleniaczy, łatwo się redukuje, a produkt reakcji zależy od pH roztworu:

Napisz w formie jonowej, z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo‑elektronowy), równania procesu redukcji i procesu utleniania zachodzących w każdej z probówek, w czasie doświadczenia zilustrowanego na powyższej grafice. Następnie napisz sumaryczne równania zachodzących reakcji, stosując zapis jonowy skrócony.
Zwróć uwagę, że redukcja manganianu potasu zależy od odczynu roztworu, w którym jest przeprowadzana. Właściwości utleniające rosną wraz z obniżeniem pH.
można wykorzystać do utlenienia szerokiej gamy związków organicznych. Otrzymywane produkty mogą różnić się od siebie w zależności od warunków prowadzonej reakcji.
Manganian potasu, ze względu na silne właściwości utleniające, utlenia glicerynęglicerynę (glicerol) do tlenku węgla. Reakcja jest silnie egzoenergetyczna. W wyniku nagromadzenia energii następuje samozapłon i zaczynają pojawiać się iskry oraz fioletowy płomień.

Słownik
(łac. reduco „zmniejszać”) atom, jon lub cząsteczka, która w reakcji utleniania‑redukcji jest donorem elektronu (elektronów)
atom, jon lub cząsteczka, która w reakcji utleniania‑redukcji jest akceptorem elektronu (elektronów)
pojęcie umowne, określające liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomowi pierwiastka chemicznego wchodzącego w skład określonego związku, gdyby cząsteczki tego związku miały budowę jonową
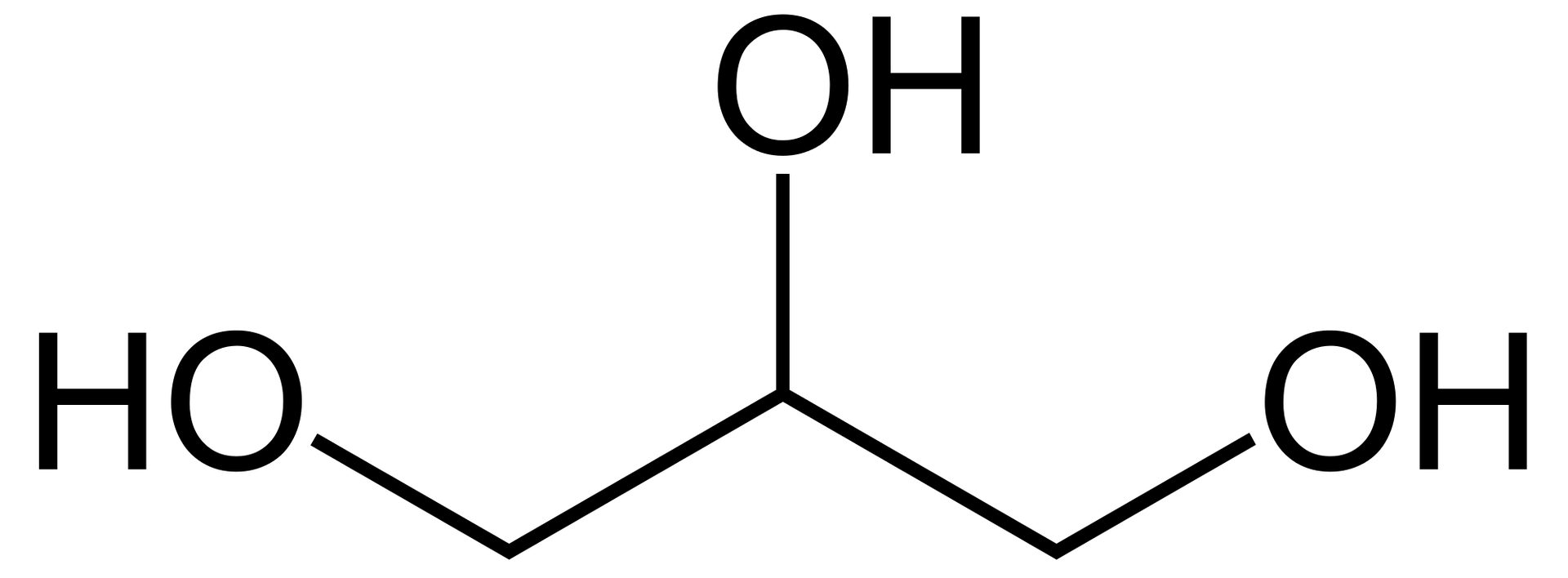
(gr. glykerós „słodki”) glicerol, propano-,,-triol, związek organiczny, najprostszy alkohol trihydroksylowy
Bibliografia
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia : Liceum – poziom podstawowy i rozszerzony, Wydawnictwo Szkolne PWN, Warszawa – Bielsko‑Biała 2010.