Przeczytaj
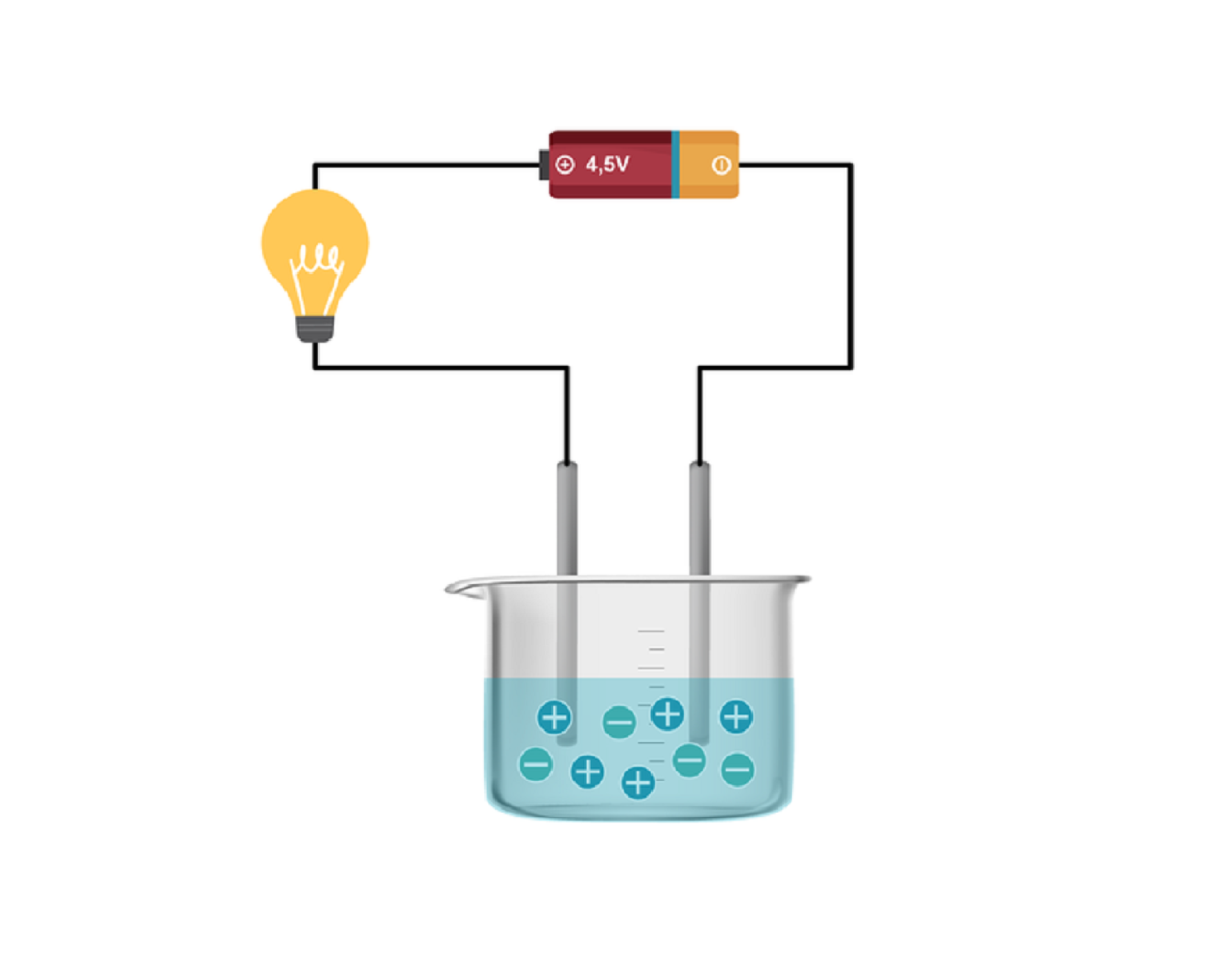
ElektrolityElektrolity zaliczane są do tzw. przewodników jonowych, z uwagi na obecność swobodnych jonów, które są nośnikami prądu elektrycznego (przewodzą prąd elektryczny). Jony pochodzą z procesu dysocjacji elektrolitycznej lub stopienia elektrolitu.
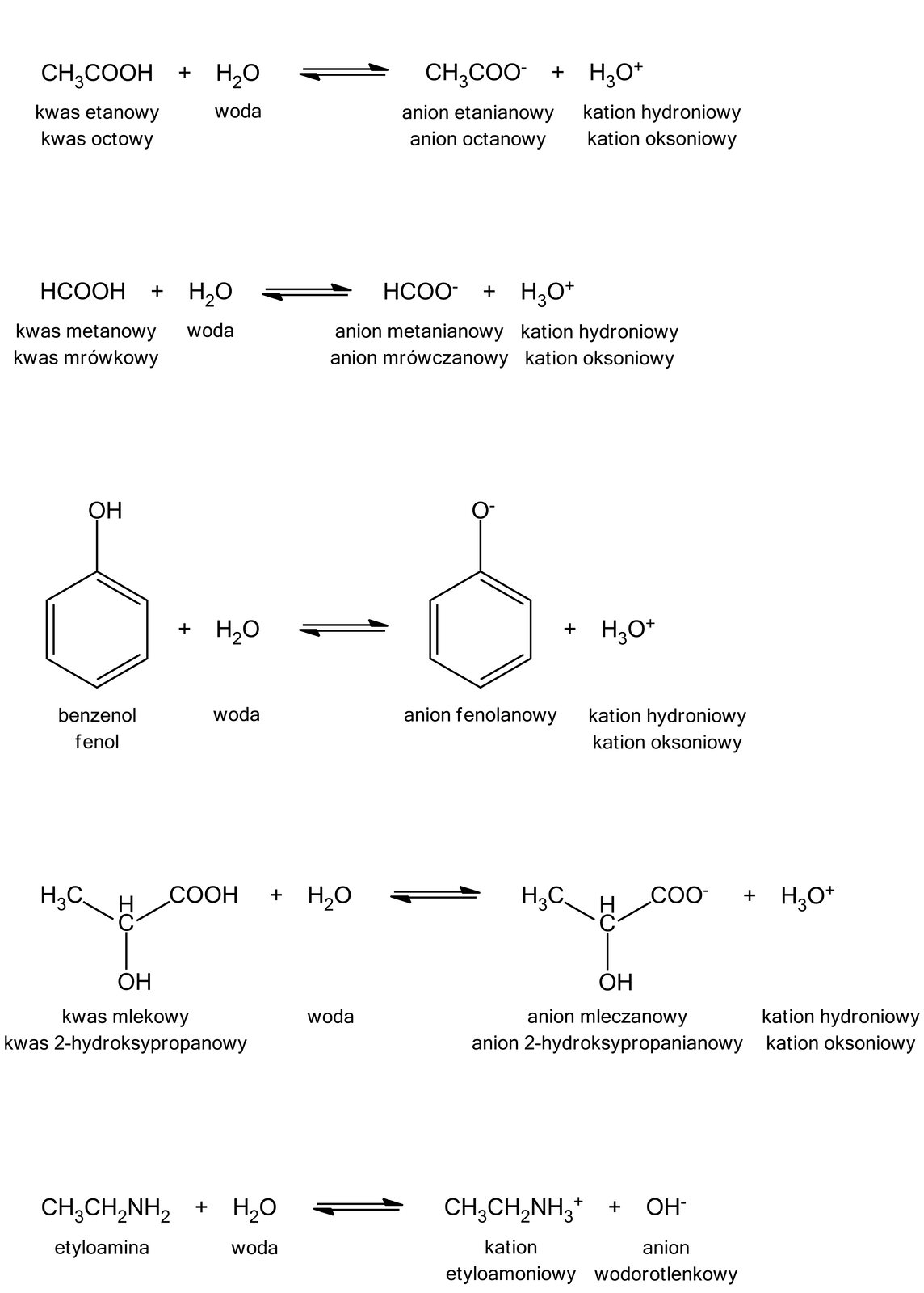
Dysocjacja elektrolitycznaDysocjacja elektrolityczna to rozpad na jony pod wpływem działania rozpuszczalnika. Związki o budowie jonowej, takie jak sole i wodorotlenki, po rozpuszczeniu w wodzie dysocjują na jony. Dysocjacji ulegają również niektóre związki o budowie kowalencyjnej - wśród nich kwasy.
Czy związki organiczne ulegają dysocjacji elektrolitycznej?
Wykonaj doświadczenie w laboratorium chemicznym, w którym sprawdzisz, czy związki organiczne ulegają dysocjacji elektrolitycznej. Rozwiąż problem badawczy i zweryfikuj hipotezę. W formularzu zapisz swoje obserwacje i wyniki w postaci równań reakcji, a następnie sformułuj wnioski.
Pamiętaj o pracy w okularach ochronnych.
Na podstawie przedstawionej mapy myśli dokonaj podziału związków na te, które ulegają i nie ulegają dysocjacji elektrolitycznej w roztworach wodnych.
- Nazwa kategorii: Dysocjacja elektrolityczna [br]związków organicznych
- Nazwa kategorii: Związki organiczne [br]ulegające dysocjacji [br]elektrolitycznej
- Nazwa kategorii: Fenole
- Nazwa kategorii: Niższe [br]kwasy [br]karboksylowe
- Nazwa kategorii: Hydroksykwasy
- Nazwa kategorii: Aminy
- Nazwa kategorii: Aminokwasy
- Nazwa kategorii: Sole organiczne Koniec elementów należących do kategorii Związki organiczne [br]ulegające dysocjacji [br]elektrolitycznej
- Nazwa kategorii: Związki organiczne [br]nie ulegające [br]dysocjacji [br]elektrolitycznej
- Nazwa kategorii: Alkany
- Nazwa kategorii: Alkeny
- Nazwa kategorii: Alkiny
- Nazwa kategorii: Areny
- Nazwa kategorii: Alkohole [br]monohydroksylowe
- Nazwa kategorii: Alkohole [br]polihydroksylowe
- Nazwa kategorii: Aldehydy
- Nazwa kategorii: Ketony
- Nazwa kategorii: Estry
- Nazwa kategorii: Amidy
- Nazwa kategorii: Wyższe [br]kwasy [br]karboksylowe [br](kwasy [br]tłuszczowe) Koniec elementów należących do kategorii Związki organiczne [br]nie ulegające [br]dysocjacji [br]elektrolitycznej
- Elementy należące do kategorii Dysocjacja elektrolityczna [br]związków organicznych
- Elementy należące do kategorii Związki organiczne [br]ulegające dysocjacji [br]elektrolitycznej
- Elementy należące do kategorii Związki organiczne [br]nie ulegające [br]dysocjacji [br]elektrolitycznej
Podsumuj zdobyte wiadomości i odpowiedz na pytanie zawarte w temacie lekcji.
Czy dysocjacji elektrolitycznej ulegają tylko związki nieorganiczne?
Słownik
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) związek chemiczny, który ulega procesowi rozpadu na jony pod wpływem wody i jest zdolny do przewodzenia prądu elektrycznego; gdy jest całkowicie zdysocjowany, mówimy o elektrolicie mocnym
(łac. dissociātiō „rozdzielenie”) proces rozpadu cząsteczek elektrolitów pod wpływem cząsteczek wody na dodatnie i ujemne jony
związek organiczny, którego cząsteczka zawiera grupę funkcyjną karboksylową () oraz długi łańcuch węglowodorowy; jest naturalnym składnikiem tłuszczy
przewodzenie prądu elektrycznego przez elektrolity, uwarunkowane obecnością jonów, które są nośnikami prądu
Bibliografia
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.