Przeczytaj
Jakie są charakterystyczne cechy tlenu?
Tlen jest pierwiastkiem położonym w drugim okresie i grupie układu okresowego pierwiastków. Elektroujemność tlenu w skali Paulinga wynosi .
Przedstaw pełną powłokową konfigurację elektronową, pełną podpowłokową konfigurację elektronową oraz konfigurację podpowłokową w zapisie skróconym (zaw. rdzeń gazu szlachetnego) dla atomu tlenu w stanie podstawowym.
Następnie zapisz pełną powłokową konfigurację elektronową oraz pełną podpowłokową konfigurację elektronową dla anionu tlenkowego .
Tlen jest atomem o dużej elektroujemności – przewyższa jego wartość jedynie elektroujemność fluoru, dlatego będzie on dążył do przechwycenia dwóch elektronów i utworzenia jonu , który ma trwałą i stabilną konfigurację atomu helowca – neonu.
Tlen tworzy tlenkitlenki z większością pierwiastków oraz wchodzi w reakcje z wieloma związkami. Przyjmuje w nich najczęściej stopień utlenienia . Natomiast w związkach z fluorem – fluorkach – tlen występuje na stopniu utlenienia we fluorku tlenu() i we fluorku tlenu() .
Z większością pierwiastków reaguje bezpośrednio. Gwałtowny proces utlenieniautlenienia – spalaniespalanie – rozpoczyna się najczęściej po ogrzaniu reagentów do temperatury zwanej temperaturą zapłonu, a sam proces jest egzoenergetyczny.
Tlen jest reaktywny chemicznie. Z litowcami, niektórymi berylowcami i fosforem białym reaguje w temperaturze pokojowej. W przypadku litowców, tylko lit reaguje z tlenem z wytworzeniem tlenku. W reakcji tlenu z sodem powstają nadtlenki, a dalsze litowce tworzą ponadtlenki. Dla przykładu:
z sodem:
z wapniem:
z fosforem:
z siarką:
z wodorem:
Po ogrzaniu, tlen reaguje niemal ze wszystkimi pierwiastkami. Wyjątek stanowią platyna i fluor. Reaguje również z wieloma związkami nieorganicznymi, jak i organicznymi.
z tlenkiem siarki():
Metale tworzą z tlenem zazwyczaj związki jonowe, które są ciałami stałymi. Niemetale tworzą z tlenem związki kowalencyjne, występujące we wszystkich trzech stanach skupienia.
Ozon
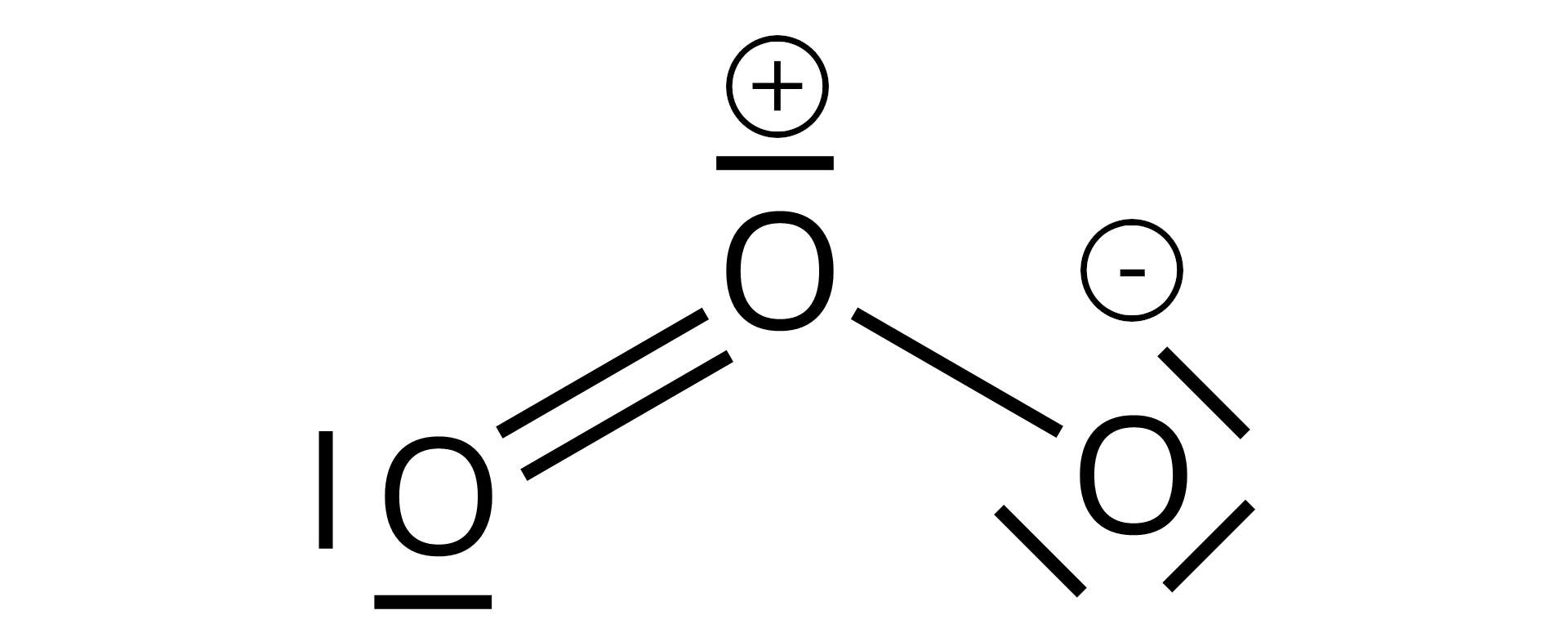
Ozon , w porównaniu z tlenem dwuatomowym, wykazuje zwiększoną aktywność chemiczną. Powstaje z tlenu dwuatomowego pod wpływem odpowiedniej dawki energii (na przykład z tlenu z powietrza podczas wyładowań atmosferycznych):
Ozon jest silnym utleniaczem. Utlenia np. srebro, które pokrywa się czarnym nalotem tlenku, oraz wydziela jod z roztworu jodku potasu ().
Model cząsteczki i struktury rezonansowe ozonu (tritlenu).

Tetratlen
Kolejną odmianą alotropową tlenu jest odkryty w roku tetratlen. Jego cząsteczki są bardzo nietrwałe i rozpadają się, tworząc dwie cząsteczki dwuatomowego tlenu . Dowód na istnienie tetratlenu zdobyto dopiero poprzez zastosowanie wysokiego ciśnienia rzędu (na ) – wówczas ditlen ma tendencję do występowania w postaci czteroatomowych cząsteczek.
Tetratlen posiada silniejsze właściwości utleniające niż ditlen czy ozon. Z tego względu jest badany pod kątem zastosowania jako utleniacz w paliwach rakietowych.

Nadal nie ma pewności, jak wyglądają cząsteczki tetratlenu. Obliczenia teoretyczne sugerują, że mogą występować w kształcie rombu z atomem w każdym jego rogu lub jako trójkąt atomów z czwartym atomem w centrum. Inne przypuszczenia sugerują z kolei, że składa się z dwóch molekuł w kształcie hantli, luźno połączonych siłami dyspersji dipolowej.
Słownik
związki tlenu z innymi pierwiastkami, w których atom tlenu występuje na stopniu utlenienia
związki chemiczne, zawierające w cząsteczkach grupę nadtlenkową , w której tlen występuje na stopniu utlenienia
substancja, która może zainicjować reakcję, zmienić jej szybkość lub poprowadzić w określonym kierunku; uczestniczy w reakcji, ale się w niej nie zużywa
proces fizykochemiczny, którego podstawą jest przebiegająca z dużą szybkością reakcja utleniania, polegająca na gwałtownym łączeniu się substancji spalanej (paliwa) z utleniaczem; towarzyszy jej wydzielanie się dużej ilości energii oraz zazwyczaj płomień
proces oddawania elektronów, związany z podwyższaniem stopnia utlenienia reduktora
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002, s. 210–240.
Piosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Gdańsk 2004, s. 56–57, 88–89.