Przeczytaj
Rzędowość reakcji
Kinetyka chemiczna to dziedzina analizująca szybkość reakcji w odniesieniu do różnych warunków: ciśnienia, temperatury oraz stężenia i natury reagentów. Dzięki niej można zbadać również złożoność oraz mechanizm reakcjimechanizm reakcji. Najważniejszymi pojęciami w tym dziale są:
szybkość reakcji;
cząsteczkowość reakcji;
stała szybkościstała szybkości reakcji;
rząd reakcji.
Aby zrozumieć pojęcie rzędu reakcji, najpierw trzeba pojąć znaczenia i rodzaje poszczególnych procesów chemicznych, które mogą być proste lub złożone. Reakcja prosta to taka, która przebiega w jednym etapie od substratów do produktów. Jeśli w trakcie nie dojdzie do powstania żadnych produktów pośrednichproduktów pośrednich – mamy wówczas do czynienia z reakcją elementarną. Jej przykładem jest synteza jodowodoru.
Reakcje złożone dzielą się na reakcje następcze i równoległe. Jednak większość z nich zawiera zarówno elementy następcze, jak i równoległe. Reakcje następcze to takie, w których kolejne etapy zachodzą po kolei. Przykładem takiego procesu następczego są naturalne szeregi promieniotwórcze.
Poniżej znajduje się przykład szeregu promieniotwórczego, rozpoczynającego się od uranu:
Reakcje równoległe polegają na jednoczesnym przebiegu kilku procesów, począwszy od tego samego substratu. Przykładem tych jest nitrowanie fenolu.

Przebieg reakcji złożonych, jak sama nazwa wskazuje, jest dość skomplikowany, dlatego też ich mechanizm wyznacza się doświadczalnie. To pozwala na zapisanie równania danej reakcji. Dzięki temu możemy określić cząsteczkowość i rzędowość reakcji. Cząsteczkowość jest inaczej liczbą cząsteczek substratu (atomów, cząsteczek, jonów lub rodników), które biorą udział w danej reakcji elementarnej. Przykładem dwucząsteczkowej reakcji elementarnej jednoetapowej prostej jest synteza jodowodoru.
A jaka jest rzędowość dla tej reakcji?
Definicja mówi, że rząd reakcji chemicznej jest sumą wykładników potęgowych, do których podniesione są stężenia reagentów w równaniu kinetycznymrównaniu kinetycznym (na szybkość reakcji chemicznej). Zapisując równanie kinetyczne dla tej reakcji otrzymujemy zależność:
gdzie:
– szybkość reakcji;
– stała szybkości reakcji;
, , – stężenia substratów biorących udział w reakcji.
Wykładniki potęgowe w równaniu kinetycznym są wyznaczane doświadczalnie i mimo że czasem pokrywają się z wartościami współczynników stechiometrycznych w równaniu reakcji, to w istocie, na podstawie równania reakcji, możemy zapisać równanie kinetyczne jedynie dla reakcji prostej i jednoetapowej - wówczas wykładniki potęgowe w równaniu kinetycznym są równe współczynnikom stechiometrycznym w równaniu reakcji. Reakcja otrzymywania jodowodoru jest reakcją jednoetapową i prostą zatem wykładniki potęgowe w równaniu kinetycznym są równe współczynnikom stechiometrycznym w równaniu reakcji. Nie ma potrzeby zapisywania wykładników potęgowych równych .
Zapis wskazuje, że cząstkowy rząd reakcji względem wynosi , względem również wynosi , a całkowity rząd reakcji, będący sumą tych cząstkowych rzędów, wynosi .
Dla reakcji opisanej równaniem:
Całkowity rząd reakcji wynosi . Rzędem reakcji względem reagenta nazywamy wykładnik potęgowy, do którego podniesione jest jego stężenie w równaniu kinetycznym. W przedstawionym wyżej przypadku widać, że reakcja jest drugiego rzędu – zarówno ze względu na substrat , jak i . Cząstkowy rząd reakcji pozwala na określenie wpływu stężenia poszczególnych reagentów na szybkość reakcji.
Równania kinetyczne dla reakcji złożonych, składających się z kilku etapów, ustala się doświadczalnie i często nie odzwierciedlają one równania stechiometrycznego. Wtedy rzędowość reakcji nie musi być wartością całkowitą, tak jak w przypadku reakcji prostych. Rząd reakcji jest wartością ustalaną doświadczalnie. W zależności od warunków reakcji, może przyjmować wartości liczb całkowitych lub ułamkowych, a może być nawet zerowa. Nie dla wszystkich reakcji można ułożyć równanie kinetyczne – w takim wypadku określenie rzędu jest niemożliwe.
Wyróżnia się reakcje:
zerowego rzędu;
rzędu;
rzędu;
reakcje wyższych rzędów (bardzo rzadkie).
Reakcje zerowego rzędu
Reakcjami zerowego rzędu są reakcje, których szybkość nie jest uzależniona od stężenia substratów. Są to np. reakcje fotochemiczne, których szybkość zależy od natężenia padającego promieniowania. Dla takich reakcji równanie kinetyczne wygląda następująco:
gdzie:
– stężenie molowe substratu pozostałe po czasie ;
– początkowe stężenie molowe substratu;
– stała szybkości reakcji;
– czas przebiegu reakcji.
Z powyższego równania reakcji wynika, że reakcja zerowego rzędu ma liniowy ubytek stężenia substratu (lub liniowy przyrost stężenia produktu) w czasie reakcji. Wykres tej zależności przedstawiony jest poniżej.
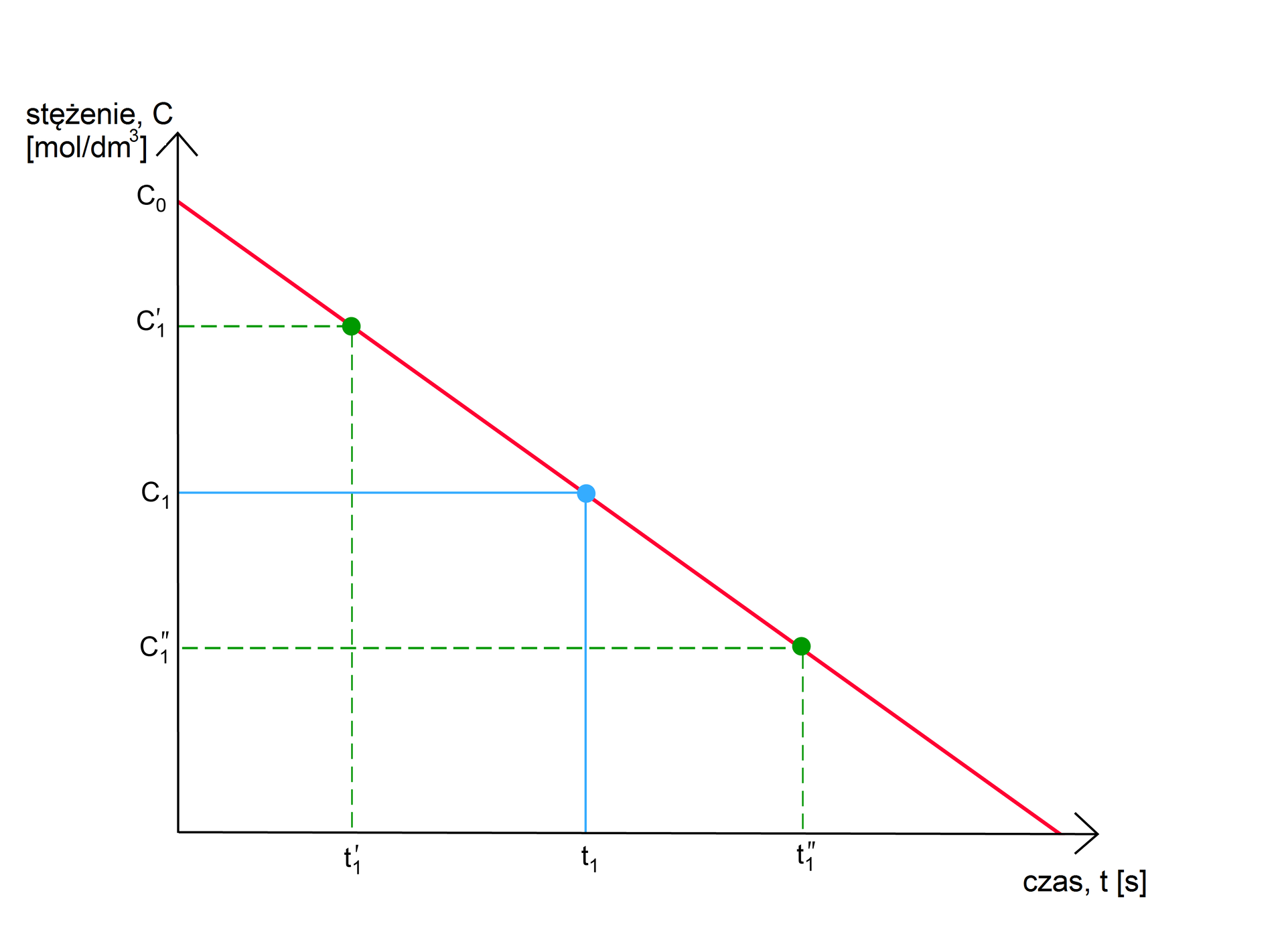
Reakcje rzędu
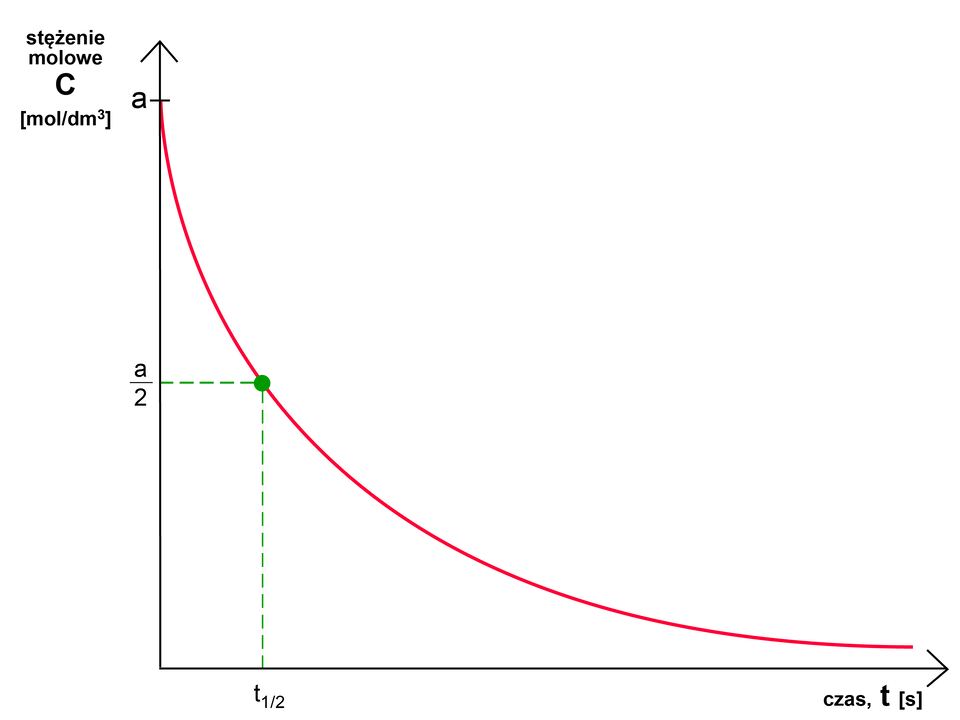
Reakcjami rzędu są reakcje, dla których rząd reakcji wynosi . Wówczas równanie kinetyczne ma postać:
gdzie:
– stężenie molowe substratu pozostałe po czasie ;
– początkowe stężenie molowe substratu;
– stała szybkości reakcji ;
– czas przebiegu reakcji;
– logarytm naturalny o podstawie (liczba Eulera), gdzie
Powyższe wyrażenie można również zapisać jako zależność masy ( i ), liczbę moli ( i ) lub jako liczbę cząsteczek ( i ). Wtedy:
Wykres ekspotencjalnej zależności stężenia molowego substratu od czasu wygląda następująco:

Na wykresy zależności stężenia molowego substratu w funkcji czasu ma wpływ stała szybkości reakcji. Jeżeli stała szybkość jest większa, nachylenie wykresu jest bardziej ostre.

Wykres ekspotencjalnej zależności szybkości reakcji od czasu wygląda następująco:

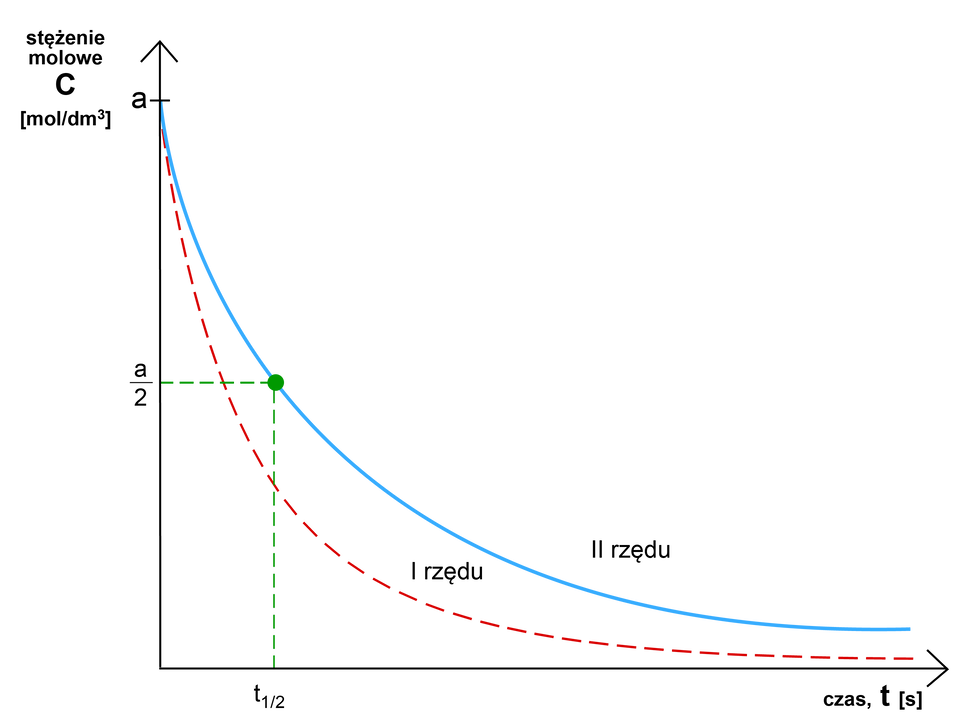
Reakcje rzędu
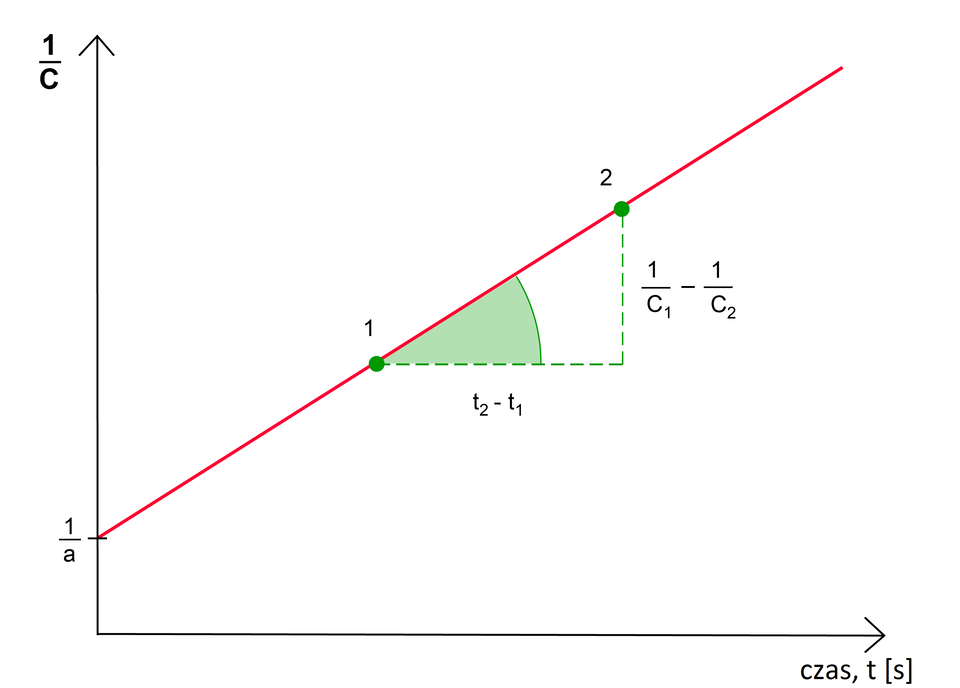
Reakcjami rzędu są reakcje, dla których rząd reakcji wynosi . Dla takich reakcji równanie kinetyczne ma postać:
gdzie:
– stężenie molowe substratu pozostałe po czasie t;
– początkowe stężenie molowe substratu;
– stała szybkości reakcji ;
– czas przebiegu reakcji.
Podsumowanie
![Schemat przedstawia podsumowanie informacji na temat rzędu reakcji: zerowego rzędu v=k, pierwszego rzędu v=k [A], drugiego rzędu v=k [A] do potęgi drugiej, v=k[A][B].](https://static.zpe.gov.pl/portal/f/res-minimized/R1drVVAnmSvC8/1613488806/1x0Stv4myxUuyhbLZzBlFHOGHXkNBESo.png)
Słownik
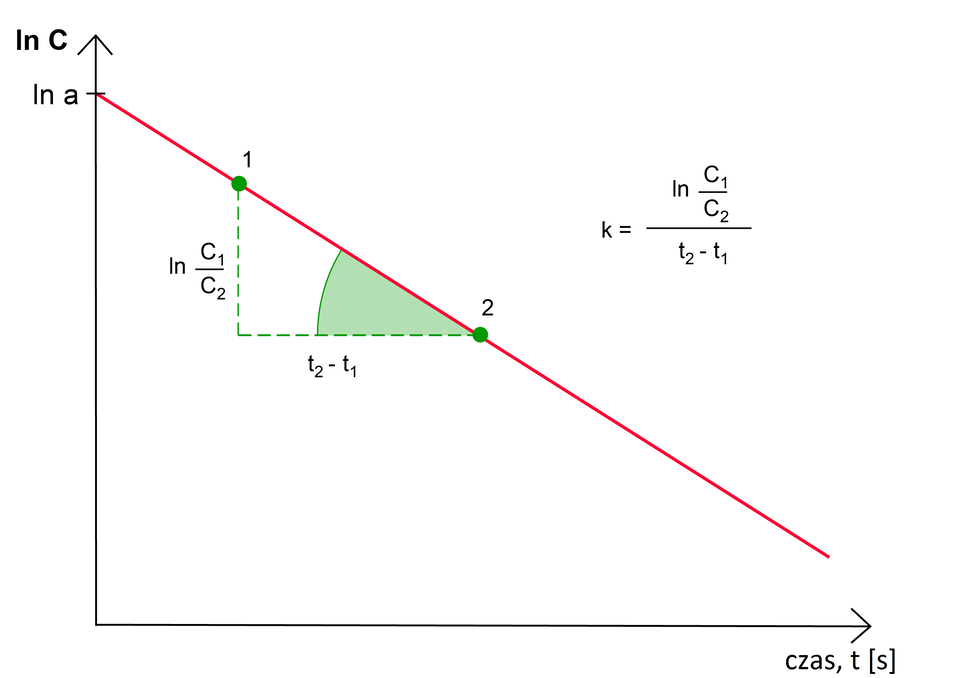
współczynnik proporcjonalności w równaniu kinetycznym, wyznaczany doświadczalnie, charakterystyczny dla danej reakcji chemicznej, zależny od temperatury i katalizatorakatalizatora; jednostkę stałej szybkości determinuje równanie kinetyczne w taki sposób, aby szybkość reakcji chemicznej wyrażona była w ; zależność jednostki stałej szybkości reakcji od rzędu reakcji przedstawia poniższy wzór ( – rząd reakcji):
opis dokładnego przebiegu reakcji chemicznej, wskazujący na produkty pośrednie powstałe w trakcie reakcji
każde indywiduum chemiczne występujące w złożonych reakcjach chemicznych, powstałe z substratów lub innych produktów pośrednich
substancja chemiczna, której dodatek do reakcji powoduje jej przyśpieszenie; bierze udział w reakcji, ale nie ulega zużyciu w czasie jej trwania
(łac. inhibeo „wstrzymuję”) substancja chemiczna, której dodatek do reakcji powoduje jej spowolnienie lub zatrzymanie; po zakończeniu reakcji jest w całości odzyskiwana
zależność szybkości reakcji chemicznej od stężenia reagentów i temperatury
Bibliografia
Bełtowska‑Brzezinska M., Podstawy kinetyki chemicznej – skrypt do wykładów, Poznań 2009.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.