Przeczytaj
Fluor jest najbardziej aktywnym niemetalem. Łączy się bezpośrednio z większością pierwiastków. Wyjątek stanowią azot, hel i argon. Fluor jest też najsilniejszym utleniaczem, co można zaobserwować w przypadku reakcji z wodą. W atmosferze fluoru następuje bardzo gwałtowny proces utlenianiautleniania (spalania) wody. W wyniku reakcji powstaje fluorowodór i cząsteczka tlenu.
Ustal formalne stopnie utlenienia pierwiastków oraz zapisz równania bilansu elektronowo‑jonowego.
Równanie reakcji redukcji:
Równanie reakcji utleniania:
Laboratoryjna, bezpieczna metoda otrzymywania fluorowodoru polega na działaniu mocnego kwasu na fluorek metalu, np:
Związki fluoru
Związkiem występującym w przyrodzie jest fluorek wapnia. Może być domieszką w apatytachapatytach i fosforytachfosforytach lub występować jako samodzielny minerał – fluoryt.
Najważniejszym, nieorganicznym związkiem fluoru jest fluorowodór, który –w przeciwieństwie do innych wodorków fluorowców – ze względu na tworzenie silnych wiązań wodorowych pomiędzy swoimi cząsteczkami, w warunkach normalnych jest cieczą. Reakcja syntezyReakcja syntezy fluoru z wodorem zachodzi bardzo gwałtownie również w fazie ciekłej obu reagentów, czyli w temperaturze poniżej -250°C. Jest to wyjątkowe zjawisko, ponieważ w tak niskiej temperaturze większość procesów przebiega bardzo powoli. Szczególna aktywność fluorowodoru przejawia się tym, że ma on zdolność do trawienia szkła.
Otrzymany w reakcji fluorowodór rozpuszcza się w wodzie, tworząc słaby kwas fluorowodorowy o właściwościach żrących i silnie toksycznych.
UWAGA! Doświadczenie należy wykonywać pod wyciągiem. Koniecznie stosować rękawice ochronne.
Trawienie szkła polega na roztwarzaniu krzemionki w wyniku jej reakcji z fluorowodorem. Pod wpływem fluorowodoru , tlenek krzemu(IV) ulega przemianie we fluorek krzemu(IV) . Produktem ubocznym tego procesu jest woda.

Ze względu na właściwości chemiczne, kwas fluorowodorowy nie może być przechowywany w szklanych opakowaniach, a jedynie w pojemnikach z tworzywa sztucznego.
Związki fluoru z innymi fluorowcamifluorowcami mają właściwości pośrednie między właściwościami tworzących je pierwiastków. Im cięższy fluorowiec, tworzący związek z fluorem, tym entalpia wiązania jest mniejsza, a fluorek bardziej reaktywny.
Znane są:
Mimo że fluor reaguje ze wszystkimi metalami, to niektóre z nich w niższych temperaturach ulegają pasywacji (pokrywają się warstewką ochronną soli). Należą do nich: , , , , , . Z tego powodu materiałem do produkcji aparatury do pracy z fluorem oraz zbiorników do jego transportu może być nikiel.
Fluor tworzy także związki z helowcami. Fluorki kryptonu i ksenonu powstają w reakcji syntezy bezpośredniej z pierwiastków (w zależności od warunków –temperatury, ciśnienia – powstaje odpowiedni fluorek).
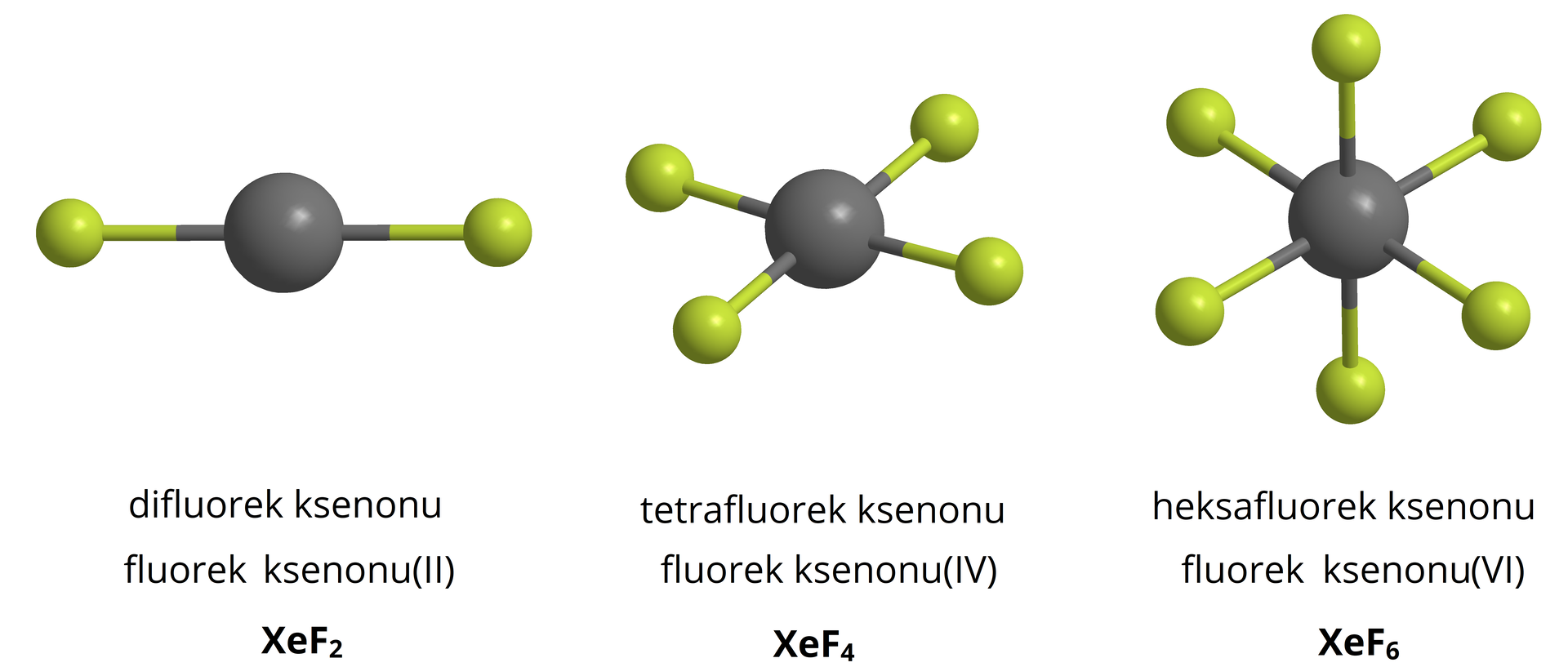
Znane są:
– fluorek kryptonu(II);
– fluorek ksenonu(II);
– fluorek ksenonu(IV);
– fluorek ksenonu(VI).
Związki te stosowane są jako silne środki fluorujące, np.:
Fluorki ksenonu są substancjami krystalicznymi.
Słownik
(gr. sýnthesis „złożenie”) reakcja chemiczna łącząca proste związki (substraty) do złożonego produktu
halogeny; pierwiastki 17. grupy układu okresowego: fluor (), chlor (), brom (), jod (), astat ()
fluorowcowodory; związki pierwiastków 17. grupy z wodorem: fluorowodór (), chlorowodór , bromowodór , jodowodór
(utlenianie, oksydacja; fr. oxygéne dosłownie „kwasoród”, „tlen”) oksydacja, proces polegający na oddaniu elektronu (elektronów) przez jon, atom lub grupę atomów, w wyniku czego podwyższa się stopień utlenienia pierwiastka oddającego elektrony
(gr. apato „oszukiwać”, ponieważ mylony jest często z innymi minerałami) szeroko rozpowszechnione minerały z gromady fosforanów, które są jednak niezwykle rzadko spotykane w postaci czystej; poza jonami fosforanowymi(V), zawierają w sobie również jony wapnia oraz dodatkowe jony; stanowią podstawowe źródło fosforu w przyrodzie
skały osadowe zbudowane w większości z fosforanów wapnia (apatytów), wykorzystywane jako żródło fosforu oraz do produkcji nawozów fosforowych
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 951‑968.
Czerwiński A, Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002, s. 335‑346.
Emsley J., Chemia. Przewodnik po pierwiastkach, Warszawa 1997, s. 70‑71.
Kałuża B., Kamińska F., Chemia. Podręcznik. Zakres rozszerzony, cz. 1, Warszawa 2013, s. 298‑299.
Waselowsky K., 225 doświadczeń chemicznych, Warszawa 1987, s. 51.



