Przeczytaj
Mangan
Mangan jest dwunastym najbardziej rozpowszechnionym minerałem na Ziemi. Występuje w skorupie ziemskiej, średnio w ilościach ok. , w znacznej części w postaci rud składających się z jego tlenków, węglanów i krzemianów. Jest, zaraz po żelazie, najbardziej rozpowszechnionym metalem ciężkim. Tworzy liczne minerały, z których największe znaczenie mają piroluzyt, manganit oraz rodochrozyt.
Mangan jest pierwiastkiem chemicznym należącym do metali przejściowychmetali przejściowych. Składa się z izotopów, ale trwały jest tylko izotopizotop , który stanowi niemal składu izotopowego manganu występującego w naturze. Mangan występuje na stopniach utlenienia od do . Na stopniach utlenienia od do I pierwiastek ten tworzy wyłącznie związki kompleksowe. Najczęśniej spotyka się związki manganu, w których mangan występuje na stopniu utlenienia od do , z czego trwałe są tylko trzy (, , ). Jako pierwiastek znajduje się w siódmej grupie czwartego okresu, czyli należy do bloku energetycznego . Jego liczba atomowa wynosi , natomiast konfiguracja powłoki walencyjnej w stanie podstawowym ma postać .
Mangan jest twardym, srebrzystoszarym metalem. Stosuje się go do wzbogacania stopów, ponieważ polepsza ich twardość i ciągliwość.

Jest bardzo ważnym mikroelementem, który wpływa na działanie wielu enzymów, pracę naszego układu nerwowego oraz jest niezbędny do prawidłowego rozwoju tkanki kostnej. Jego niedobór może zmniejszyć intensywność wzrostu oraz obniżyć płodność, z kolei jego nadmiar działa toksycznie.
Związki manganu są stosowane także w medycynie jako środki dezynfekujące (antyseptyczne) do odkażania ran. Manganian() potasu możesz kupić w aptece. Występuje w postaci malutkich tabletek lub proszku/kryształków.
Obecność manganu w wodzie pitnej może wpływać pośrednio na powstawanie niekorzystnych zmian cech wody.
Nawet w wodach o małej zawartości manganu mogą rozwijać się bakterie manganowe, które nadają jej nieprzyjemny, stęchły smak i zapach. Bakterie te tworzą w sieci wodociągowej błonę, a następnie pobierają z wody wolny chlor.
Mangan powoduje również ciemnienie jasnych tkanin podczas prania oraz powstawanie ciemnych osadów na urządzeniach sanitarnych.
Czysty mangan w warunkach laboratoryjnych i na skalę przemysłową otrzymuje się między innymi metodą aluminotermii, czyli redukcją tlenku manganu() glinem, zgodnie z równaniem reakcji:
Tlenki manganu zmieniają swój charakter – od zasadowego , poprzez amfoterycznyamfoteryczny , do wyraźnie kwasowego .
Stopnie utlenienia manganu
Stopień utlenienia | Przykładowa forma występowania | Charakter chemiczny | Jony |
|---|---|---|---|
zasadowy | |||
zasadowy | |||
amfoteryczny | |||
- | |||
kwasowy | |||
kwasowy | |||
Barwy tlenków manganu na różnych stopniach utlenienia
Stopień utlenienia | |||
|---|---|---|---|
Wzór tlenku | |||
Nazwa | tlenek manganu() | tlenek manganu() | tlenek manganu() |
Barwa | oliwkowozielona | czarna/brunatna | ciemnozielona (ciecz) |
Charakter kwasowo–zasadowy | zasadowy | amfoteryczny | kwasowy |
Właściwości utleniająco–redukujące | reduktor | reduktor lub utleniacz | utleniacz |
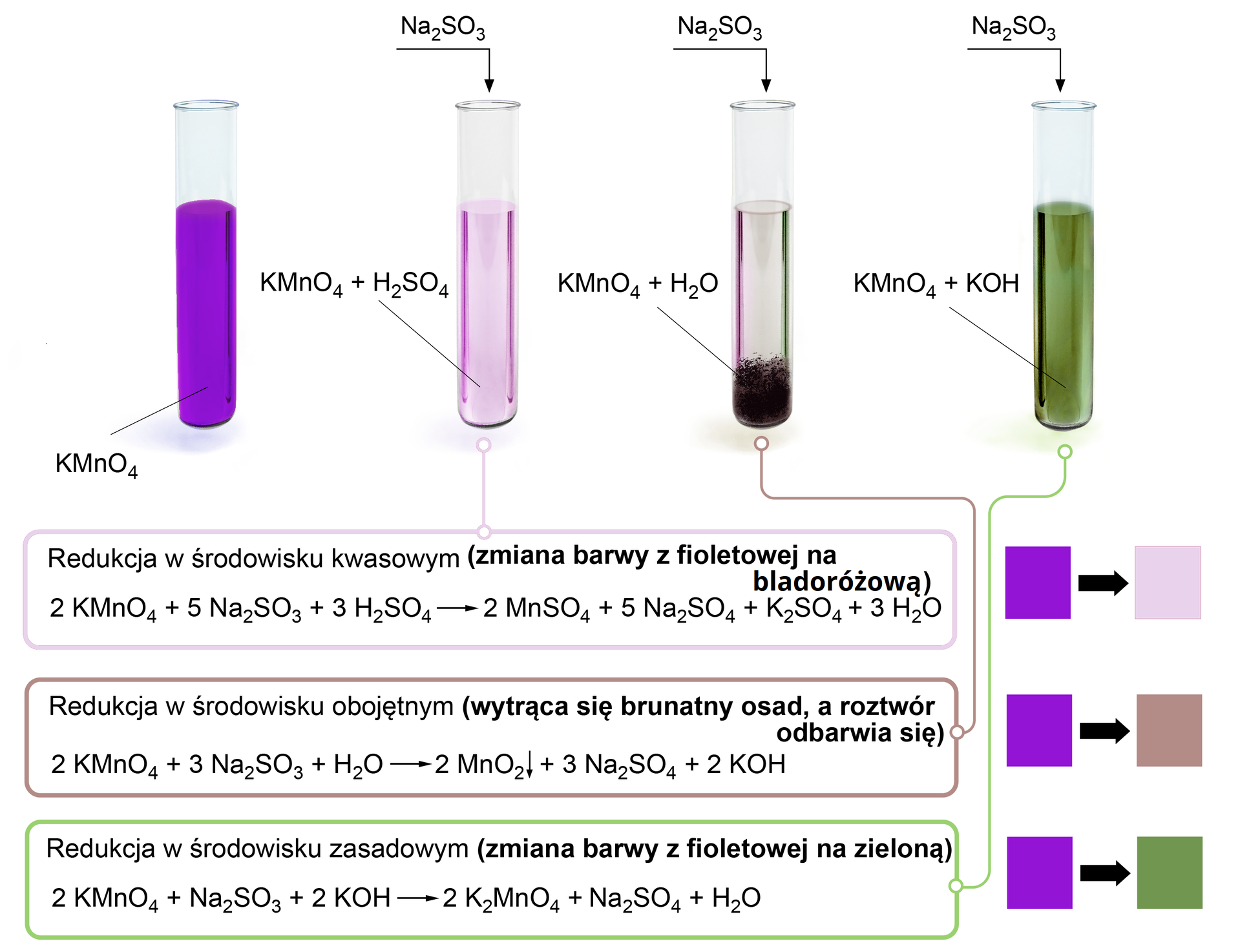
Doświadczenie
Przygotuj doświadczenie, w trakcie którego zbadasz reakcję manganianu() potasu z siarczanem() sodu w środowisku kwaśnym, obojętnym i zasadowym.
Zapamiętaj więc, że właściwości utleniająco‑redukujące związków manganu zmieniają się wraz ze zmianą stopnia utlenienia manganu w związku:
związki manganu() są reduktorami;
tlenek manganu() w zależności od doboru pozostałych substratów może pełnić zarówno rolę utleniacza, jak i reduktora;
związki manganu() są utleniaczami.
W Polskich Tatrach Zachodnich w okolicach Doliny Chochołowskiej i Lejowej znajdują się pakiety wapieni manganowych. W latach były one eksploatowane górniczo i rudy manganowe były traktowane jako dodatek do stopów stali wytwarzanej w piecach hutniczych, m. in. w Kuźnicach. W tej lokalizacji pozostało kilka starych sztolni, które znajdują się na zachodnim zboczu wzgórza Kliny oraz pod Wierchem Banie. Są to miejsca poza szlakami turystycznymi, więc nie można ich przemierzać na własną rękę. Mają za to swoje odniesienie w literaturze, np. Henryka Josta Dzieje górnictwa i hutnictwa w Tatrach Polskich lub w wersji bardziej popularno‑naukowej Macieja Pawlikowskiego oraz Marty Wróbel Tatrzańskie Skarby.
Słownik
zdolność związku chemicznego do reakcji zarówno z kwasem, jak i zasadą
odmienne postacie atomów pierwiastka chemicznego, rozbieżne co do liczby neutronów w jądrze. Izotopy tego samego pierwiastka różnią się liczbą masową (łączną liczbą neutronów i protonów w jądrze), ale mają tę samą liczbę atomową (liczbę protonów w jądrze)
grupa pierwiastków (jest ich ) chemicznych, których atomy lub jony posiadają niecałkowicie wypełniona podpowłokę ; metale tej grupy mają właściwości pośrednie między metalami alkalicznymi a metalami z bloku układu okresowego; wspólną cechą prawie wszystkich tych pierwiastków jest zdolność do tworzenia złożonych kompleksów, z których bardzo wiele wykazuje intensywne zabarwienie
(ang. parts per million „liczba części na milion”) oznaczenie stosowane m.in. przy wyrażaniu stężeń
cecha substancji, którą można zaobserwować podczas reakcji chemicznej; przykłady właściwości chemicznych to: toksyczność, palność, smak, zapach czy reaktywność
cecha substancji, której przykładami właściwości fizycznych są: gęstość, temperatura topnienia, opór właściwy, lepkość, moduł sztywności, współczynnik załamania światła
Bibliografia
Bielański A., Podstawy chemii nieorganicznej , Warszawa .
Durrant Ph. J., Durrant B., Zarys współczesnej chemii nieorganicznej, Warszawa , s. .
Gać P., Waliszewska M., Zawadzki M., Poręba R., Andrzejak R., Narażenie na mangan, .
Kemmitt R. D., W. Peacock R. D., The Chemistry of Manganese, Technetium and Rhenium, Oxford, NowyJork, Toronto, Sydney, Paryż, Braunschweig, , s. , , , .
Patnaik P., Handbook of Inorganic Chemicals, New York , s. .
Starek A., Mangan i jego związki nieorganiczne– w przeliczeniu na Mn, „Podstawy i Metody Oceny Środowiska Pracy” , t. , nr , s. .
Surgiewicz J., Mangan i jego związki – metoda oznaczania, „Podstawy i Metody Oceny Środowiska Pracy” , t. , nr , s. .