Przeczytaj
TermochemiaTermochemia to dział chemii fizycznej, zajmujący się badaniem efektu cieplnegoefektu cieplnego reakcji chemicznej. Efekt cieplny reakcji może być wyznaczony doświadczalnie przy użyciu kalorymetrukalorymetru lub metodami obliczeniowymi. W przypadku, gdy efektu cieplnego nie można bezpośrednio zmierzyć, np. z powodu bardzo powolnego przebiegu procesu lub z powodu zachodzących reakcji ubocznych, to w takich przypadkach stosuje się prawo Hessa.
Prawo Hessa
Prawo Hessa jest konsekwencją pierwszej zasady termodynamiki, wg której całkowita energia układuukładu izolowanego jest stała i nie zależy od zachodzących w nim przemian. Obliczenie standardowej entalpiientalpii dowolnej reakcji chemicznej jest możliwe dzięki zastosowaniu prawa Hessa. Zgodnie z nim:
zmiana entalpii, towarzysząca reakcji chemicznej (ciepło reakcji), nie zależy od drogi przemiany, a jedynie od efektów cieplnych stanów początkowego i końcowego układu.

Z prawa można korzystać, jeśli znane są entalpie, np. tworzenia lub spalania wszystkich substratów lub produktów danej reakcji chemicznej (mogą to być też entalpie dowolnych innych reakcji, które pozwolą po właściwym przekształceniu uzyskać pożądaną reakcję). Entalpię określa się zazwyczaj dla warunków standardowych (T= 273,15 K (0°C) i ciśnienia (p= 1000 hPa). Efekt cieplny reakcji to zmiana entalpii układu w reakcji chemicznej w warunkach stałego ciśnienia.
Wzór, który pozwala na obliczenie entalpii reakcji chemicznej, przedstawia się następująco:
gdzie:
– zmiana standardowej entalpii ;
– liczba moli produktów lub substratów;
– suma zmian standardowych entalpii tworzenia produktów;
– suma zmian standardowych entalpii tworzenia substratów.
Prawo to umożliwia obliczenie efektów energetycznych reakcji, które są trudne lub czasami nawet niemożliwe do bezpośredniego przeprowadzenia.
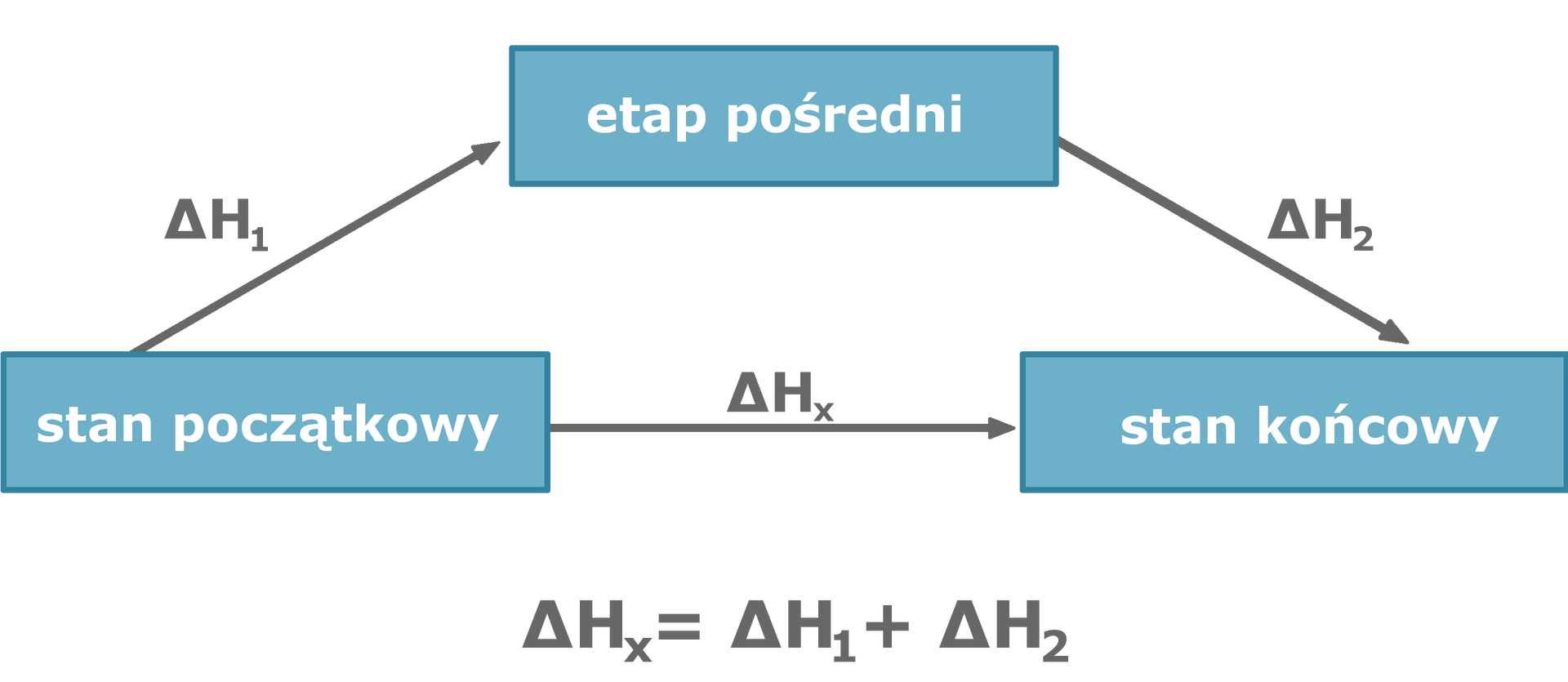
Prawo Hessa można przedstawić graficznie:
Standardową entalpię reakcji chemicznej oblicza się, sumując efekty cieplne wszystkich procesów, których efektem jest utworzenie kolejnych stanów pośrednich:
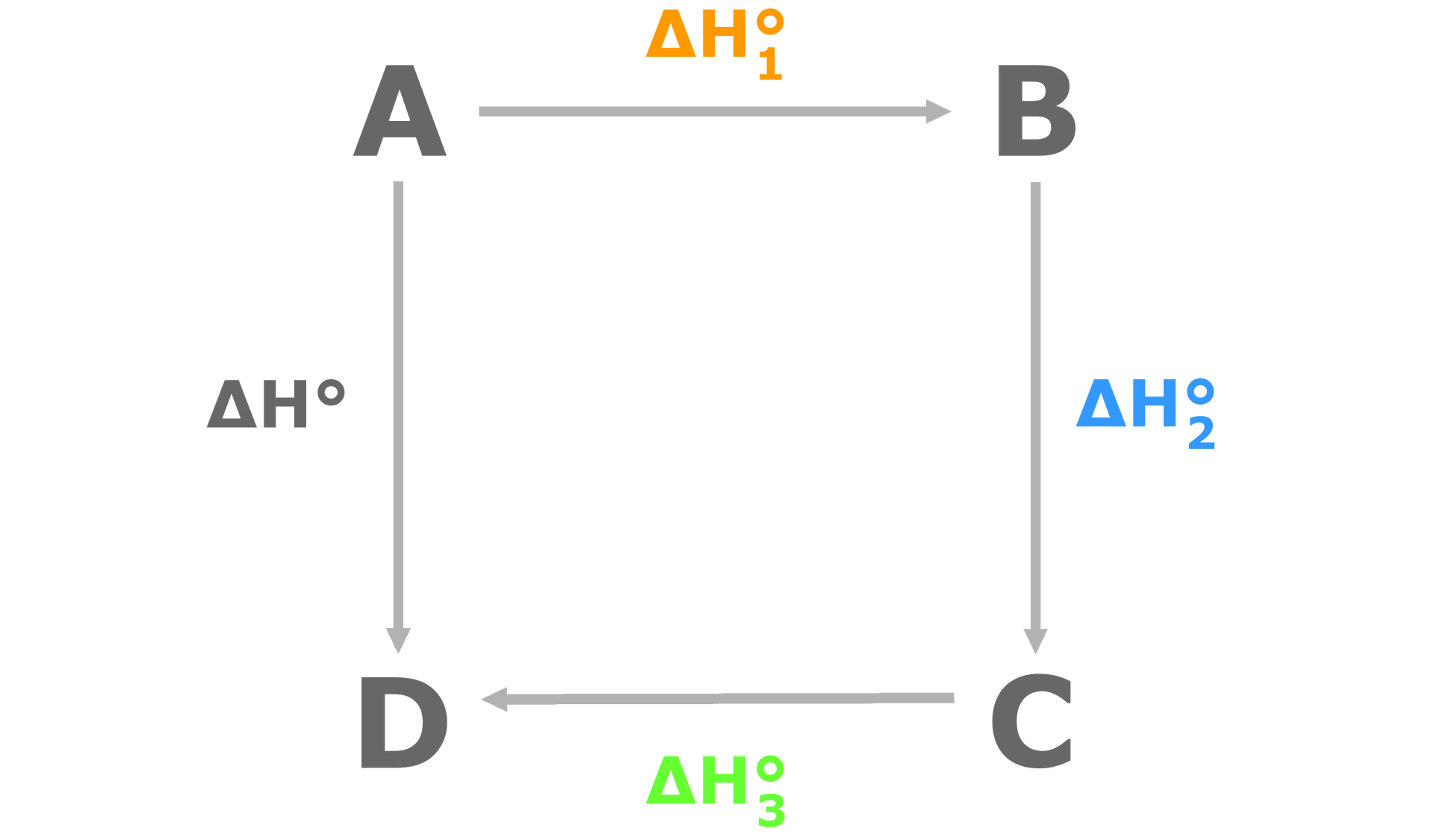
Obliczenia z wykorzystaniem prawa Hessa można przeprowadzić, układając cykl termochemiczny lub odpowiednio sumując równania reakcji (dla ułatwienia, w zapisie stosuje się ułamkowe współczynniki stechiometryczne reakcji).
Z cyklu termochemicznego musi wynikać, że sumaryczne równanie stechiometryczne wszystkich etapów jest równaniem reakcji bezpośredniej. Projektując cykl termochemiczny, można pominąć realność chemiczną etapów. Kiedy znany jest efekt cieplny, można wykorzystać każdy etap do obliczeń. Wartości entalpii tworzenia znajdziemy w tablicach chemicznych. Ich znajomość umożliwia obliczanie efektów cieplnych wielu reakcji. Należy znać jedynie entalpię tworzenia każdego z reagentów.
Dana jest reakcja:
Oraz znane są standardowe entalpie poniższych reakcji:
Mając powyższe dane, oblicz zmianę entalpii ∆H° podanej reakcji.
Prawo Hessa umożliwia obliczenie ciepła tworzenia praktycznie każdego związku chemicznego, pomimo że pomiary doświadczalne ciepła tworzenia (ciepła reakcji syntezy) są w przypadku wielu reakcji chemicznych trudne do wykonania.
Słownik
dział chemii fizycznej, który zajmuje się efektami energetycznymi reakcji chemicznych
wyodrębniona część przestrzeni, której zawartość jest badana lub obserwowana
efekt cieplny równy energii wymienianej na sposób ciepła między układem a otoczeniem podczas przemiany zachodzącej w warunkach izobarycznych (pod stałym ciśnieniem)
efekt energetyczny reakcji jest definiowany jako ilość energii przekazanej z otoczenia do układu lub z układu do otoczenia
przyrząd służący do pomiaru ilości ciepła, które zostało wydzielone lub pochłonięte przez układ podczas przemiany chemicznej lub fizycznej
Bibliografia
Atkins P., Paula J., Chemia fizyczna, Warszawa 2015.
Atkins P., Jones L., Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
Atkins P., Podstawy chemii fizycznej, Warszawa 1999.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.
