Przeczytaj
Informacje ogólne o siarce
Siarka jest niemetalem znajdującym się w grupie układu okresowego. W warunkach standardowych występuje głównie w postaci ośmioatomowych cząsteczek . Ze względu na dużą stabilność oraz niską reaktywność, siarka reaguje samorzutnie tylko z nielicznymi metalami – litem, sodem, potasem, rubidem, cezem i fransem.
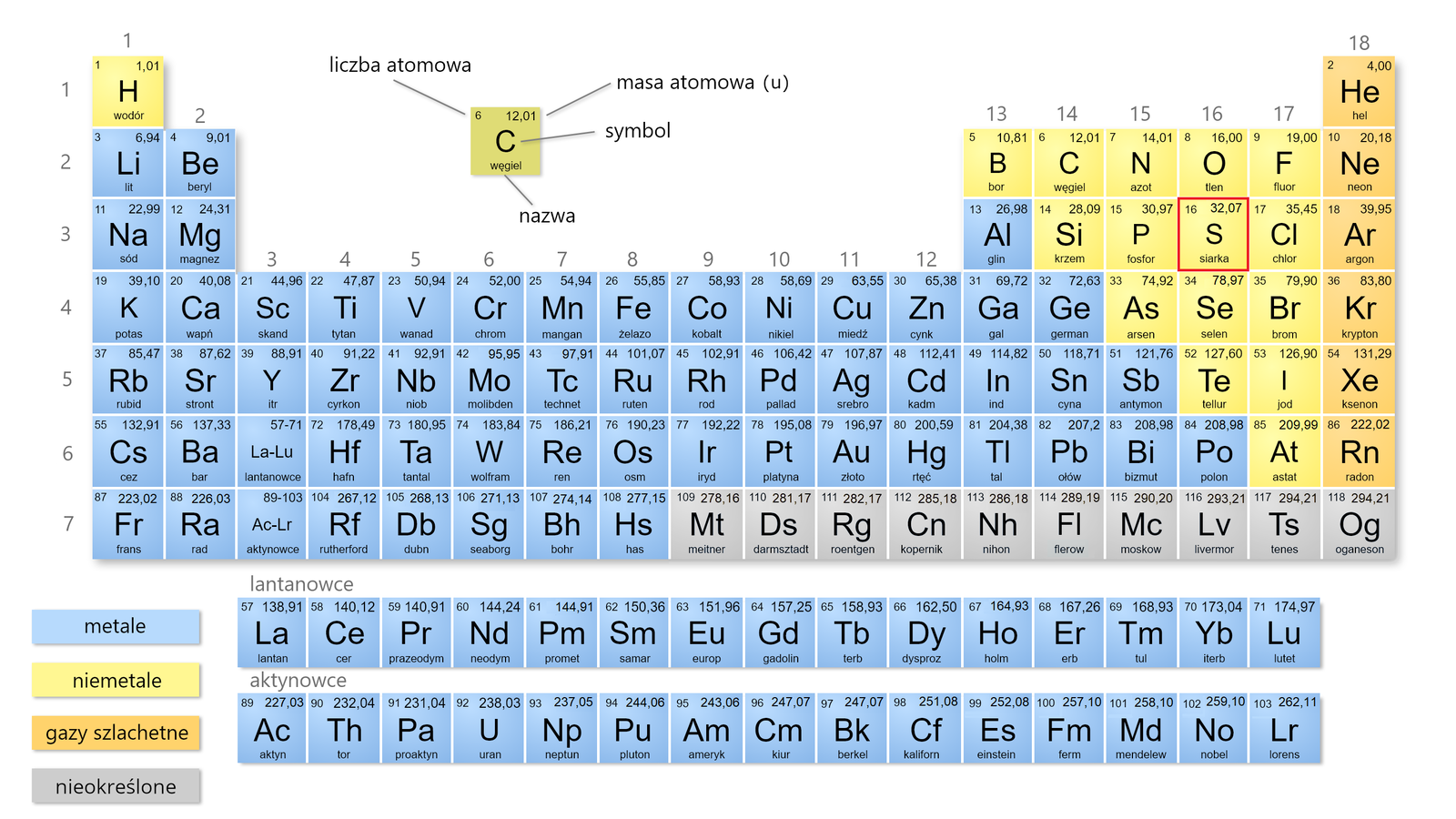
Przypomnijmy sobie najważniejsze informacje dotyczące budowy atomu siarki. Skorzystaj z układu okresowego i podaj pełną podpowłokową oraz skróconą podpowłokową (z rdzeniem gazu szlachetnego) konfigurację elektronową atomu siarki w stanie podstawowym. Na podstawie zapisanej konfiguracji elektronowej ustal, jakie stopnie utlenienia zazwyczaj przyjmują atomy siarki w związkach chemicznych.
Atom siarki chętnie przyjmuje dwa elektrony, stając się anionem siarczkowym . Dzięki temu może osiągnąć stabilną energetycznie konfigurację elektronową atomu najbliższego gazu szlachetnego – argonu.
Ze względu jednak na stosunkowo niewielką elektroujemność, szczególnie w porównaniu do innych niemetali, prócz wiązań jonowych siarka może tworzyć również wiązania kowalencyjne i w takich sytuacjach zwykle występuje na formalnych stopniach utlenienia i .
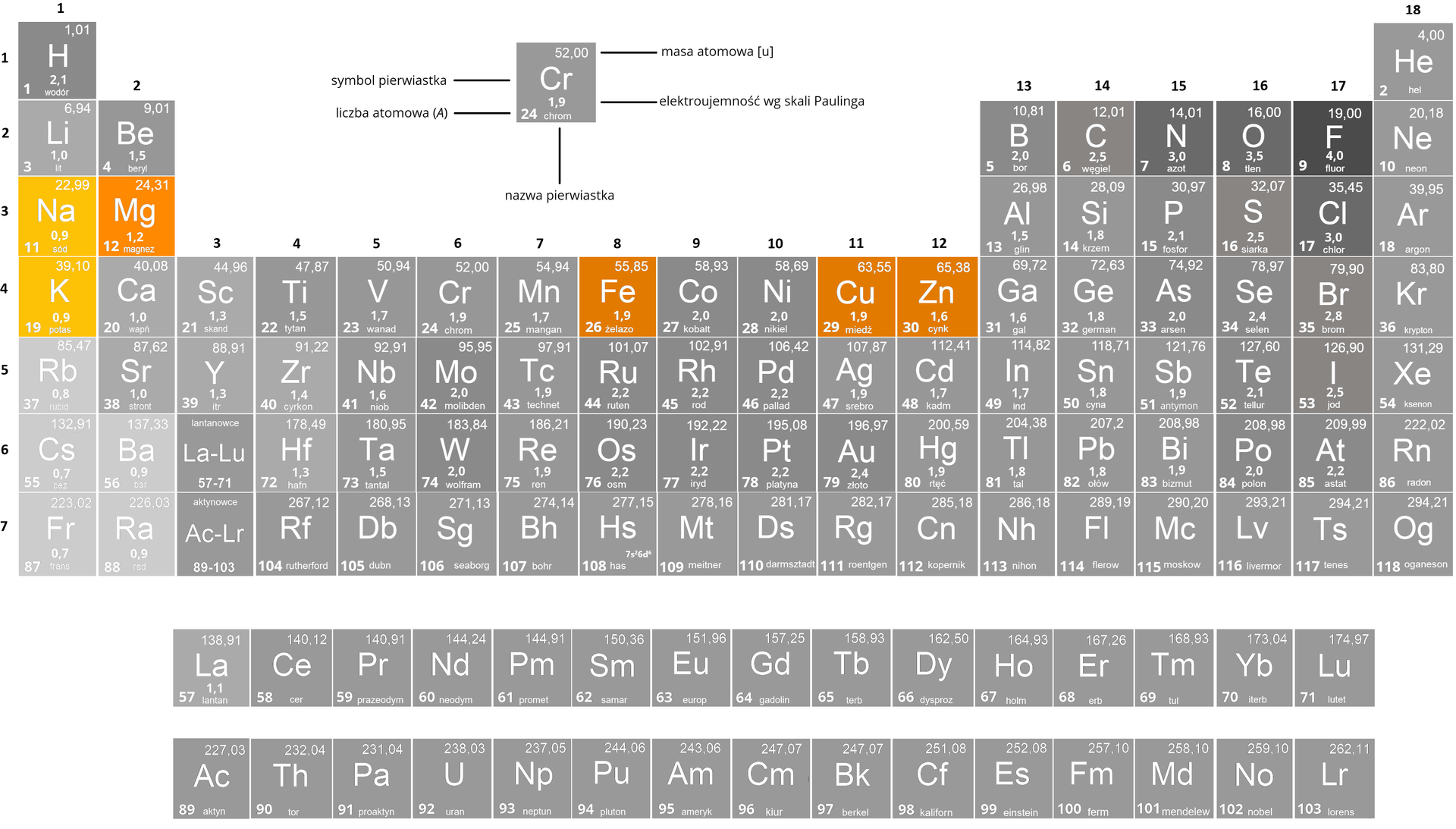
Elektroujemność metali i grupy układu okresowego pierwiastków (litowców i berylowców) jest na tyle niska, że wiązania w siarczkach generalnie traktujemy jako jonowe. W kolejnych grupach elektroujemność metali jest coraz wyższa, dlatego charakter wiązań w siarczkach tych metali jest pośredni między jonowym a kowalencyjnym. Udział wiązania kowalencyjnego w siarczkach metali rośnie wraz ze wzrostem elektroujemności metalu.
Aby określić naturę wiązań w związkach chemicznych przeprowadza się badania krystalograficzne. W ten sposób można stwierdzić, czy w danym związku wiązanie jest jonowejonowe, czy kowalencyjnekowalencyjne. Służy temu wykonanie pomiaru gęstości elektronowej wokół atomów tworzących wiązanie, za pomocą rentgenografii strukturalnej. Jeśli w przestrzeni między atomami występuje obszar, gdzie gęstość elektronowa jest tak mała, że nie da się jej zmierzyć, świadczy to o tym, że chmury elektronowe wokół obu atomów są wyraźnie od siebie oddzielone. Wtedy przyjmuje się, że wiązanie ma charakter jonowy.
Reakcje siarki z metalami grupy układu okresowego
Siarka stosunkowo łatwo reaguje z metalami alkalicznymi. Reakcje te przebiegają już w temperaturze pokojowej:
Lub w uproszczeniu:
Analizując powyższe ogólne równania reakcji, można zauważyć, że zaszły zmiany stopnia utlenienia atomów poszczególnych pierwiastków. Pierwiastkom w stanie wolnym (w analizowanym przykładzie metalom () i siarce) przypisujemy stopień utlenienia równy . W utworzonym siarczku, metal występuje na , a siarka na stopniu utlenienia. Opisana reakcja jest zatem reakcją redoks (utleniania‑redukcji).
Siarczki litowców są rozpuszczalne w wodzie, a ich wysokie temperatury topnienia potwierdzają ich jonowy charakter.
Temperatury topnienia przykładowych siarczków litowców:
Reakcja siarki z sodem
Siarka reaguje z metalami grupy układu okresowego tworząc wiązania jonowe. Przeanalizujmy reakcję chemiczną siarki z sodem. Podczas reakcji atom sodu oddaje jeden elektron (elektron walencyjny) przekształcając się w kation:
Konfiguracja elektronowa kationu sodu:
Natomiast atom siarki przyjmuje dwa elektrony i przekształca się w anion:
Konfiguracja elektronowa anionu siarczkowego:
Kationy sodu i aniony siarczkowe przyciągają się siłami elektrostatycznymi, tworząc sieć krystaliczną, w której na mol anionów siarczkowych, przypadają mole kationów sodu.
Jeżeli sód i siarkę umieścimy razem w probówce, dojdzie do reakcji, w wyniku której powstanie nowy związek – siarczeksiarczek sodu:
W uproszczeniu reakcję tę można opisać równaniem:

Zastanów się i odpowiedz na pytanie, czy reakcja syntezy siarczku potasu jest reakcją redoks? Jeżeli tak, to jak zmieniają się stopnie utlenienia w reakcji syntezy tego siarczku?

Niektóre siarczki metali aktywnych są rozpuszczalne w wodzie, natomiast w roztworach wodnych ulegają hydrolizie, na przykład:
Siarczki sodu i potasu są substancjami krystalicznymi, dobrze rozpuszczają się w wodzie.
Reakcje siarki z metalami grupy układu okresowego
Siarka reaguje z berylowcami po uprzednim zainicjowaniu reakcji, np. poprzez ogrzewanie. Często do przeprowadzenia reakcji zamiast siarki w stałym stanie skupienia, wykorzystuje się jej pary. W wyniku reakcji powstają odpowiednie siarczki. Powyżej opisana reakcja chemiczna przebiega zgodnie z ogólnym równaniem:
Lub w uproszczeniu:
Podobnie jak w przypadku reakcji z metalami grupy układu okresowego, również w czasie reakcji z berylowcami dochodzi do zmian stopnia utlenienia atomów pierwiastków chemicznych. W utworzonym siarczku, metal występuje na , a siarka na stopniu utlenienia.
Siarczek magnezu
Siarka w reakcji z magnezem tworzy wiązania jonowe.
Podczas reakcji atom magnezu oddaje dwa elektrony (elektrony walencyjne), przekształcając się w kation:
Konfiguracja elektronowa kationu magnezu:
Natomiast atom siarki przyjmuje dwa elektrony i przekształca się w anion:
Konfiguracja elektronowa anionu siarczkowego:
Kationy magnezu i aniony siarczkowe przyciągają się siłami elektrostatycznymi, tworząc sieć krystaliczną, w której na 1 mol anionów siarczkowych, przypada 1 mol kationów magnezu.
Reakcje siarki z żelazem, cynkiem i miedzią
Względnie niska elektroujemność siarki powoduje, że jej wiązania z metalami przejściowymi mają charakter mniej jonowy, a bardziej kowalencyjny, czyli mają charakter pośredni między jonowym a kowalencyjnym. Wiązania kowalencyjne tworzą się w skutek nakładania się orbitali walencyjnych s i p atomu siarki z orbitalami s, p i d metali przejściowych.
Siarczek żelaza()
Siarczek żelaza() można otrzymać w laboratorium przez krótkie ogrzewanie mieszaniny pyłu żelaznego i sproszkowanej siarki. Reakcję inicjuje się np. przy użyciu płomienia palnika.

Siarczek cynku
Siarczek cynku w czystej postaci jest białym krystalicznym proszkiem. W naturze występuje w postaci dwóch minerałów: sfalerytu i wurcytu, które przybierają różne barwy w zależności od obecności zanieczyszczeń.
Siarczek cynku można otrzymać w wyniku ogrzewania metalicznego cynku ze sproszkowaną siarką:

Siarczek miedzi()
Siarczek miedzi() można otrzymać w wysokiej temperaturze (powyżej ) poprzez działanie par siarki na metaliczną miedź w próżni:
W celu otrzymania siarczku miedzi() () należy miedź poddać reakcji z siarką w temperaturze niższej niż .
Siarka tworzy z niektórymi metalami także disiarczkidisiarczki, np. disiarczek sodu . Znane są także oraz .

Słownik
litowce; pierwiastki chemiczne stanowiące 1. grupę układu okresowego pierwiastków: lit (), sód (), potas (K), rubid (), cez () i promieniotwórczy frans ()
wiązanie chemiczne, które powstaje przez uwspólnianie elektronów (pary elektronowej) przez atomy tworzące wiązanie
wiązanie chemiczne, którego istotą jest elektrostatyczne oddziaływanie między jonami o różnoimiennych ładunkach; powstaje najczęściej między metalem a niemetalem
pochodne kwasu siarkowodorowego ; siarczki metali (sole) mogą być obojętne, o wzorze ogólnym , lub kwaśne, czyli wodorosiarczki, o wzorze ogólnym ( — atom metalu jednowartościowego)
związki chemiczne litowców, berylowców i glinu z siarką, w których siarka występuje na stopniu utlenienia
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987, s. 571‑574.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik, Warszawa 2002, s. 347‑360.
Litwin M., Styka‑Wlazła Sz., Szymońska J., Chemia ogólna i nieorganiczna. Część 1. Podręcznik dla liceum, Warszawa 2004 s. 59.
Piosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Gdańsk 2004, s. 790‑81.
Trzebiatowski W., Chemia nieorganiczna, Warszawa 1977, s. 196‑227.