Przeczytaj
Wodorki typu soli
Wodorki typu soliWodorki typu soli powstają w wyniku reakcji wodoru z metalem bloku s (z wyłączeniem berylu i magnezu) w podwyższonej temperaturze. Wzór ogólny wodorków można przedstawić następująco:
gdzie:
– symbol metalu;
– stopień utlenienia atomu metalu.
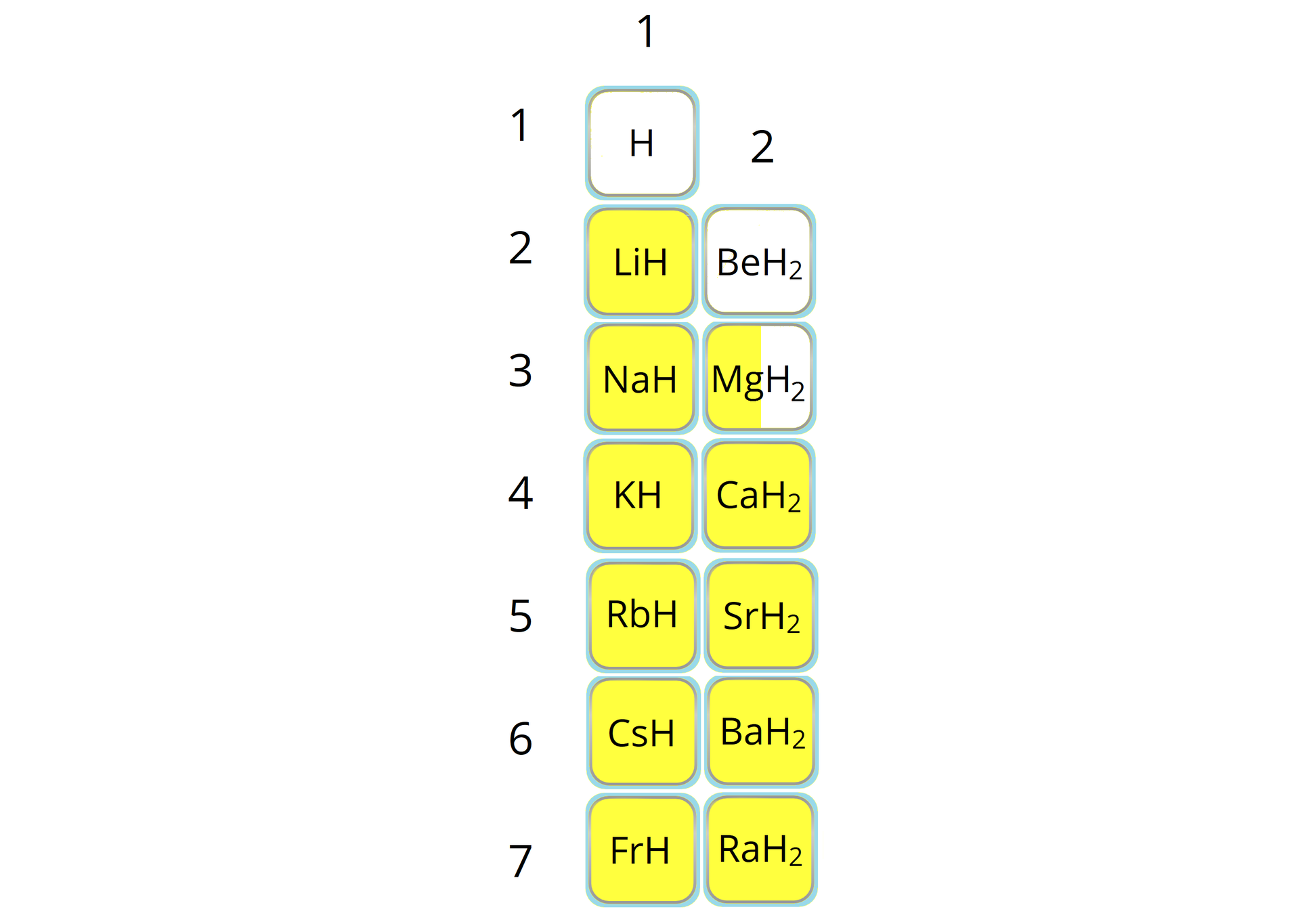
Dlaczego beryl nie tworzy wodorków typu soli?
Związane jest to z różnicą elektroujemnościelektroujemności. Wartość elektroujemności według Paulinga wodoru wynosi , a berylu . Różnica ich elektroujemności równa jest , co jest wartością odpowiadającą wiązaniu kowalencyjnemu. W wodorku magnezu również występuje wiązanie o charakterze kowalencyjnym.
Atom wodoru, w przypadku wodorków typu soli, jest bardziej elektroujemny niż atom metalu. W związkach tego typu atom wodoru przyjmuje jeden elektron od metalu bloku s. Staje się on jonem wodorkowym .
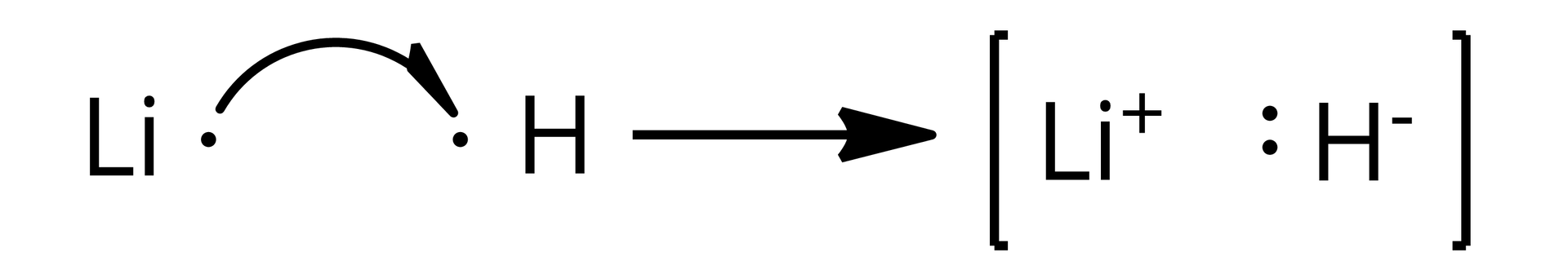
W wyniku powstania wodorków oba atomy osiągnęły korzystną energetycznie konfigurację elektronową najbliższego atomu gazu szlachetnego.
Jakim reakcjom ulegają wodorki typu soli?
Reaktywność wodorków rośnie w dół grupy układu okresowego, czyli wraz ze wzrostem różnicy elektroujemności atomów.
Wszystkie wodorki typu soli reagują z wodą z wytworzeniem gazowego wodoru oraz wodorotlenku metalu.
W wyniku reakcji wodorku z wodą wydziela się gazowy wodór. Takie reakcje są niebezpiecznie ze względu na ich gwałtowność oraz wydzielający się wodór, który wraz z tlenem tworzy mieszaninę piorunującą – istnieje ryzyko wybuchu.
Wodorek litu może posłużyć do otrzymania tetrahydroglinianu litu (glinowodorku litu) . Reakcję tę prowadzi się w eterze, między wodorkiem litu a chlorkiem glinu.
W środowisku niewodnym, np. przy użyciu bezwodnego rozpuszczalnika organicznego, ograniczamy możliwość uwolnienia się wodoru, a co za tym idzie, zmniejszenie ryzyka eksplozji.
Tetrahydroglinian litu jest szeroko używany w syntezie organicznej jako odczynnik redukujący. Dzięki jego użyciu możemy z kwasu karboksylowego otrzymać alkohol. Został zsyntezowany w przez Finholta, Bonda i Schlesingera.
Wodorki typu soli mogą reagować w reakcjach metatezyreakcjach metatezy z innymi wodorkami. Reakcja ta zachodzi pomiędzy stałym wodorkiem a rozpuszczonym w organicznym rozpuszczalniku chlorkiem. W wyniku tej reakcji jony wodoru zostają przeniesione na atom drugiego reagenta. Jednym z przykładów jest redukcja tetrachlorku krzemu do tetrawodorku krzemu.
Oblicz, z ilu gramów wodorku wapnia, reagującego z wodą, otrzymamy gazowego wodoru, odmierzonego w warunkach normalnych? Do obliczeń przyjmij następujące masy molowe:
Wodorki typu soli są dobrymi nośnikami wodoru – wystarczy wodorku, aby otrzymać gazowego wodoru (odmierzonego w warunkach normalnych). Jednak zastosowanie wodorków jako paliwa jest problematyczne ze względu na ich wysoką reaktywność, która może spowodować eksplozję.
Słownik
(łac. metathesis, z gr. muepsilontauάthetaepsilonsigmaiotaς metáthesis „przestawienie”) nazwa ta używana jest w syntezie organicznej jako określenie reakcji wymiany podwójnej
zdolność atomu do przyciągania elektronów
związki metalu z wodorem, w których występuje jon wodorkowy
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząstki, materia, reakcje, Warszawa .
Bielański A., Podstawy chemii nieorganicznej, Warszawa .
Encyklopedia PWN
Finholt A. E., Bond A. C., Schlesinger H. I., Lithum Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry, „J. Am. Chem. Soc” , t. , nr , s. ., online: https://pubs.acs.org/doi/abs/10.1021/ja01197a061, dostęp: .
Zuckerman J. J., Hagen A. P., Inorganic Reactions and Methods, The Formation of the Bond to Hydrogen, Oklahoma., online: https://books.google.pl/books?id=ANQtNtt1jcwC&pg=PA90&lpg=PA90&dq=SiCl4+%2B+LiH&source=bl&ots=ReAuD9oQ5o&sig=ACfU3U3phIlrM3brPLz6i8pVQKy8g7UIpg&hl=pl&sa=X&ved=2ahUKEwj-l8Gb6NvpAhXDmIsKHVEtBlsQ6AEwAXoECAUQAQ#v=onepage&q=SiCl4%20%2B%20LiH&f=false, dostęp: .