Przeczytaj
Liczba przestrzenna a kształt
Metoda VSEPR jest jedną z dokładniejszych, a zarazem najprostszych metod przewidywania kształtu cząsteczek. W metodzie tej, typ hybrydyzacji oraz orientacja przestrzenna cząsteczki są ustalane na podstawie liczby przestrzennej ()iczby przestrzennej (), co w praktyce sprowadza się do obliczenia jej wartości na podstawie konkretnych wzorów.
Danej wartości można przyporządkować odpowiedni rodzaj hybrydyzacji, co jest podstawą do określenia geometrii cząsteczki. W tabeli poniżej znajdziesz zestawienie liczb przestrzennych oraz odpowiadające im typy hybrydyzacjihybrydyzacji.
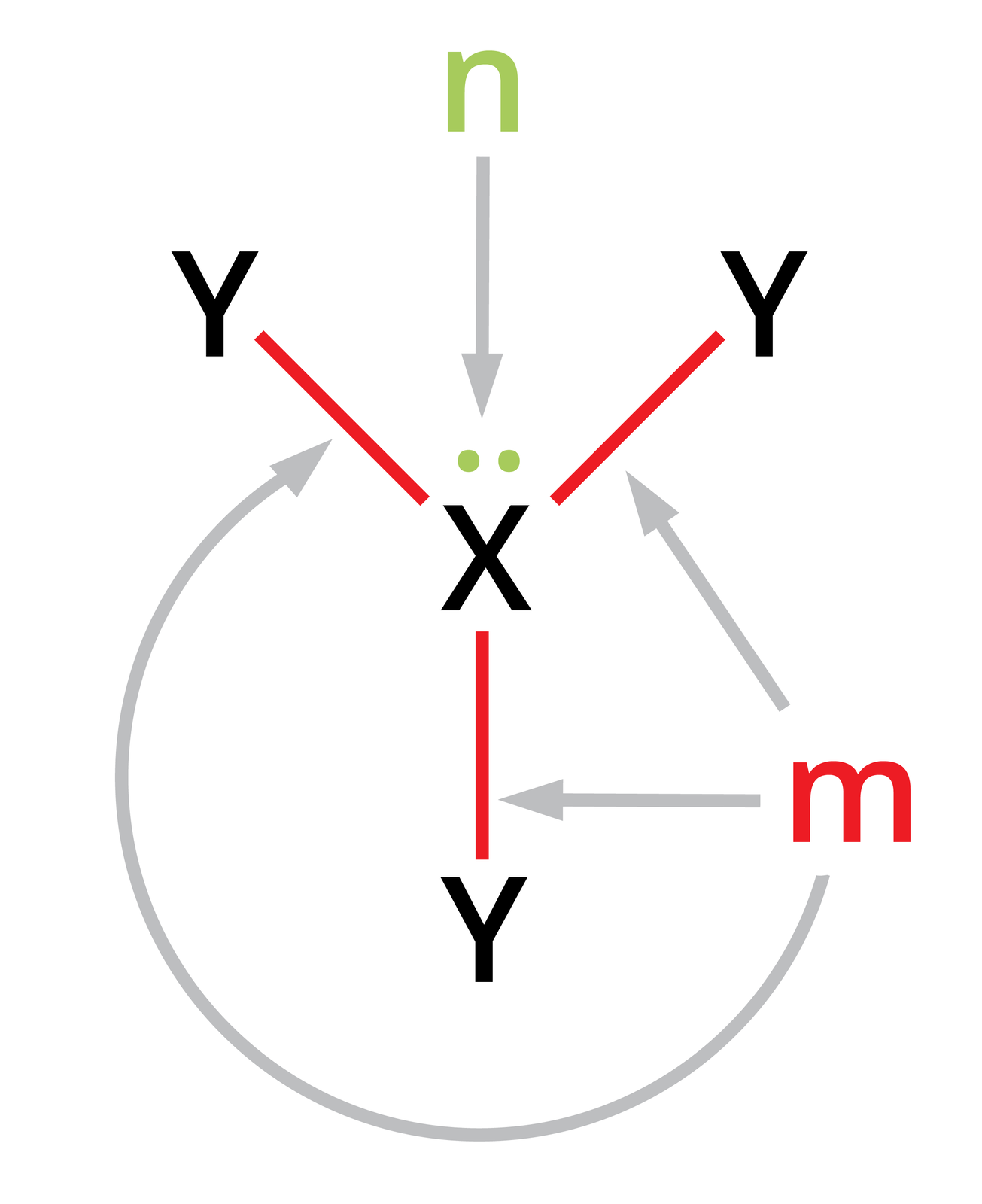
Typ cząsteczki zapisano w postaci skrótu, gdzie:
– atom centralnyatom centralny,
– atom otaczający atom centralny,
– liczba wolnych par elektronowych na atomie centralnym.
Kształt cząsteczek lub jonów dla poszczególnych liczb przestrzennych
Jak ustalić kształt jonu lub cząsteczki, korzystając z metody VSEPR?
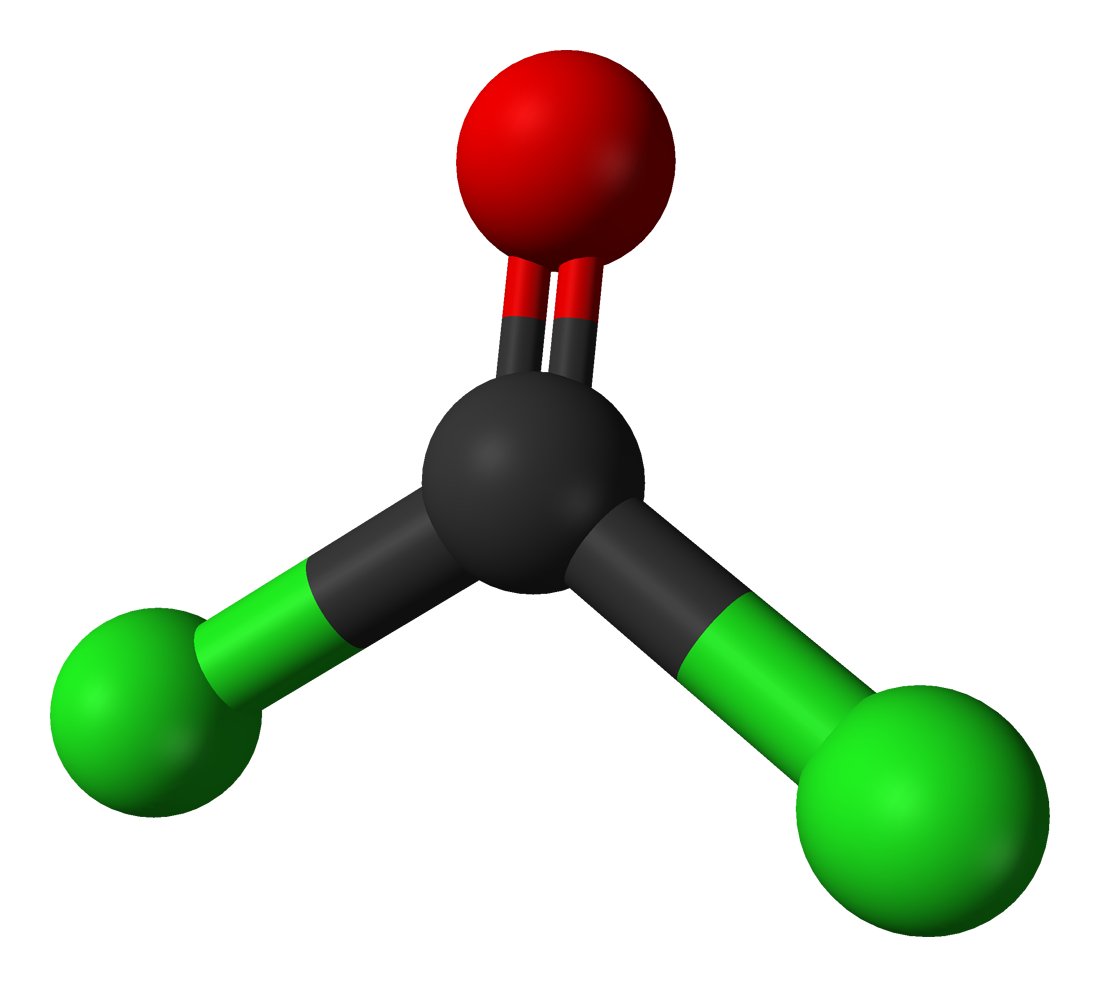
Przykład 1. Ustalanie kształtu cząsteczki obojętnej, np.
Przykład 2. Ustalanie kształtu jonu ujemnego, np.
Przykład 3. Ustalanie kształtu jonu dodatniego, np.
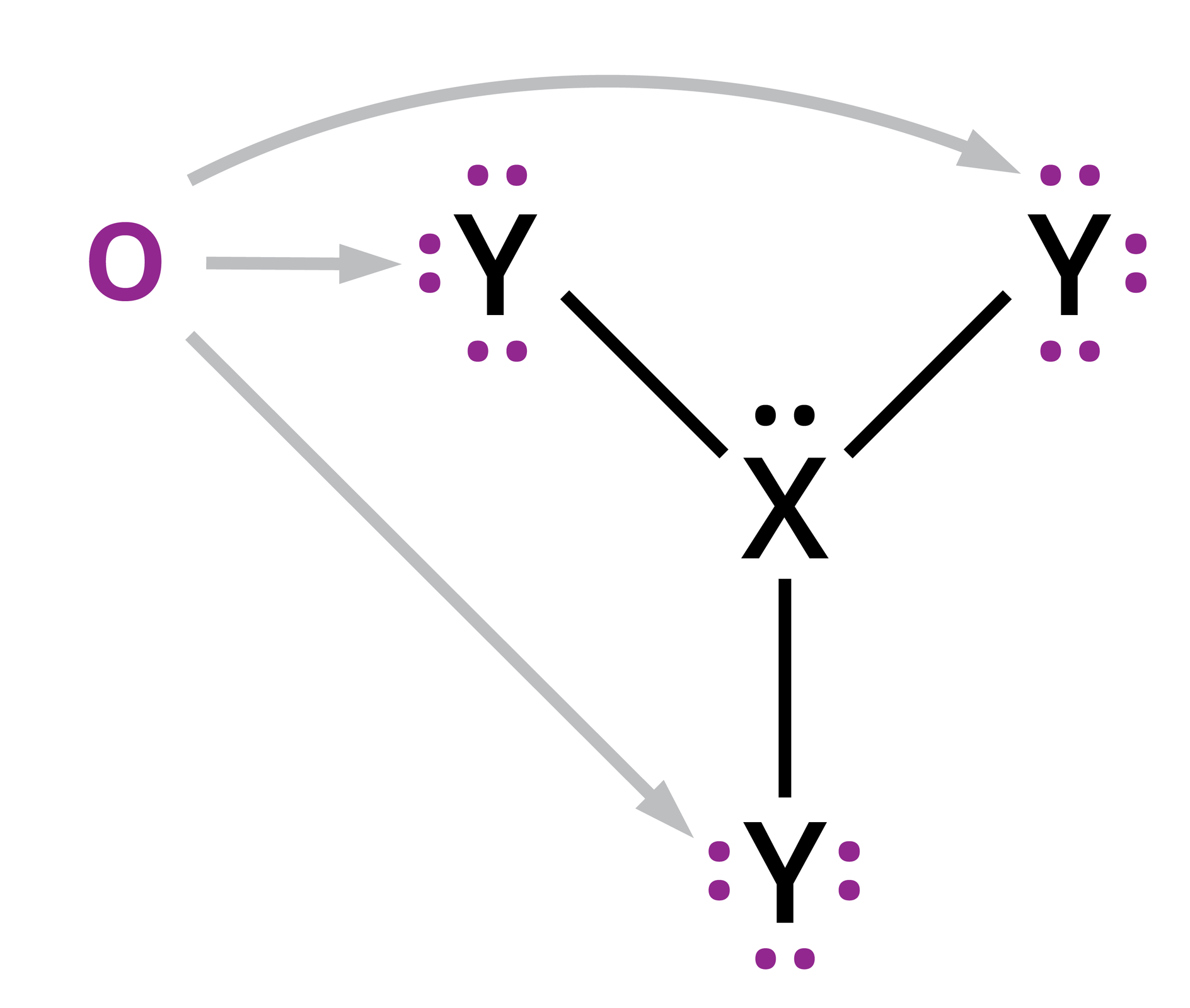
Przykład 4. Ustalenie kształtu cząsteczki na podstawie wzoru elektronowego, np.
Słownik
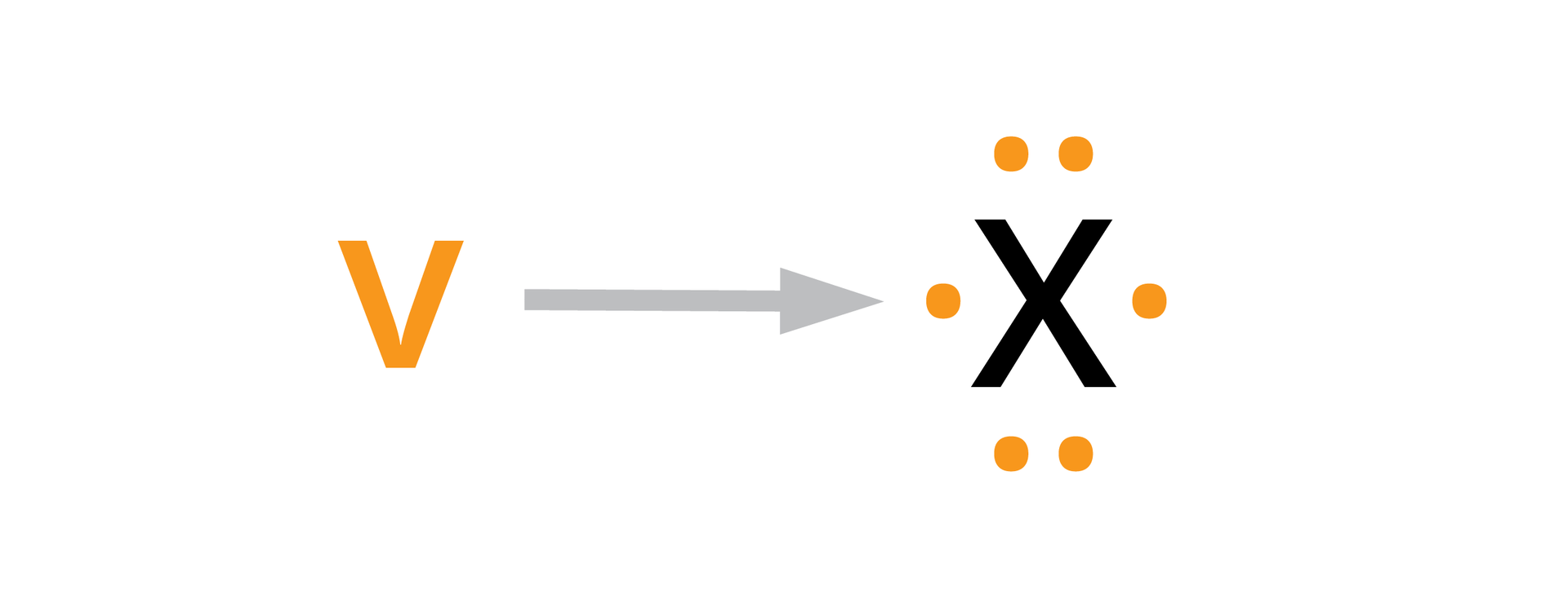
wartość pozwalająca wyznaczyć kształt cząsteczki z użyciem metody VSEPR; liczba przestrzenna jest równa liczbie wiązań z atomami otaczającymi i wolnych par elektronowych dookoła atomu centralnego cząsteczki; wiązania wielokrotne i wolne elektrony liczy się jako pojedyncze wiązanie
atom bądź jon stanowiący rdzeń kompleksu (koordynacyjne związki) i przyłączający (koordynujący) pewną liczbę jonów ujemnych lub cząsteczek obojętnych, zwanych atomami otaczającymi
(łac. hibrida „mieszaniec”) w chemii kwantowej – tworzenie kombinacji liniowych orbitali atomowych powłoki walencyjnej danego atomu wieloelektronowego, różniących się wartościami pobocznej liczby kwantowej
Bibliografia
Basiński A., Bielański A., Gumiński K. i inni, Chemia fizyczna, Warszawa 1966, s. 86–110.
Encyklopedia PWN
Jones L., Atkins P.,Chemical Principles: The Quest for Insight, 5th Edition, New York 2009.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2013.
Pfennig B. W., Principles of Inorganic Chemistry, New Jersey 2015.
Słownik Języka Polskiego PWN
Usnalski W., Chemia w szkole średniej, Warszawa 1998.