Przeczytaj
Szereg elektrochemiczny
Pierwszym skojarzeniem ze słowem elektrochemia jest ogniwo galwaniczne. To urządzenie, w którym – pod wpływem reakcji chemicznej – wytwarzane jest napięcie elektryczne. Dzięki takim ogniwom możemy korzystać z bezprzewodowych urządzeń elektrycznych. Mowa tu oczywiście o bateriach. Takie ogniwo zawsze składa się z dwóch półogniw, czyli elektrod (kawałków metalu), zanurzonych w roztworze elektrolitu (nie dotyczy to ogniw gazowych).
Półogniwo to elektroda zanurzona w roztworze elektrolitu, EIndeks górny 00- potencjał standardowy elektrody wyrażany w woltach.
Metale wykazują różną reaktywność. Kawałek sodu wrzucony do wody reaguje tak gwałtownie, że może dojść do eksplozji wydzielonego wodoru. Z kolei wrzucony do wody kawałek srebra nie wykazuje żadnych objawów reakcji.
Gdy metale ułożymy w szereg, w którym będą one ułożone ze względu na ich reaktywność, otrzymamy szereg elektrochemiczny, nazywany również szeregiem napięciowym metali.
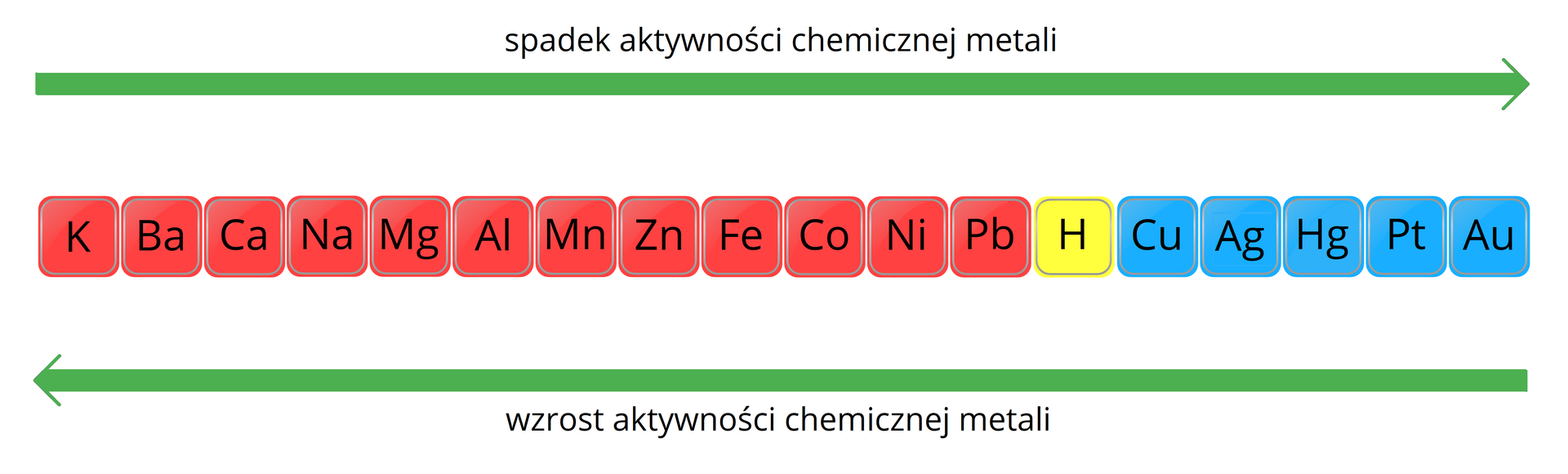
Szereg aktywności metali to zestawienie pierwiastków chemicznych wg ich potencjału standardowego. Punktem odniesienia jest elektroda wodorowa, której potencjał standardowy przyjmuje się za zero.
półogniwo | reakcja przebiegająca na półogniwie | [V] |
|---|---|---|
-3,04 | ||
-2,93 | ||
-2,91 | ||
-2,84 | ||
-2,71 | ||
-2,36 | ||
-1,97 | ||
-1,66 | ||
-1,18 | ||
-0,83 | ||
-0,76 | ||
-0,74 | ||
-0,44 | ||
-0,40 | ||
-0,28 | ||
-0,23 | ||
-0,15 | ||
-0,14 | ||
-0,13 | ||
-0,04 | ||
0,00 | ||
+0,07 | ||
+0,15 | ||
+0,15 | ||
+0,22 | ||
+0,27 | ||
+0,34 | ||
+0,40 | ||
+0,52 | ||
+0,54 | ||
+0,77 | ||
+0,80 | ||
+0,85 | ||
+1,09 | ||
+1,22 | ||
+1,23 | ||
+1,33 | ||
+1,36 | ||
+1,50 | ||
+1,51 | ||
+1,51 | ||
+1,72 | ||
+1,78 | ||
+1,92 | ||
+2,87 |
Indeks dolny Na podstawie: Indeks dolny koniecNa podstawie:Indeks dolny Bielański A., Podstawy chemii nieorganicznej, Warszawa 2010 oraz Indeks dolny koniec Bielański A., Podstawy chemii nieorganicznej, Warszawa 2010 oraz Indeks dolny Jones L., Atkins P., Chemia ogólna: cząsteczki, materia, reakcje, tłum. J. Kuryłowicz, Warszawa 2012. Indeks dolny koniecJones L., Atkins P., Chemia ogólna: cząsteczki, materia, reakcje, tłum. J. Kuryłowicz, Warszawa 2012.
Zwróć uwagę, że każda z par przedstawionych w szeregu odpowiada reakcją redukcji.
Jakie dane możemy odczytać z szeregu?
W lewej kolumnie szeregu elektrochemicznego są zapisane pary związków chemicznych, pierwiastków i jonów, które mogą pełnić rolę półogniw. Oznaczają one reakcje redukcji na elektrodzie, jakim ulega pierwiastek lub związek chemiczny, co w efekcie daje jony i pierwiastki - produkty reakcji. Jest to przedstawione w środkowej kolumnie.
W wyniku tej reakcji nikiel roztwarza się, tworząc kationy niklu(II) w roztworze. Utlenienie jednego mola niklu powoduje powstanie dwóch moli elektronów.
W prawej kolumnie przedstawiony jest standardowy potencjał elektrody EIndeks górny 00, który jest opisem zdolności metalu do ulegania reakcji redoks w temperaturze 25°C. W przypadku gazu, potencjał standardowy odnosi się do reakcji przeprowadzanej pod ciśnieniem 1013 hPa (1 atmosfera), a stanem standardowym potencjału elektrody w roztworze jest stężenie elektrolituelektrolitu równe 1 . Standardowy potencjał elektrody wyrażany jest w woltach, czyli jednostce napięcia.
Zwróć uwagę, że metale i jony, znajdujące się poniżej wodoru w szeregu elektrochemicznym, mają wartości dodatnie EIndeks górny 00, czyli są utleniaczami. Natomiast metale z ujemną wartością EIndeks górny 00 są reduktorami.
Dlaczego wodór ma wartość standardowego potencjału równą 0?
Wartość EIndeks górny 00 dla ogniwa została umownie przyjęta przez chemików i wynosi 0. Odnosi się ona do standardowego ogniwa wodorowego, zbudowanego z blaszki platynowej zanurzonej w roztworze kwasu chlorowodorowego.
Na podstawie standardowych półogniw, możemy obliczyć siłę elektromotoryczną ogniwasiłę elektromotoryczną ogniwa (SEM, E) zbudowanego z dwóch metali. W celu obliczenia siły elektromotorycznej ogniwa, korzystamy ze standardowych potencjałów elektrody zbudowanej z dwóch półogniw.
W powyższym wzorze użyte zostały oznaczanie EIndeks górny 00Indeks dolny katodykatody i EIndeks górny 00Indeks dolny anodyanody. Katoda zawsze ma większy potencjał od anody. To na niej zachodzi reakcja redukcji, zaś na anodzie zachodzi reakcja utlenienia. Znając wartości EIndeks górny 00, możemy przewidzieć, w jakim kierunku zajdzie reakcja metalu z roztworami kwasów czy soli. Metal bardziej aktywny (o mniejszym potencjale standardowym) będzie wypierał jony metalu (o większym potencjale standardowym).
Wartość SEM jest zawsze wartością dodatnią, ponieważ działanie ogniwa jest procesem samorzutnym – w wyniku którego może popłynąć prąd elektryczny. W przeciwnym wypadku, jeżeli SEM ma wartość ujemną, nie jest to proces samorzutny. Oznacza to, że należy przyłożyć napięcie do układu, aby zaszła reakcja chemiczna. Wówczas katoda staje się anodą i odwrotnie, a proces może stać się samorzutny.
Przeprowadzono następujące doświadczenie, podczas którego do pięciu probówek dodano roztwór siarczanu(VI) miedzi(II) o stężeniu 1 . W probówkach zanurzono blaszki (w jednej probówce znajduję się jedna blaszka): miedzi, kadmu, manganu, srebra i cyny. Na podstawie standardowego potencjału elektrody określ, w których probówkach zajdzie reakcja chemiczna.
Krok 1. Zlokalizuj w szeregu napięciowym pierwiastki wymienione w zadaniu i zapisz ich potencjały standardowe.
Krok 2. Uszereguj pierwiastki względem rosnącego standardowego potencjału.
Metale bardziej aktywne, czyli takie, które mają niższy potencjał standardowy, wypierają jony metali o wyższym potencjale standardowym.
Krok 3. Przeanalizuj położenie metali względem jonu metalu, który występuje w roztworze.
Blaszki metali zanurzone są w roztworze zawierającymi jony . Potencjał standardowy / wynosi +0,34 V. Zatem metale, które mają niższe wartości potencjału standardowego, będą wypierać jony miedzi z roztworu. Probówki, w których zajdzie reakcja, to próbówki z blaszką manganu, kadmu oraz cyny. Nie zaobserwujemy objawów reakcji w probówce z blaszką srebra i miedzi.
Wyznacz siłę elektromotoryczną ogniwa zbudowanego z płytki kobaltowej zanurzonej w roztworze azotanu(V) kobaltu o stężeniu 1 i płytki cynkowej zanurzonej w roztworze azotanu(V) cynku o stężeniu 1 .
Krok 1. Odszukaj w szeregu elektrochemicznym potencjały standardowe elektrod.
Krok 2. Określ, która elektroda będzie anodą, a która katodą?
Anodą będzie elektroda zbudowana z metalu o niższym potencjale standardowym, a katodą z metalu o wyższym potencjale standardowym.
- katoda
- anoda
Krok 3. Skorzystaj ze wzoru na siłę elektromotoryczną ogniwa.
Siła elektromotoryczna danego ogniwa wynosi 0,48 V.
Słownik
zdolność związków i pierwiastków chemicznych do wejścia w reakcję chemiczną z innym związkiem lub pierwiastkiem.
zdolność do oddawania elektronów przez metal. Metal bardziej aktywny chemicznie wypiera mniej aktywny metal z wodnego roztworu jego soli.
siła elektromotoryczna ogniwa, w którym drugą elektrodą jest elektroda wodorowa, której przypisuje się potencjał równy zeru. Dla anody potencjał standardowy jest ujemny, a dla katody dodatni
(gr. ḗlektron „bursztyn”, hodós „droga”) układ złożony z przewodnika elektronowego (metal, półprzewodnik) stykającego się z przewodnikiem jonowym (najczęściej ciekły elektrolit), w którym może przebiegać reakcja elektrodowa utleniania‑redukcji
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) przewodnik elektryczny jonowy (zwany też przewodnikiem drugiego rodzaju), w którym poruszające się jony przenoszą ładunki elektryczne i przewodzenie prądu zawsze jest związane z transportem masy.
napięcie źródła energii elektrycznej w stanie jałowym (przy odłączonym obciążeniu)
szereg napięciowy, uszeregowanie pierwiastków chem. w kolejności wzrastającej zdolności do przyjmowania przez nie (lub ich kationy) elektronów w reakcjach utleniania‑redukcji (redoks) w warunkach standardowych
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząstki, materia, reakcje, Warszawa 2018.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2007.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Staluszka J., Chemia 3. Równowagi i procesy jonowe Podręcznik dla liceum ogólnokształcącego, Gdynia 2005.
Pigoń K., Ruziewicz Z., Chemia Fizyczna. T. 1. Podstawy fenomenologiczne, Warszawa 2005.