Przeczytaj
Berylowce
Berylowce to pierwiastki drugiej grupy układu okresowego. Są miękkimi i łatwo topliwymi ciałami stałymi barwy szarej lub srebrzystoszarej. Wszystkie występują na Ziemi naturalnie, choć bar tylko w ilościach niewielkich, a rad w śladowych.
Zawartość pierwiastków 2. grupy układu okresowego w postaci jonów lub związków chemicznych w skorupie ziemskiej przedstawiono w poniższej tabeli.
Symbol pierwiastka | ||||||
|---|---|---|---|---|---|---|
Zawartość w skorupie ziemskiej (%) |
Indeks dolny Trzebiatowski W., Chemia nieorganiczna, PWN, Warszawa 1977, s. 390. Indeks dolny koniecTrzebiatowski W., Chemia nieorganiczna, PWN, Warszawa 1977, s. 390.
Berylowce są aktywne chemicznie, dlatego trudno jest je wydzielić z ich związków w postaci metalicznej. Występują w związkach wyłącznie na stopniu utlenienia +II. Aktywność berylowców rośnie w dół grupy. Beryl i magnez mogą być przechowywane z dostępem do powietrza, natomiast wapń, stront i bar, podobnie do sodu czy potasu, przechowuje się pod naftą.
Konfiguracje elektronowe atomów berylowców
Poniżej przedstawiono zapisy konfiguracji podpowłokowych skróconych (zawierających rdzeń gazu szlachetnego) atomów berylowców stanie podstawowym:
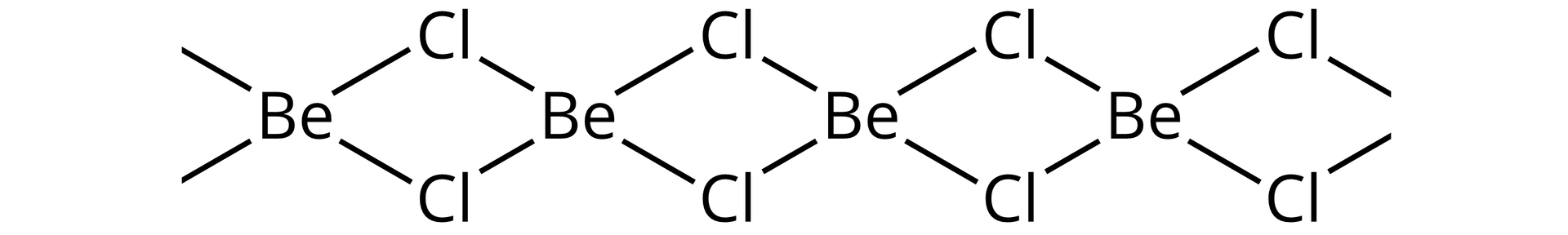
Analizując przedstawione konfiguracje można zauważyć, że atomy wszystkich pierwiastków drugiej grupy posiadają dwa elektrony walencyjne. Oba obsadzone na orbitalach typu s. Berylowce, jako pierwiastki silnie elektrododatnie, zwykle chętnie oddają elektrony, tworząc wiązania jonowe i uzyskując konfigurację gazów szlachetnych poprzedzających je w układzie okresowym. W związkach takich występują wtedy w postaci jonów . Wyjątkowo pod tym względem zachowuje się beryl, który w przypadku większości związków tworzy wiązania kowalencyjne, zamiast, wydawałoby się bardziej korzystnych wiązań jonowych. Fluorek berylu wykazuje wprawdzie charakter jonowy, ale już chlorek berylu jest związkiem o budowie kowalencyjnej. Substancja ta w stanie stałym zawiera w swej sieci długie łańcuchy, w których beryl ma liczbę koordynacyjną 4, a atomy chloru tworzą mostki pomiędzy atomami berylu.
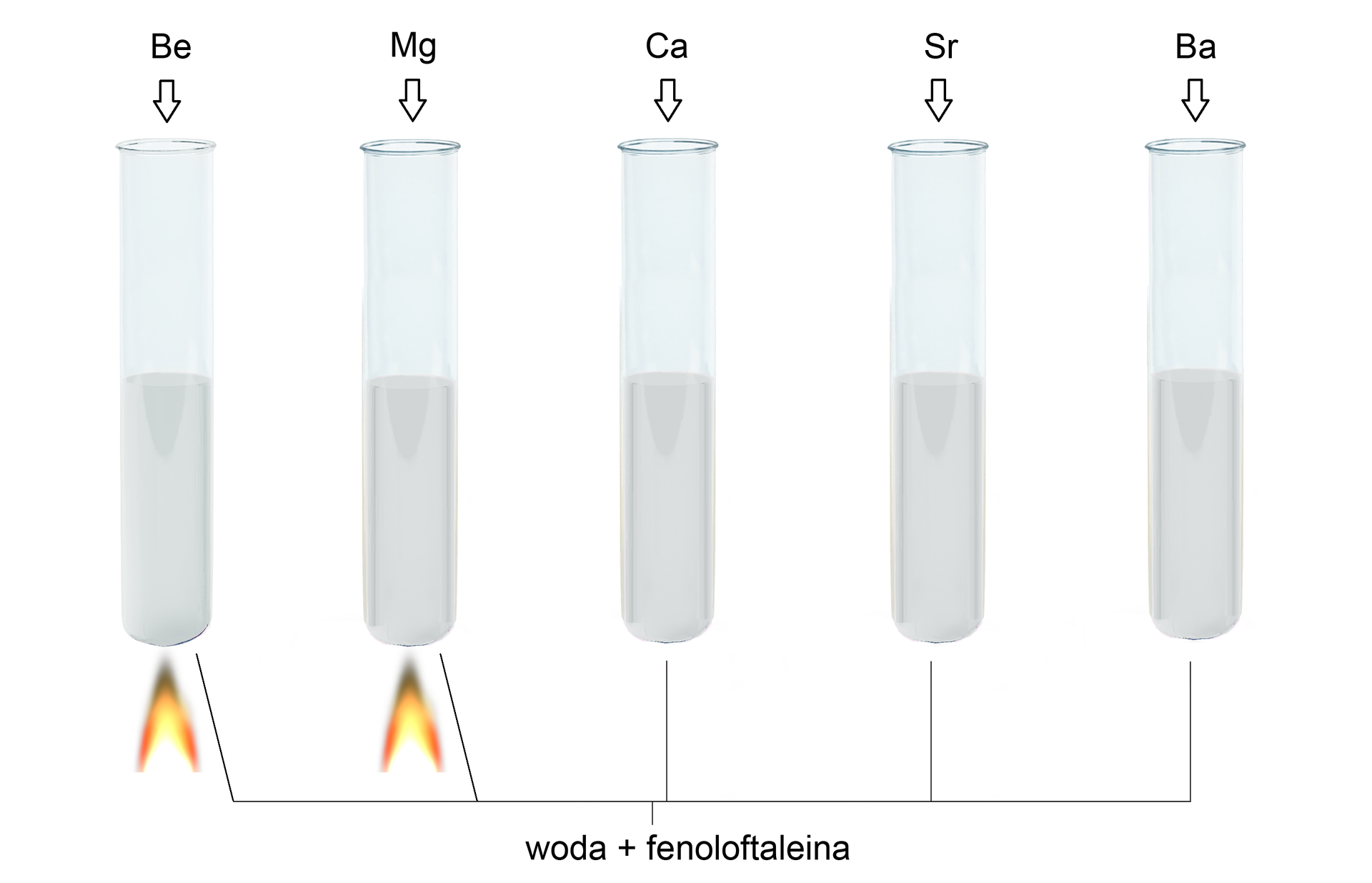
Reakcje berylowców z wodą
Wapń, stron i bar w sposób widoczny reagują z wodą w temperaturze pokojowej - reaktywność rośnie w dół grupy. Magnez z zimną wodą reaguje bardzo wolno, ale szybkość tej reakcji rośnie znacznie po ogrzaniu. Beryl jako jedyny z pierwiastków należących do 2 grupy układu okresowego nie reaguje z wodą zarówno na zimno, jak i po ogrzaniu. Produktami tych reakcji są odpowiednie wodorotlenki i wodór.
Powstające w reakcji z wodą wodorotlenki berylowców, począwszy od magnezu, tworzą roztwory zasadowe. Wodorotlenek magnezu jest wprawdzie bardzo słabo rozpuszczalny, a wodorotlenek wapnia słabo rozpuszczalny, niemniej ich wodne roztwory i tak przyjmują mocno zasadowy odczyn. Dzieje się tak dlatego, że wodorotlenki berylowców (z wyjątkiem wodorotlenku berylu) są mocnymi wodorotlenkami, o charakterze zasadowym, praktycznie całkowicie zdysocjowanymi w roztworze wodnym na jony.
Wodorotlenek berylu jest praktycznie nierozpuszczalny w wodzie, a charakter chemiczny tego wodorotlenku jest amfoteryczny.
Właściwości wodorotlenku berylu przejawiają się w reakcjach z kwasami i zasadami:
Produktem powyższej reakcji jest tetrahydroksoberylan sodu.
Reakcję magnezu z wodą można przeprowadzić w bardzo widowiskowy sposób. Jak wykonać takie doświadczenie i co będzie potrzebne?
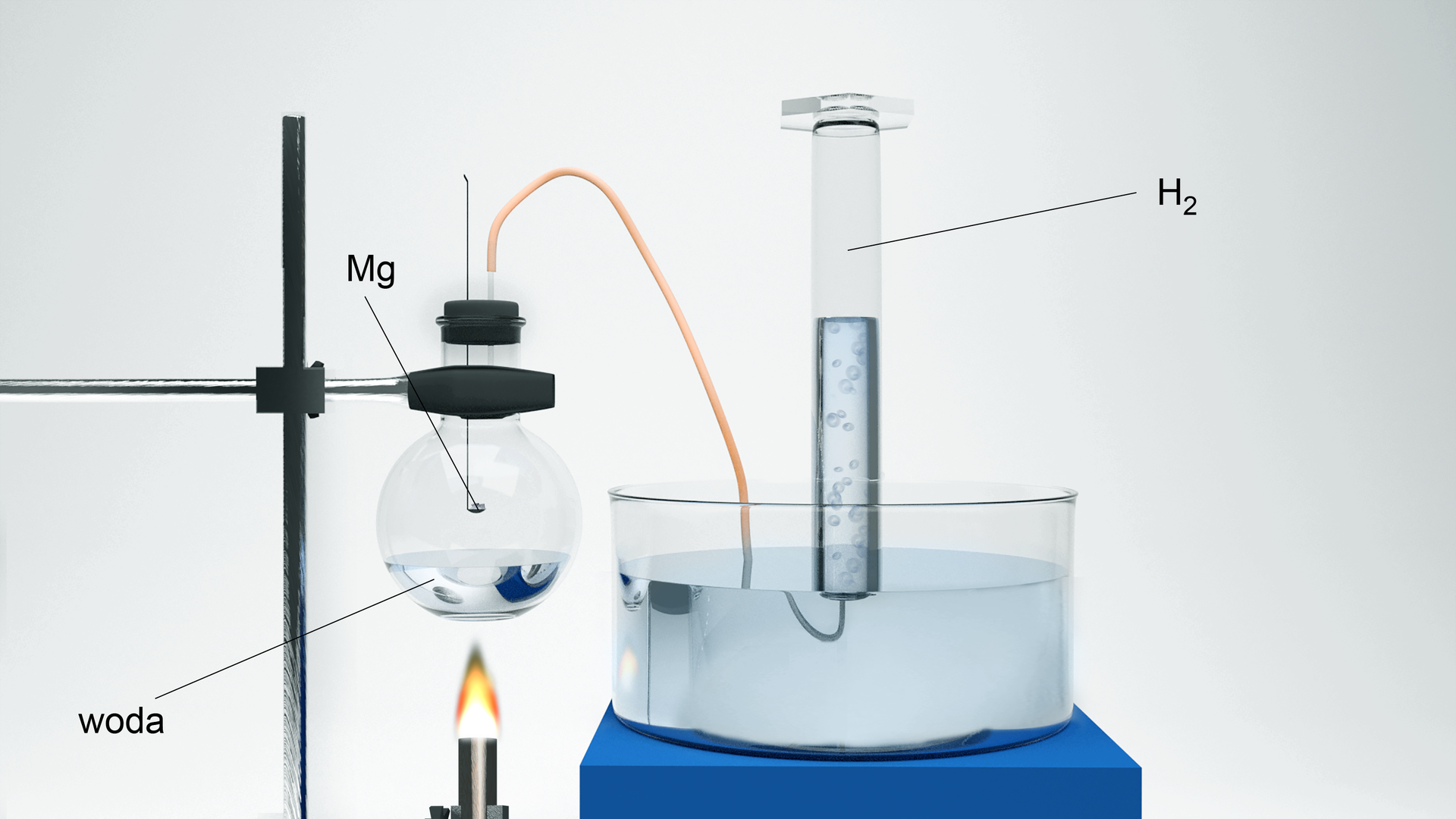
Indeks dolny Piosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Wydawnictwo UG, Gdańsk 2004, s. 69. Indeks dolny koniecPiosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Wydawnictwo UG, Gdańsk 2004, s. 69.
Przebieg reakcji można zapisać równaniem:
Rad jest pierwiastkiem promieniotwórczympierwiastkiem promieniotwórczym, występującym w przyrodzie w znikomych ilościach. Został odkryty przez Marię Curie‑Skłodowską i Piotra Curie, a ich odkrycie uhonorowano w 1903 r. nagrodą Nobla w dziedzinie fizyki. Maria Curie‑Skłodowska była pierwszą kobietą wyróżnioną tą nagrodą.
Jak doszło do odkrycia radu?
Jako surowiec do wyodrębnienia nowego pierwiastka, służyły naukowcom odpady blendy uranowej, które zostały sprowadzone (w ilości 10 ton) z kopalni uranu w czeskim Jachimkowie. W 1902 r., po 3 latach pracy, udało się wydzielić 10 miligramów radu i określić jego liczbę atomową (88).

Słownik
pierwiastki położone w drugiej grupie układu okresowego
samorzutny proces rozpadu elektrolitów (kwasów, zasad, soli) w roztworach na dodatnio i ujemnie naładowane cząstki, tj. jony
(gr. amphóteros „dwustronny”) właściwość niektórych związków chemicznych polegająca na ich zdolności do reakcji zarówno z kwasami, jak i z zasadami
zdolność zasady do uwalniania jonów wodorotlenkowych (w roztworze); moc zasad określa wartość stałej dysocjacji
pierwiastki, których atomy samorzutnie rozpadają się, emitując cząstki alfa, beta lub promienie gamma
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. 3, Warszawa 1987.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik, Warszawa 2002.
Hasssa R., Mrzigod A., Mrzigod J., Sułkowski., Chemia 2, Warszawa 2003.
Piosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Gdańsk 2004, s. 89.
Sołoniewicz R., Pierwiastki chemiczne grup głównych, Warszawa 1989, s. 199.
Trzebiatowski W., Chemia nieorganiczna, Warszawa 1977.
encyklopedia PWN





