Przeczytaj
Budowa i właściwości
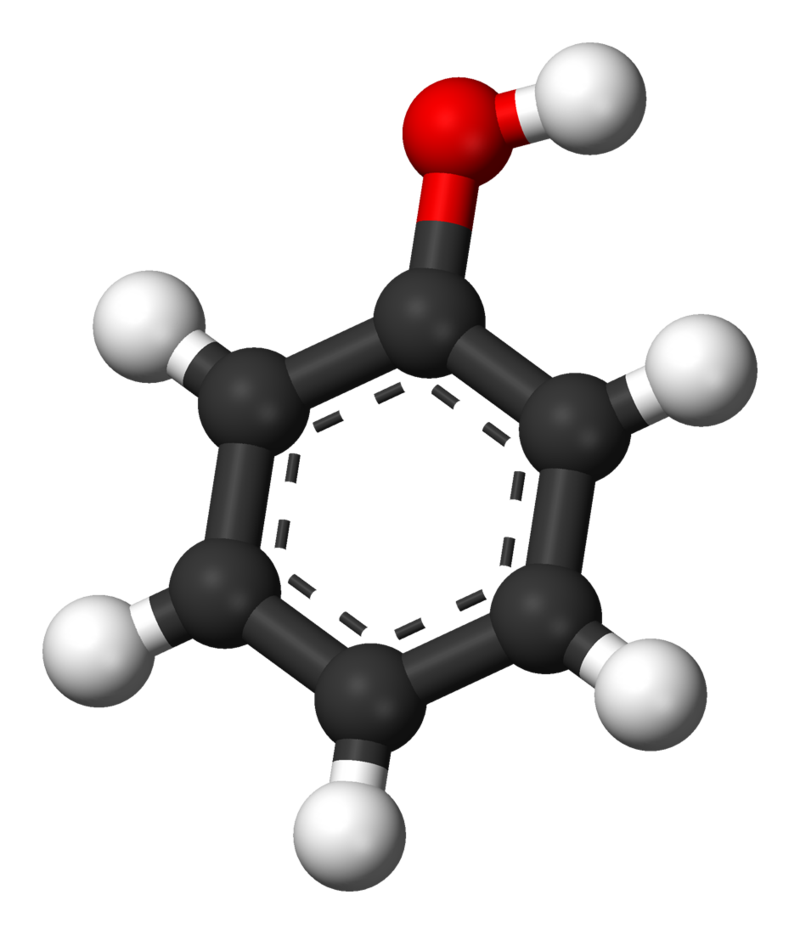
Fenole to związki, które zawierają – jako grupę funkcyjną – grupę hydroksylową , bezpośrednio związaną z atomem węgla w pierścieniu benzenowym. Najprostszym przedstawicielem tej grupy związków jest benzenol, którego nazwa zalecana to fenol, o wzorze .
W myśl teorii Brønsteda‑Lowry’ego, fenol pełni funkcję kwasu. Jest kwasem silniejszym od wody (, ), ale słabszym od kwasu węglowego ( ). Należy do elektrolitów słabych – tylko niewielki procent jego cząsteczek dysocjuje na jony, a reszta zostaje w roztworze w postaci niezdysocjowanej.
Przyczyna kwasowości fenolu
Właściwości kwasowe fenolu wynikają z obecności pierścienia aromatycznego w cząsteczce związku, który powoduje polaryzację wiązania między atomem tlenu a atomem wodoru w grupie hydroksylowej. Dochodzi do zmiany gęstości elektronowej, czyli przemieszczenia ładunku ujemnego atomu tlenu na sąsiadujący atom węgla w pierścieniu aromatycznym, co powoduje łatwiejsze oddanie protonu od cząsteczki fenolu. Skutkiem tego jest zwiększenie właściwości kwasowych fenolu i powstanie czterech możliwych struktur anionu fenoksylanowego (fenolanowego).
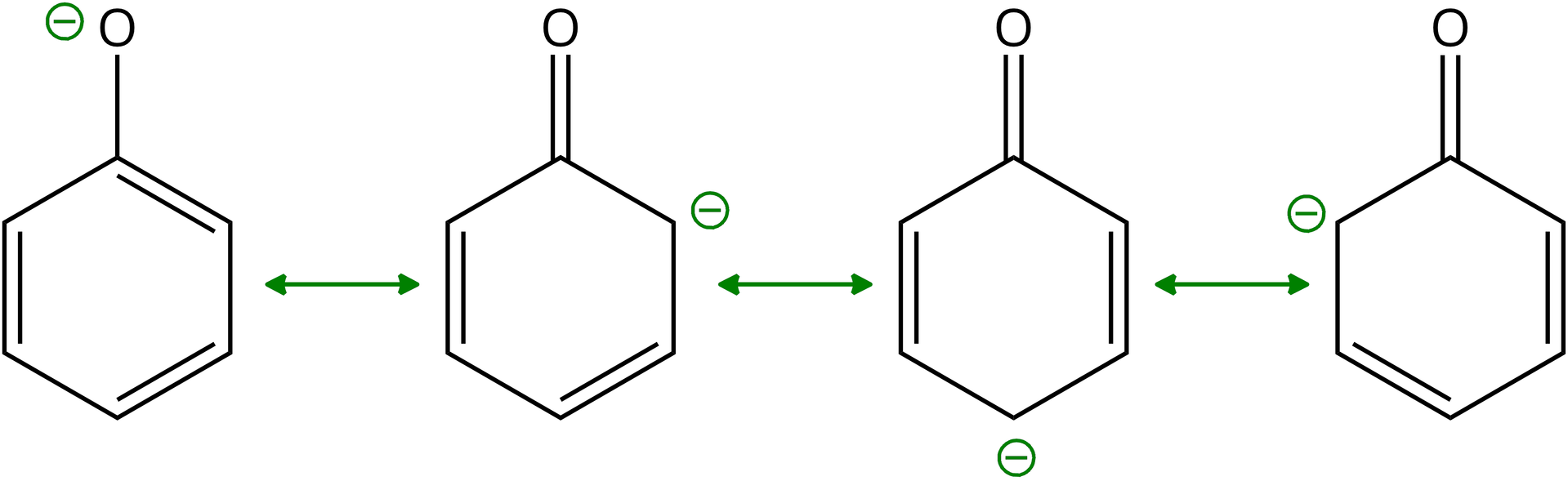
Poniżej został przedstawiony model anionu fenoksylanowego (fenolanowego) .

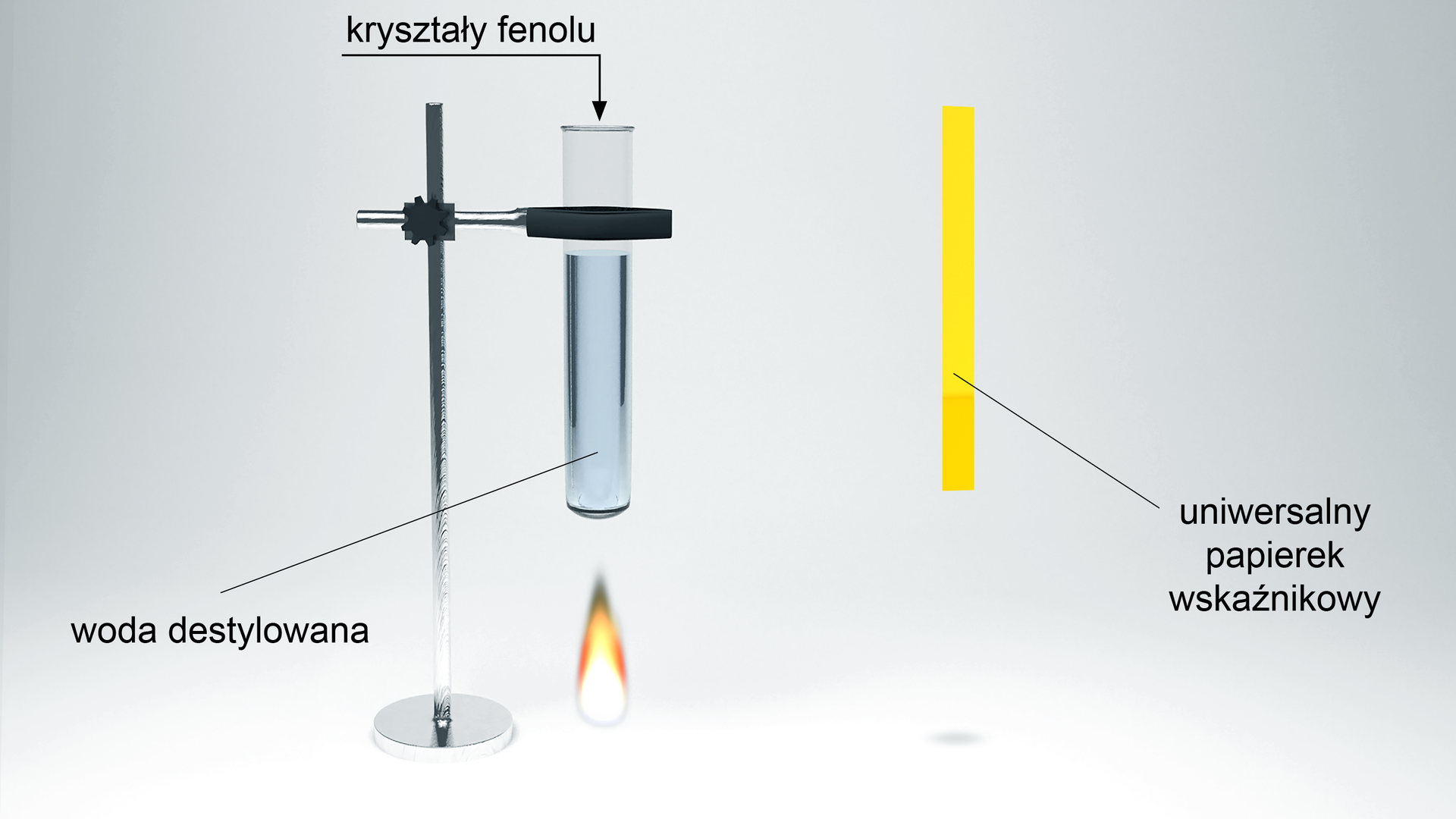
Przeprowadź eksperyment w laboratorium chemicznym. Zaproponuj hipotezę/hipotezy badawcze, którą/które możesz rozwiązać za pomocą zgromadzonego sprzętu i odczynników. Rozwiąż problem badawczy i zweryfikuj postawioną/postawione hipotezę/hipotezy. Zapisz obserwacje i wnioski.
Ważne:
Pamiętaj o zachowaniu środków ostrożności i wykonywaniu doświadczenia pod wyciągiem w okularach ochronnych. Przed przystąpieniem do pracy, zapoznaj się z kartami charakterystyk substancji użytych w doświadczeniu. W razie wątpliwości, skorzystaj z podpowiedzi do zadania.
Czy roztwór fenolu ulega dysocjacji elektrolitycznej?
● probówka;
● kilka kryształów fenolu;
● woda destylowana;
● uniwersalny papierek wskaźnikowy;
● palnik;
● szklany pręcik;
● cylinder;
● łapa drewniana.
Odpowiedź zapisz w zeszycie do lekcji chemii, zrób zdjęcie, a następnie umieść je w wyznaczonym polu.
Słownik
(łac. dissociatio „rozdzielenie”) rozpad cząsteczek substancji na jony pod wpływem rozpuszczalnika
cecha roztworu elektrolitu zależna od wzajemnego stosunku stężeń jonów i
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków, 2020.
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum - poziom podstawowy i rozszerzony, Warszawa - Bielsko‑Biała 2010.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, tłum. A. Dworak, Warszawa 2014.
McMurry J., Chemia organiczna, tom 1‑5, Warszawa 2000.
Morrison R.T., Boyd R.N., Chemia organiczna, tom 1 i 2, Warszawa 1997.
Vollhardt P., Schore N., Organic Chemistry. Sixth Edition. Structure and Function, New York 2011.