Przeczytaj
Jak bardzo aktywnym fluorowcem jest brom?
Brom znajduje się w grupie układu okresowego pierwiastków, wśród fluorowców. Reaktywność fluorowców maleje w dół grupy, dlatego też możemy zauważyć, że brom jest mniej reaktywny aniżeli fluor czy chlor, będąc jednocześnie bardziej reaktywnym od jodu.
Fluorowce mogą reagować z metalami, tworząc odpowiednie sole. Dla fluoru będą to fluorki, dla chloru - chlorki, dla jodu - jodki, a dla bromu - bromki. Zmniejszenie reaktywności pierwiastków spowodowane jest zwiększaniem się promienia atomowego ich atomów. Wraz ze wzrastającym promieniem atomowym maleje również elektroujemność, a więc zdolność atomów fluorowców do przyciągania elektronów.
Reakcje bromu z metalami pierwszej i drugiej grupy układu okresowego
Brom reaguje z metalami pierwszej i drugiej grupy układu okresowego, tworząc odpowiednie bromki. W związkach tych dominuje jonowy charakter wiązania, co wynika z różnicy elektroujemności atomu bromu i atomów odpowiednich metali. Reakcje te zachodzą samorzutnie (w przypadku na przykład potasu, reakcja jest dość gwałtowna i może grozić wybuchem).
Wyjaśnijmy to na przykładzie:
Zapisz równanie reakcji zachodzącej pomiędzy bromem a sodem.
Jak łatwo zauważyć, w reakcji bromu z metalami następują zmiany stopni utlenienia atomów, dlatego też reakcje bromu z metalami są reakcjami utleniania‑redukcji (redoks). Brom pełni w tych reakcjach rolę utleniacza, jednocześnie redukując się do stopnia utlenienia.
Bromek sodu był wykorzystywany jako lek nasenny i uspokajający. Stanowił także składnik leku o nazwie Bromo-Seltzer, popularnego w latach 60 ubiegłego stulecia. Swoją popularność zyskał głównie jako antidotum na zatrucie alkoholowe. W 1975 roku został wycofany ze sprzedaży ze względu na swoją szkodliwość.
Reakcja bromu z metalami drugiej grupy układu okresowego zachodzi analogicznie do reakcji z metalami pierwszej grupy. Ogólne równanie analizowanej reakcji można zapisać jako:
gdzie () jest symbolem metalu drugiej grupy układu okresowego.
Wyjaśnijmy to na przykładzie:
Zapisz równanie reakcji zachodzącej pomiędzy bromem a magnezem. Nazwij produkt.
Reakcje bromu z metalami szlachetnymi
Reaktywność bromu pozwala na otrzymanie bromków metali szlachetnychmetali szlachetnych (takich jak na przykład bromek platyny, palladu czy miedzi) w bezpośredniej syntezie z pierwiastków.
Zapisz równanie reakcji zachodzącej pomiędzy miedzią a bromem. Nazwij produkt.
Równania reakcji bromu z innymi metalami
Brom może reagować również z innymi metalami, takimi jak na przykład żelazo. Żelazo w związkach może przyjmować różne stopie utlenienia – najczęściej i . Ze względu na wysoce utleniające właściwości bromu, w wyniku reakcji bromu z żelazem, otrzymuje się bromek żelaza na wyższym stopniu utlenienia, a więc bromek żelaza().
Nazwa produktu: bromek żelaza()
Brom reaguje również z metalami bloku p, na przykład z glinem. Reakcja ta zachodzi samorzutnie i jest bardzo gwałtowna. W wyniku reakcji bromu z glinem powstaje bromek glinu:
Na poziomie szkolnym dopuszcza się uproszczony zapis wzoru sumarycznego bromku glinu – .
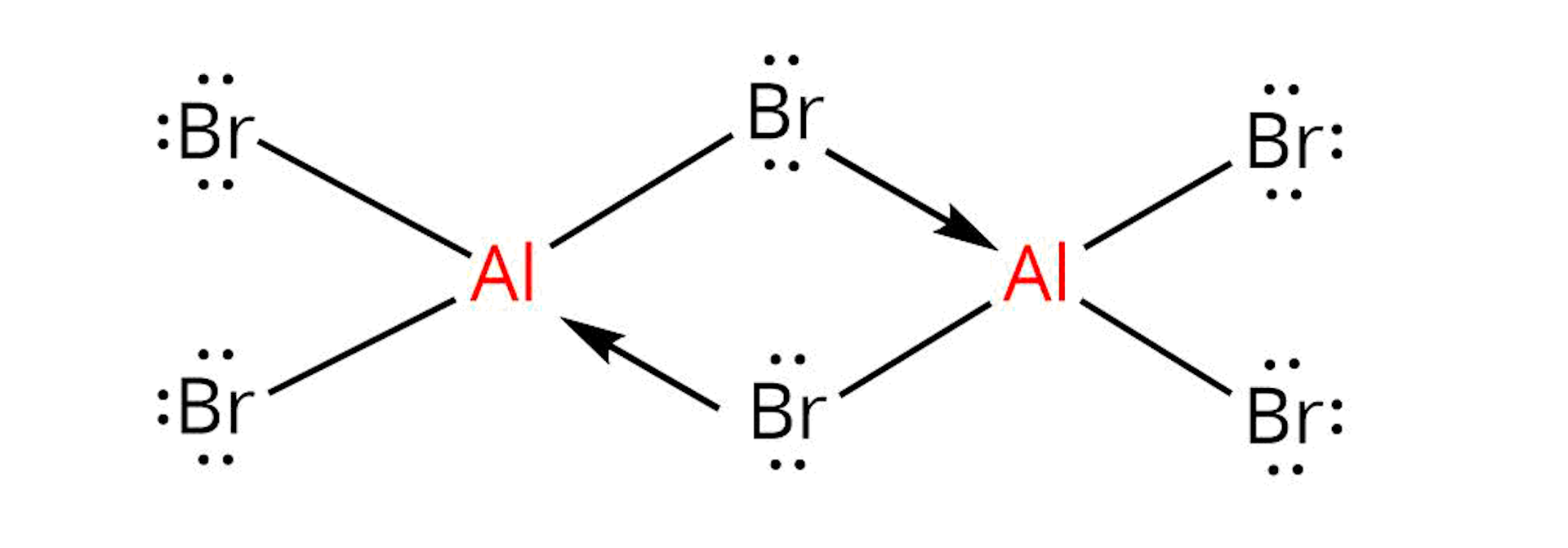
Uwaga: Bromek glinu tworzy dimer.
W stanie stałym bromek glinu występuje w postaci dimeru. Dwa atomy bromu są ligandami mostkującymi. Jedna z wolnych par elektronowych z atomu bromu jednej cząsteczki, tworzy wiązanie koordynacyjne z atomem glinu drugiej cząsteczki i odwrotnie.
Podsumowanie
Brom zaliczany jest do fluorowców. Wykazuje podobieństwo w reaktywności do pozostałych pierwiastków tej grupy. Ma właściwości utleniające, przez co może reagować z metalami, tworząc związki o charakterze soli – bromki.
Słownik
zwyczajowa nazwa metali mających dodatni standardowy potencjał elektrochemiczny; zalicza się do nich: ruten, rod, pallad, platynę, osm, iryd, srebro i złoto
Bibliografia
Atkins, P., Jones, L., Laverman L., Chemical Principles, 7th Edition, New York 2016.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2012.
Greenwood N. N.,Earnshaw A., Chemistry of the Elements, 2nd Edition, Oksford 1997.
Housecroft C. E., Inorganic Chemistry, New Jersey 2005.