Przeczytaj
W laboratorium wodór można otrzymać na kilka sposobów.
Reakcje chemiczne metali aktywnych z wodą
Wszystkie metale grupy układu okresowego (litowce) reagują z wodą roztwarzając się, w wyniku czego powstają wodorotlenki metali i wodór. Przykładowo sód reaguje z wodą, zgodnie z równaniem reakcji:
forma cząsteczkowa:
forma jonowa:
Metale grupy układu okresowego (berylowce) również reagują z wodą (beryl może reagować z wodą dopiero w specyficznych warunkach, w bardzo wysokich temperaturach) roztwarzając się, w wyniku czego powstają, podobnie jak w przypadku metali grupy, odpowiednie wodorotlenki i wodór. Przykładowo wapń reaguje z wodą, zgodnie z równaniem reakcji:
forma cząsteczkowa:
forma jonowa:
Magnez jest berylowcem, który z zimną wodą reaguje bardzo powoli, jednak reakcja przyspiesza zdecydowanie po ogrzaniu układu. Reakcja przebiega wówczas zgodnie z równaniem:
forma cząsteczkowa:
forma jonowa:
Oba uzyskane w reakcjach wodorotlenki – wodorotlenek wapnia i wodorotlenek magnezu, są trudno rozpuszczalne w wodzie. Tylko początkowo w reakcji obserwuje się powstawanie klarownych, bezbarwnych roztworów. Po przekroczeniu wartości iloczynów rozpuszczalności ( i ) zaczynają wytrącać się osady wodorotlenków wapnia i magnezu.
Większość innych metali aktywnych nie reaguje z wodą zimną lub podgrzaną do kilkudziesięciu stopni, ponieważ na powietrzu pokrywają się one warstewką własnego tlenku (ulegają pasywacji), która izoluje je od środowiska zewnętrznego i uniemożliwia reakcję z wodą. Reakcje niektórych z tych metali z wodą mogą jednak zachodzić po ich wprowadzeniu do gorącej pary wodnej (o temperaturze kilkuset stopni Celsjusza). Przykładowo żelazo metaliczne może reagować z parą wodną podgrzaną do temperatury ponad . Warstwa tlenkowa pojawia się także na powierzchni litowców czy berylowców. Jednak w tym przypadku tlenki te są na tyle aktywne chemicznie, że reagują z wodą, tworząc wodorotlenki, więc sama warstwa tlenku nie jest tutaj ochroną dla metalu.
Elektroda | Elektroda | ||
Reakcje metali z kwasami nieutleniającymi
Metale posiadające ujemny potencjał oksydacyjno–redukcyjny reagują z kwasami nieutleniającymi (np. kwasem chlorowodorowym i kwasem siarkowym() rozcieńczonym), w wyniku czego powstają odpowiednie sole i wodór. Przykładowo cynk reaguje z kwasem chlorowodorowym (solnym), zgodnie z równaniem reakcji:
forma cząsteczkowa:
forma jonowa skrócona:
Cynk reaguje także z rozcieńczonym kwasem siarkowym(), zgodnie z równaniem reakcji:
forma cząsteczkowa:
forma jonowa skrócona:
Reakcje chemiczne glinu i cynku z mocnymi zasadami
Cynk reaguje z wodorotlenkiem sodu, w wyniku czego powstaje tetrahydroksocynkan sodu oraz wydziela się wodór. Równanie opisanej reakcji ma postać:
forma cząsteczkowa:
forma jonowa skrócona:
Glin reaguje z wodorotlenkiem sodu, w wyniku czego może powstać tetrahydroksoglinian sodu lub heksahydroksoglinian sodu oraz wydziela się wodór. Równanie reakcji powstania tetrahydroksoglinianu sodu:
forma cząsteczkowa:
forma jonowa skrócona:
Równanie reakcji powstania heksahydroksoglinianu sodu:
forma cząsteczkowa:
forma jonowa skrócona:
Reakcje chemiczne wodorków metali i grupy układu okresowego z wodą
Wodorki metali i grupy układu okresowego (wodorki litowców i berylowców), w wyniku reakcji z wodą tworzą odpowiednie wodorotlenki i wodór. Przykładowo wodorek sodu reaguje z wodą, zgodnie z równaniem reakcji:
forma cząsteczkowa:
forma jonowa:
Wodorek baru także reaguje z wodą, zgodnie z równaniem reakcji:
forma cząsteczkowa:
forma jonowa:
Elektroliza
W laboratorium wodór można otrzymać również w wyniku elektrolizyelektrolizy wody na elektrodach platynowych. Wodór wydziela się na katodzie w wyniku redukcji wody:
Na anodzie powstaje tlen w wyniku utleniania wody:
Sumaryczne równanie:
Jeśli elektrolizer będzie odpowiednio skonstruowany, tak aby produkt katodowy nie mieszał się z anodowym, istnieje możliwość otrzymywania wodoru o wysokiej czystości. Cel ten udało się osiągnąć w aparacie Hofmannaaparacie Hofmanna, czyli aparacie do elektrolizy wody.
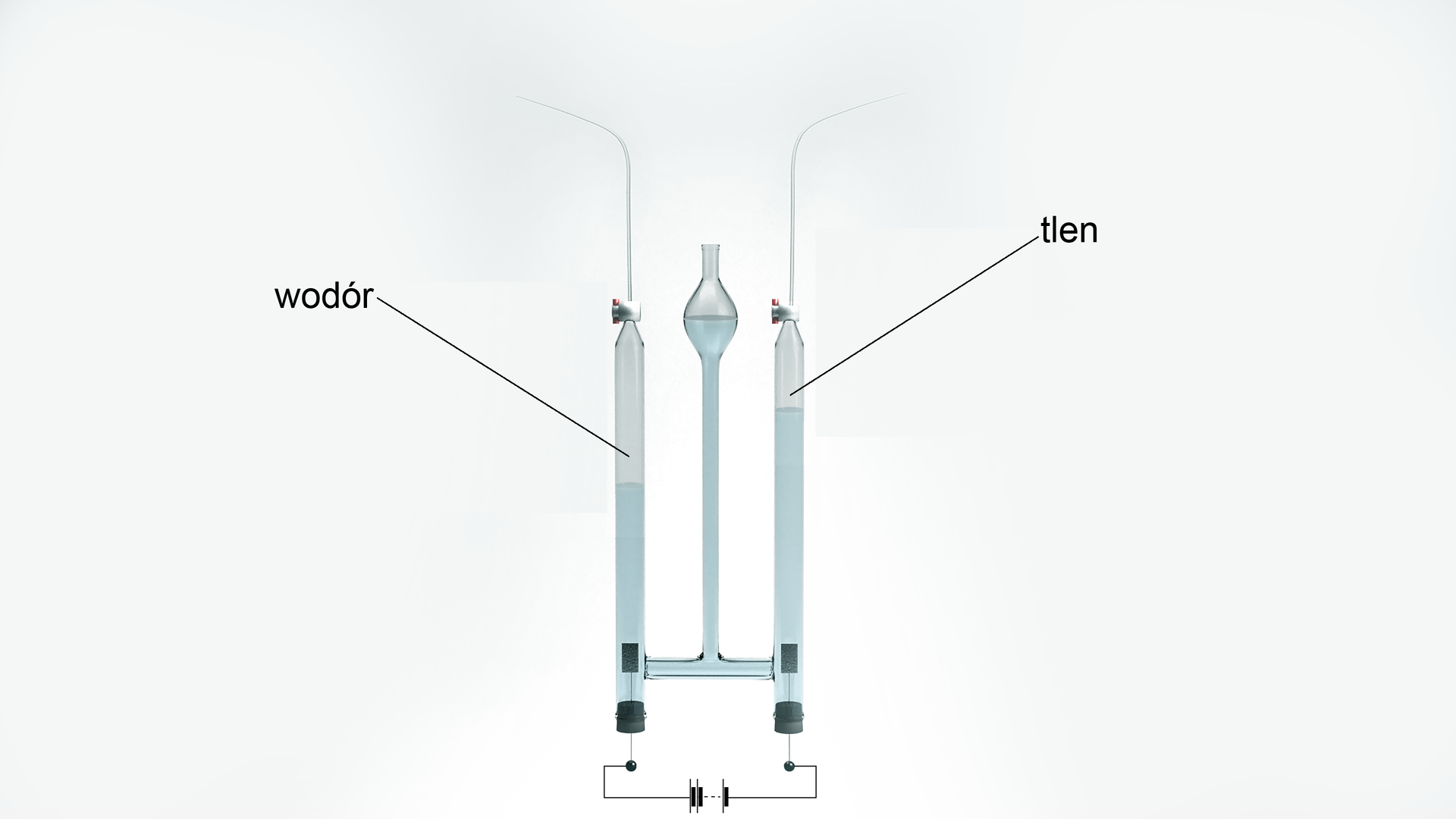
W środkowym cylindrze znajduje się woda i substancja zwiększająca przewodnictwoprzewodnictwo (np. kwas siarkowy() lub siarczan() sodu). Do źródła prądu podłączone są dwie elektrody platynowe. Po podłączeniu napięcia do aparatu, na anodzie powstaje tlen, natomiast na katodzie – wodór. Otrzymywane gazy zbierane są na szczytach cylindrów poprzez wypieranie wody.
Skala przemysłowa
W przemyśle wodór otrzymuje się głównie za pomocą konwersjikonwersji węglowodorów z parą wodną. Źródłem węglowodorów najczęściej jest gaz ziemny, a jego główny składnik to metan. Po zmieszaniu metanu z parą wodną, w temperaturze 1025 K i pod wpływem katalizatora niklowego, zachodzą reakcje, które można opisać za pomocą poniższych równań:
Dawniej bardzo często wodór otrzymywano poprzez wprowadzenie pary wodnej na rozżarzony koks w temperaturze , w wyniku czego zachodziła reakcja:
Powstająca w powyższych reakcjach mieszanina tlenku węgla() i wodoru nazywana jest gazem wodnym (syntezowym). Jest to paliwo posiadające wysoką wartość opałowąwartość opałową, używane do ogrzewania instalacji przemysłowych.
Wodór w laboratorium należy zbierać w probówce obróconej dnem do góry, ponieważ jako gaz lekki, o małej gęstości (w gęstość wodoru wynosi ), mniejszej od powietrza , będzie szybko unosić się. Wodór, zależnie od potrzeby, może być zbierany również w probówce wypełnionej wodą, odwróconej do góry dnem i umieszczonej w naczyniu z wodą. Wodór jest bowiem gazem, który bardzo słabo rozpuszcza się w wodzie. Jest także bezbarwny, bezwonny i palny.

Słownik
(gr. ḗlektron „bursztyn”, lýsis „rozłożenie”) – podstawowy proces elektrochemiczny polegający na chemicznej przemianie składników elektrolitu (a często i materiału elektrod), przebiegającej na elektrodach pod wpływem przepływu prądu elektrycznego
(eudiometr Hofmanna) – aparat służący do przeprowadzenia elektrolizy wody, który został wynaleziony w roku przez Augusta Wilhelma von Hofmanna
zjawisko przepływu prądu elektrycznego przez ośrodek pod wpływem zewnętrznego pola elektrycznego
(łac. conversio „odwrócenie”) określenie przemian chemicznych prowadzonych, np. w celu otrzymania gazu syntezowego, który powstaje w wyniku konwersji lekkich węglowodorów z parą wodną; znana jest także konwersja tlenku węgla() z parą wodną
stosunek ciepła uzyskanego ze spalenia paliwa do masy lub objętości tego paliwa
mieszanina gazów, głównie wodoru () i tlenku węgla() (), stosowana do syntez związków organicznych
Bibliografia
Bielański A., Podstawy chemii nieorganicznej 2, Warszawa 2013.
Litwin M., Styka–Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2015.
Encyklopedia PWN