Przeczytaj
Otrzymywanie soli w wyniku reakcji kwasów z tlenkami
Równania reakcji kwasów z tlenkami zasadowymi i amfoterycznymi, które prowadzą do otrzymania soli, przebiegają następująco:
Reakcja kwasu z tlenkami zasadowymi
Tlenki zasadowe to substancje, które, w reakcji z kwasami, dają sole, natomiast nie reagują z zasadami. Do grupy tlenków zasadowych zaliczamy tlenki metali I i II grupy, z wyjątkiem tlenku berylu, oraz dodatkowo niektóre tlenki metali przejściowych, np. i . Poniżej przedstawiono opis doświadczenia kwasu z tlenkiem zasadowym.
Problem badawczy: czy tlenek zasadowy będzie reagował z kwasem, tworząc sól?
Hipoteza: tlenek zasadowy będzie reagował z kwasem, tworząc sól.
Sprzęt i odczynniki:
probówki, mała łyżeczka;
roztwory substancji: rozcieńczony kwas chlorowodorowy, tlenek magnezu.
Wykonanie:
Umieść w probówce 2 cmIndeks górny 33 kwasu chlorowodorowego.
Za pomocą łyżeczki dodawaj małymi porcjami tlenek magnezu.
Obserwuj zawartość probówki.
Schemat doświadczenia:
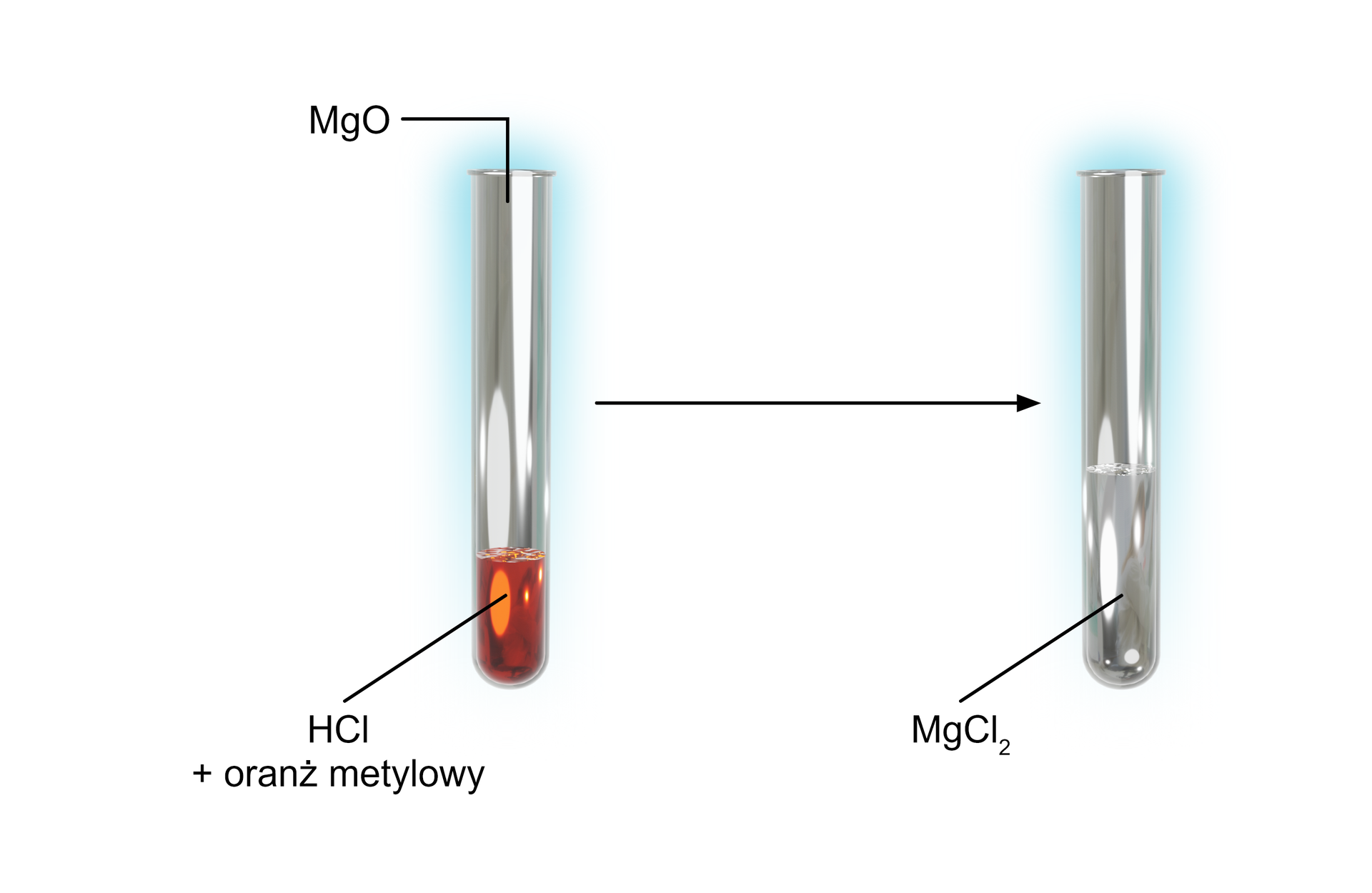
Obserwacje:
Po dodaniu do kwasu chlorowodorowego stałego tlenku magnezu, tlenek się roztworzył. Roztwór zmienił barwę z czerwonej na pomarańczową. Powstała sól, chlorek magnezu oraz woda.
Użycie wskaźnika kwasowo‑zasadowego, w przypadku doświadczeń z użyciem tlenków reagujących z wodą, jest konieczne, bowiem jednym ze składników kwasu solnego, a więc wodnego roztworu chlorowodoru, jest woda. Zatem zaobserwowane roztwarzanie nie jest wystarczającym dowodem na zachodzenie reakcji z kwasem. Przykładowo, (stały tlenek niemetalu), choć nie reaguje z , dodany do probówki z kwasem solnym ulegnie roztworzeniu, ponieważ reaguje z zawartą w niej wodą, tworząc .
Wnioski:
Powyższe doświadczenie wykazało, że kwasy mogą reagować z tlenkami zasadowymi. W wyniku tej reakcji powstała sól i woda.
Równania reakcji:
Zapis cząsteczkowy reakcji:
Zapis jonowy reakcjiZapis jonowy reakcji:
Zapis jonowy skróconyZapis jonowy skrócony:
Oczywiście analogiczne zapisy z użyciem kationów wodoru () w miejscu jonów oksoniowych () są równie poprawne.
Reakcja kwasu z tlenkami amfoterycznymi
Do grupy tlenków amfoterycznych można zaliczyć m.in. tlenek glinu , tlenek cynku oraz np. tlenek chromu(III) . Poniżej przedstawiono doświadczenie kwasu z tlenkiem amfoterycznym.
Problem badawczy: czy tlenek amfoteryczny będzie reagował z kwasem, tworząc sól?
Hipoteza: tlenek amfoteryczny będzie reagował z kwasem, tworząc przy tym sól.
Sprzęt i odczynniki:
probówki, mała łyżeczka;
roztwory substancji: rozcieńczony kwas chlorowodorowy, tlenek glinu.
Wykonanie:
Umieść w probówce 2 cmIndeks górny 33 kwasu chlorowodorowego.
Za pomocą łyżeczki dodawaj, małymi porcjami, tlenek glinu.
Obserwuj zawartość probówki.
Schemat doświadczenia:
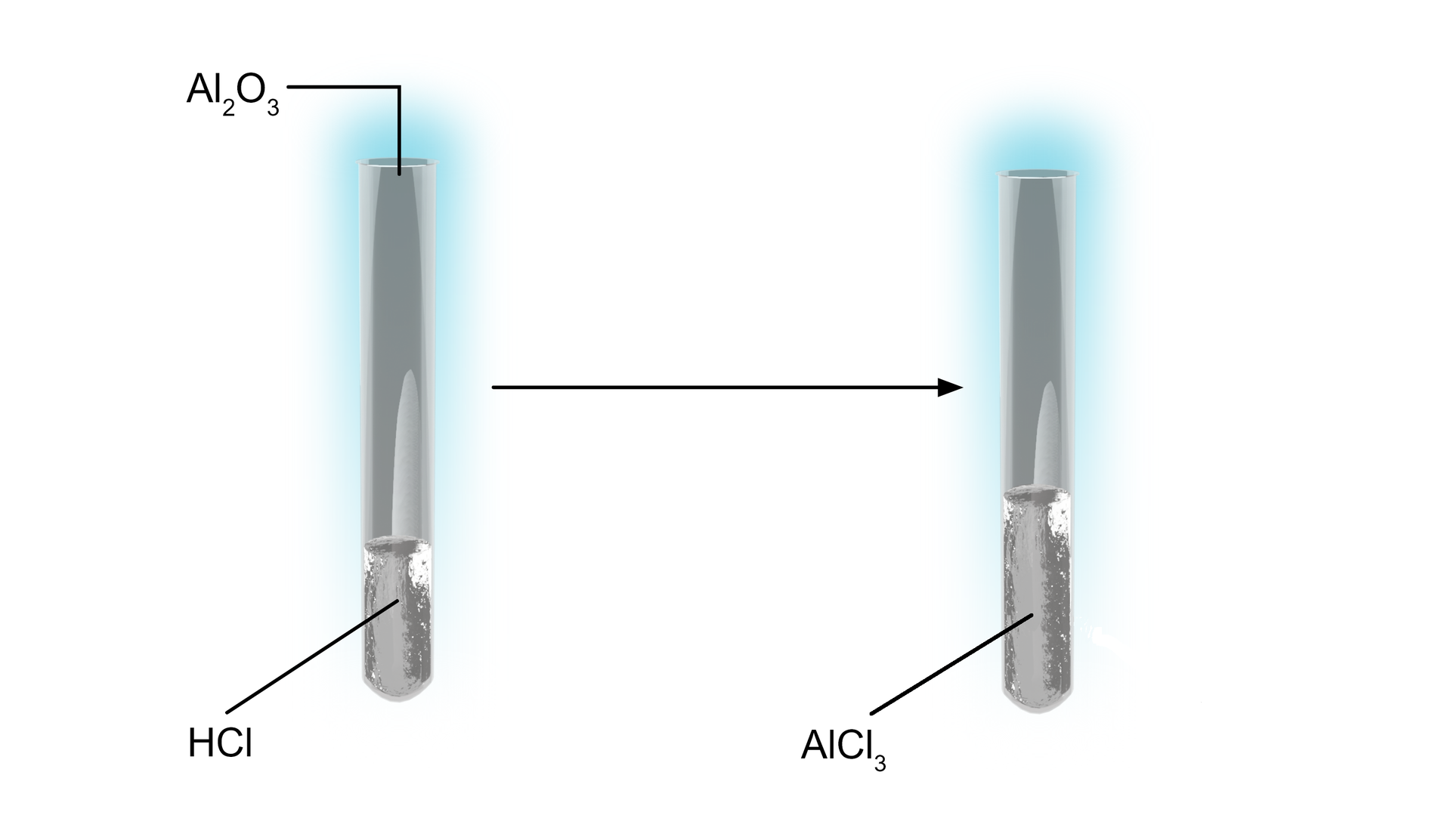
Obserwacje:
Po dodaniu do kwasu chlorowodorowego stałego tlenku glinu, tlenek się roztworzył. Powstała sól, chlorek glinu oraz woda.
W tym doświadczeniu użycie wskaźnika kwasowo‑zasadowego nie jest potrzebne, a wręcz nie przyniesie upragnionego efektu. Wodny roztwór powstałej soli – chlorku glinu – ma odczyn kwasowy, podobnie jak kwas chlorowodorowy. Należy jednak zauważyć, że chociaż tlenki amfoteryczne nie reagują z wodą, to sam proces roztwarzania się w kwasie świadczy o zachodzącej reakcji pomiędzy tlenkiem amfoterycznym a kwasem, w tym wypadku chlorowodorowym.
Wnioski:
To z kolei doświadczenie wykazało, że kwasy reagują z tlenkami amfoterycznymi. W wyniku tej reakcji powstaje sól i woda.
Równania reakcji chemicznej:
Zapis cząsteczkowy równania reakcji:
Zapis jonowy równania reakcji:
Zapis jonowy skrócony:
Oczywiście użycie jonów w miejsce jonów jest jak najbardziej poprawne.
Kwasy dysocjują na jony oraz aniony reszty kwasowej, natomiast tlenki to związki tlenu z innymi pierwiastkami chemicznymi, w których atom tlenu występuje na -II stopniu utlenienia. W wyniku reakcji kwasu z większością tlenków zasadowych i amfoterycznych otrzymuje się sól oraz wodę. Sól powstaje z kationu, który pochodzi od tlenku metalu i anionu reszty kwasowej.
Słownik
(gr. amphoteros „dwustronny”) zdolność związku chemicznego do reakcji zarówno z kwasami, jak i zasadami
mogą reagować zarówno z zasadami, jak i z kwasami
rozpad substancji chemicznej na jony dodatnie i ujemne pod wpływem rozpuszczalnika (na przykład wody)
zapis równania reakcji chemicznej zachodzącej w roztworze wodnym; przedstawia substraty i produkty rozpuszczalne w wodzie w postaci jonów
zapis równania reakcji chemicznej zachodzącej w roztworze wodnym, gdzie przedstawione są jedynie substancje i jony, które biorą udział w reakcji
Bibliografia
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2020.
Pac B., Zegar A., Reakcje w roztworach wodnych w teorii i zadaniach, Kraków 2020.