Przeczytaj
Struktura cząsteczki benzenu
Najprostszym, a zarazem najistotniejszym przedstawicielem węglowodorów aromatycznychwęglowodorów aromatycznych (arenów) jest benzen o wzorze sumarycznym . Na jeden atom węgla w cząsteczce benzenu przypada jeden atom wodoru. Jak zatem rozmieszczone są te atomy w cząsteczce benzenu?
Przez wiele lat chemicy próbowali ustalić strukturę cząsteczki benzenu. Z jednej strony skład cząsteczki wskazywał na nienasycony charakter związku, z drugiej właściwości chemiczne benzenu świadczyły o tym, że reaguje on jak związek nasycony. Rozwiązanie zaproponował August Kekulé. Stwierdził, że cząsteczka benzenu ma strukturę pierścienia, w którym atomy węgla łączą się ze sobą naprzemiennie wiązaniami pojedynczymi i podwójnymi, a każdy atom węgla dodatkowo tworzy jedno wiązanie z atomem wodoru. Według teorii Kekulégo struktura cząsteczki benzenu jest dynamiczna. Wiązania pojedyncze i podwójne między atomami węgla przemieszczają się w cząsteczce, tworząc dwie struktury rezonansowe:

Można to przedstawić prościej, za pomocą wzorów szkieletowych:
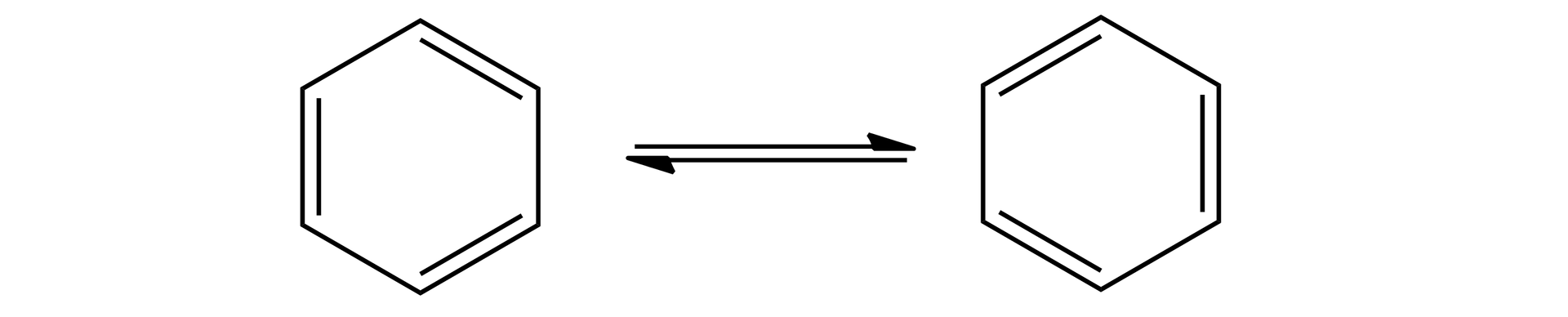
Wielu naukowców nie zgadzało się na taki wzór benzenu. Sugerował on, że ów pierwiastek łatwo ulega reakcjom addycji, co w rzeczywistości nie jest prawdą. Szczegółowe badania wykazały, że cząsteczka benzenu jest płaska, a tworzące ją atomy węgla i wodoru tworzą sześciokąty foremne. Kąty między wszystkimi wiązaniami wynoszą po . Wiązania między atomami węgla mają taką samą długość, czyli , co czyni je dłuższymi od wiązań podwójnych i krótszymi od pojedynczych.
Okazuje się, że walencyjne orbitale atomu węgla są w stanie **hybrydyzacji , która wyjaśnia płaską budowę pierścienia benzenu. Dwa orbitale zhybrydyzowane każdego atomu węgla wykorzystywane są do tworzenia wiązań sigma z dwoma sąsiednimi atomami węgla. Wiązanie z atomem wodoru powstaje z udziałem trzeciego zhybrydyzowanego orbitalu. Te orbitale atomowe, które nie biorą udziału w hybrydyzacji p, są prostopadłe do płaszczyzny pierścienia. W związku z tym właściwości tej cząsteczki można lepiej opisać przy użyciu wielocentrowych orbitali molekularnych . Powstaje wiązanie zdelokalizowanewiązanie zdelokalizowane, tworzone przez wszystkie sześć równomiernie rozłożone elektrony, pochodzące od sześciu atomów węgla w pierścieniu. Takie wiązanie jest typowe dla wszystkich związków aromatycznych.
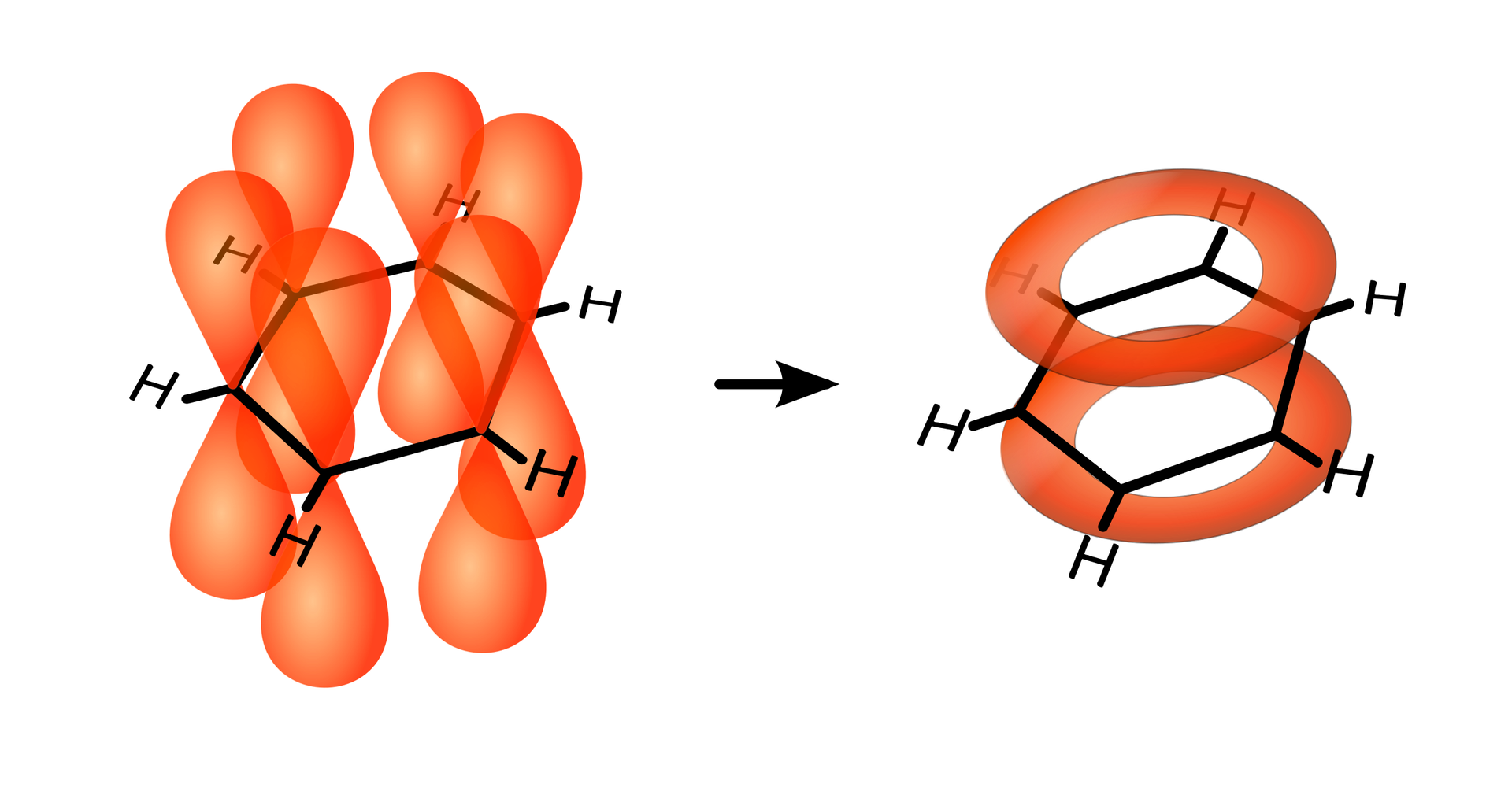
Delokalizację elektronów można przedstawić w sposób graficzny jako okrąg wpisany w pierścień benzenu. Jest to wzór uproszczony:
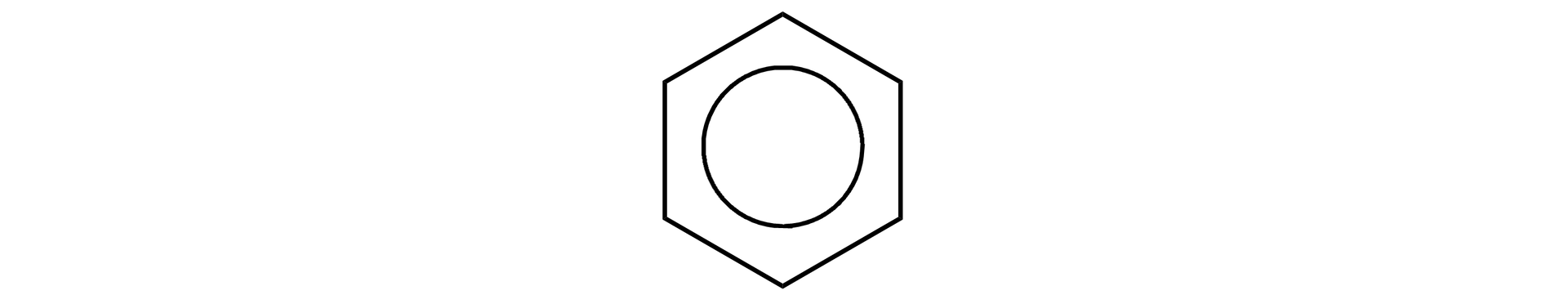
Warto pamiętać, że IUPAC zaleca stosowanie wzorów Kekulégo, pamiętając o ich umownym charakterze.
Reguła Hückla
Związki aromatycznearomatyczne, biorące swoją nazwę od aromatycznych olejków, z których wiele z nich zostało wyizolowanych, mają pewne cechy charakterystyczne. Ich cząsteczki o budowie cyklicznej są płaskie i posiadają zdelokalizowane elektrony . Jednak nie każda cząsteczka mająca zdelokalizowane elektrony jest aromatyczna. Jak to stwierdzić? Z pomocą przychodzi niemiecki naukowiec Erich Hückel. Reguła HücklaReguła Hückla mówi, że cząsteczkę uznaje się za aromatyczną, gdy posiada zdelokalizowanych elektronów ( – liczba naturalna, ; często utożsamiana z liczbą pierścieni w cząsteczce). A zatem cząsteczki związków aromatycznych posiadają np. dwa lub sześć elektronów . Związki chemiczne, które posiadają wiązania zdelokalizowane, wyróżniają się dużą trwałością.

Szereg homologiczny benzenu
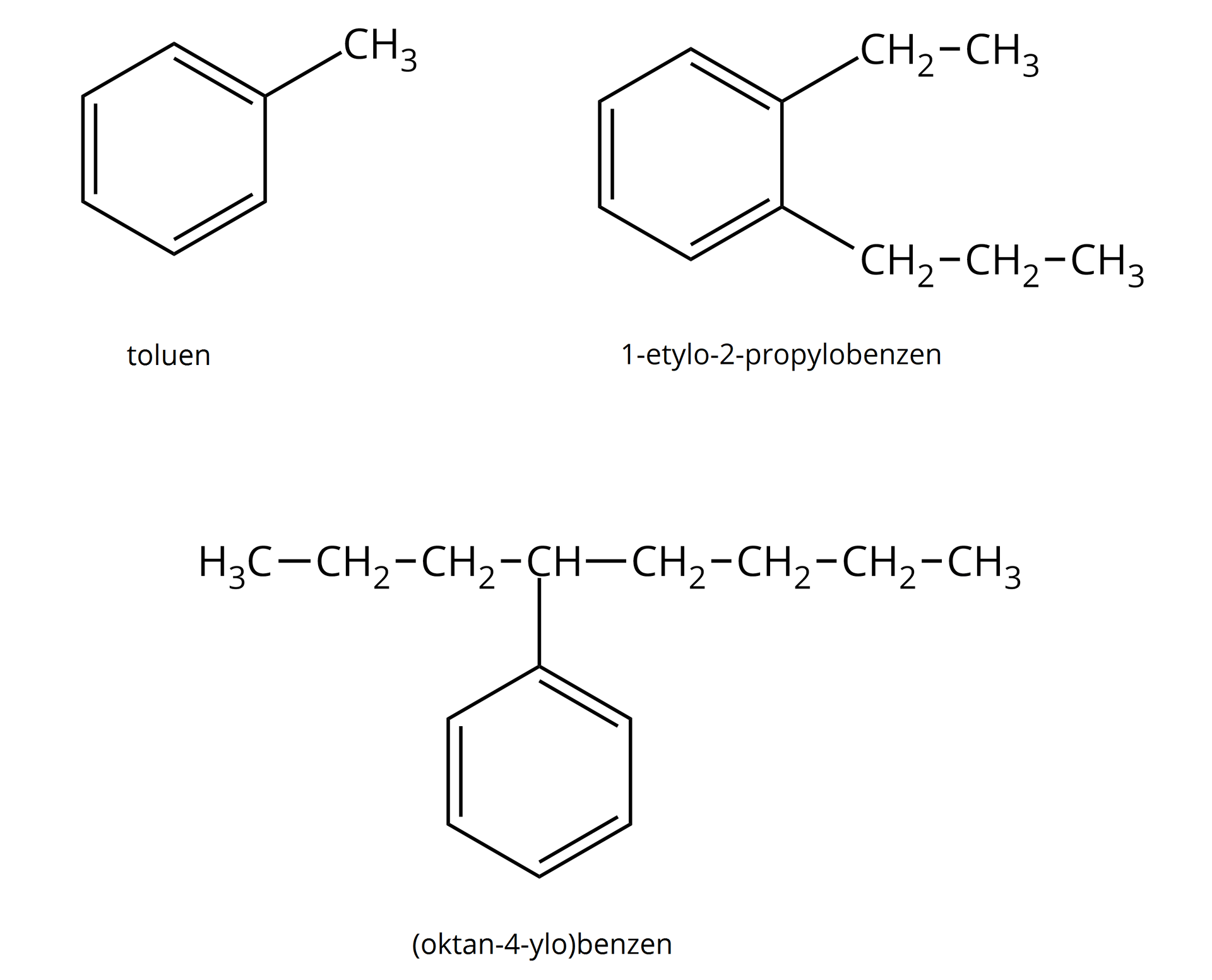
Zgodnie ze znaną definicją homologów, jako związków należących do tego samego szeregu homologicznego, które różnią się o grupę lub jej wielokrotność, z łatwością możemy stwierdzić, że najprostszym homologiem benzenu jest toluen o wzorze sumarycznym . Odpowiadają mu już cztery izomery.
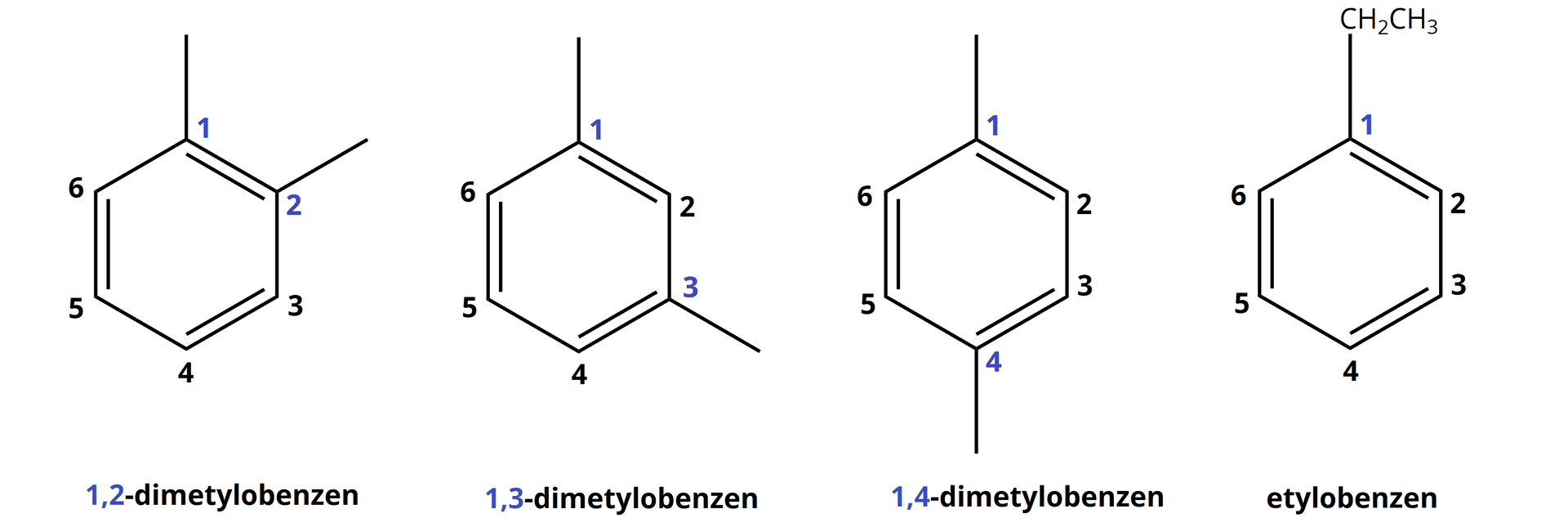
Wzory niektórych homologów benzenu oraz ich nazwy zostały przedstawione poniżej. Należy podkreślić, że bez względu na długość podstawnika alkilowego podłączonego do benzenu, to pierścień aromatyczny zawsze stanowi łańcuch główny.
Zapach nowego samochodu

Lotne związki organiczne (LZO) stanowią grupę zanieczyszczeń powietrza, które cechuje łatwość przechodzenia w stan gazowy w temperaturze pokojowej i przy ciśnieniu atmosferycznym. Około różnych LZO wykryto we wnętrzach nowych samochodów. Wiele z nich przyczynia się do „zapachu nowości” samochodu. Skąd się tam wzięły LZO? Z zastosowanych w konstrukcji plastików, tapicerki czy smarów i benzyny. Najczęściej występującymi tam substancjami są związki z szeregu homologicznego benzenu oraz alkany. Stężenia LZO są bardzo niskie i z czasem związki te zostają wywietrzone z pojazdu, ale ich obecność może powodować bóle głowy czy reakcje alergiczne.

Reakcje charakterystyczne benzenu
Cząsteczki związków o budowie nienasyconej reagują z wodą bromową oraz roztworem manganianu() potasu. Obserwujemy wtedy odbarwienie tych odczynników, które świadczy o zajściu reakcji. Jak zachowa się benzen wobec wody bromowej?
Ze względu na obecność wiązań zdelokalizowanych i względną trwałość cząsteczki, nie wykazuje on charakteru nienasyconego. W jego przypadku nie zachodzi reakcja addycji bromu i odbarwienia wody bromowej ani zakwaszonego roztworu . Czy to znaczy, że benzen w ogóle nie jest w stanie reagować z bromem?
Oczywiście, że może. Benzen reaguje z w obecności katalizatora, (bromek żelaza()). Jest to reakcja substytucji elektrofilowej, w której produktami są bromobenzen i bromowodór . Poniżej przedstawiono równanie tej reakcji:
Bromek żelaza() umożliwia powstanie elektrofila – jonu .
Reakcję bromowania benzenu można przedstawić w następujący sposób:
Reakcję tę można zapisać sumarycznie w następujący sposób:

Benzen – występowanie i zastosowanie
Benzen jest składnikiem dymu papierosowego, który może uszkadzać szpik kostny i obniżać liczbę erytrocytów we krwi. Występuje w ropie naftowej i smole węglowej. Powstaje też podczas erupcji wulkanów czy pożarów lasów oraz spalania paliw kopalnych. Stosunkowo duże stężenie benzenu występuje wciąż w okolicy stacji benzynowych, rafinerii i dróg o dużym natężeniu ruchu.
Związek ten znajduje szerokie zastosowanie jako rozpuszczalnik i substrat do syntezy organicznej. Benzen stanowi surowiec do syntezy leków oraz pestycydów. Z jego pochodnych można produkować materiały wybuchowe, np. trinitrobenzen (TNB) oraz barwniki. Wytwarza się z niego także tworzywa sztuczne i włókna syntetyczne. Jest wykorzystywany w przemyśle petrochemicznym jako środek przeciwstukowy, dodawany do benzyny w celu podniesienia jej liczby oktanowej.
Słownik
płaskie węglowodory cykliczne spełniające regułę Hückla
występowanie sprzężonego układu cyklicznego wiązań podwójnych, wykazujący zjawisko delokalizacji elektronów
reguła głosząca, że związkami aromatycznymi są związki posiadające elektronów zdelokalizowanych
wiązanie łączące więcej niż dwa atomy
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Karta charakterystyki substancji chemicznej – benzen, ChemPur 2004.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2014, wyd. 2.
Morrison R. T., Boyd R. N., tłum. Wiesław Antkowiak i in., Chemia organiczna, t. 1, Warszawa 2010, wyd. 5.
The aroma of new car, 2014, online: https://www.compoundchem.com/2014/06/16/newcarsmell/, dostęp: 04.06.2021.
The Chemistry of Petrol & The Tetraethyl Lead Story, 2016, online: https://www.compoundchem.com/2016/05/17/petrol/, dostęp: 04.06.2021.