Przeczytaj
Rodzaje mieszanin oraz ich właściwości
Mieszaniny to układy, w których wyróżnić możemy min. dwie różne fazy. W układach heterogenicznych, czyli mieszaninach niejednorodnych, fazy te jesteśmy w stanie dostrzec w sposób bezpośredni lub za pomocą prostych przyrządów optycznych. Układy homogeniczne stanowią z kolei mieszaniny jednorodne, których składniki po wymieszaniu tworzą jedną fazę i wtedy rozróżnienie ich gołym okiem lub przy użyciu dodatkowych urządzeń optycznych jest nieosiągalne.
Z uwagi na wielkość cząstek rozproszonych w mieszaninie, rozróżnia się trzy podstawowe rodzaje mieszanin:
roztwory właściweroztwory właściwe – roztwory rzeczywiste, w których średnica drobin/cząstek nie jest większa niż ();
koloidykoloidy (roztwory koloidalne) – w których średnica drobin/cząstek mieści się w przedziale wielkości ( a );
zawiesinyzawiesiny – w których średnica drobin/cząstek jest większa niż
().
Aby poprawnie sklasyfikować, z jakim typem mieszaniny/układu mamy do czynienia, można wykorzystać poniższą tabelę, opartą o wielkości cząstek tworzących daną mieszaninę.
Roztwór właściwy
Roztwór rzeczywisty to jednorodna mieszanina dwóch lub więcej substancji (układ homogeniczny). W takim roztworze najczęściej jeden ze składników tej mieszaniny występuje w większej ilości i wówczas nazywany jest rozpuszczalnikiem, a więc substancją służącą do rozpuszczenia innych składników (substancji rozpuszczonych). Pojęcie rozpuszczalnika niemal zawsze kojarzy nam się z wodą, a co za tym idzie – z roztworami wodnymi.
Należy jednak pamiętać, że każdy gaz, ciecz oraz ciało stałe również może spełniać funkcję rozpuszczalnika. I tak stopy metali mogą być roztworami danego metalu rozpuszczonego w innym metalu (np. mosiądz, brąz). Innym przykładem roztworu jest czyste powietrze, czyli gazowa oraz jednorodna mieszanina: azotu, tlenu, argonu, tlenku węgla() i kilku innych gazów.
Właściwości
Roztwór właściwy stanowi układ jednofazowy wieloskładnikowy. Jak w każdej mieszaninie, składniki zachowują swoje właściwości. Cechą tego roztworu jest jego elektroobojętność. W większości przypadków, roztwory właściwe są przezroczyste. Odznacza je za to wysoka trwałość oraz to, że nie rozpraszają światła. Ze względu na rozmiar tworzących je drobin, nie można ich rozdzielić za pomocą filtrowania.
Otrzymywanie
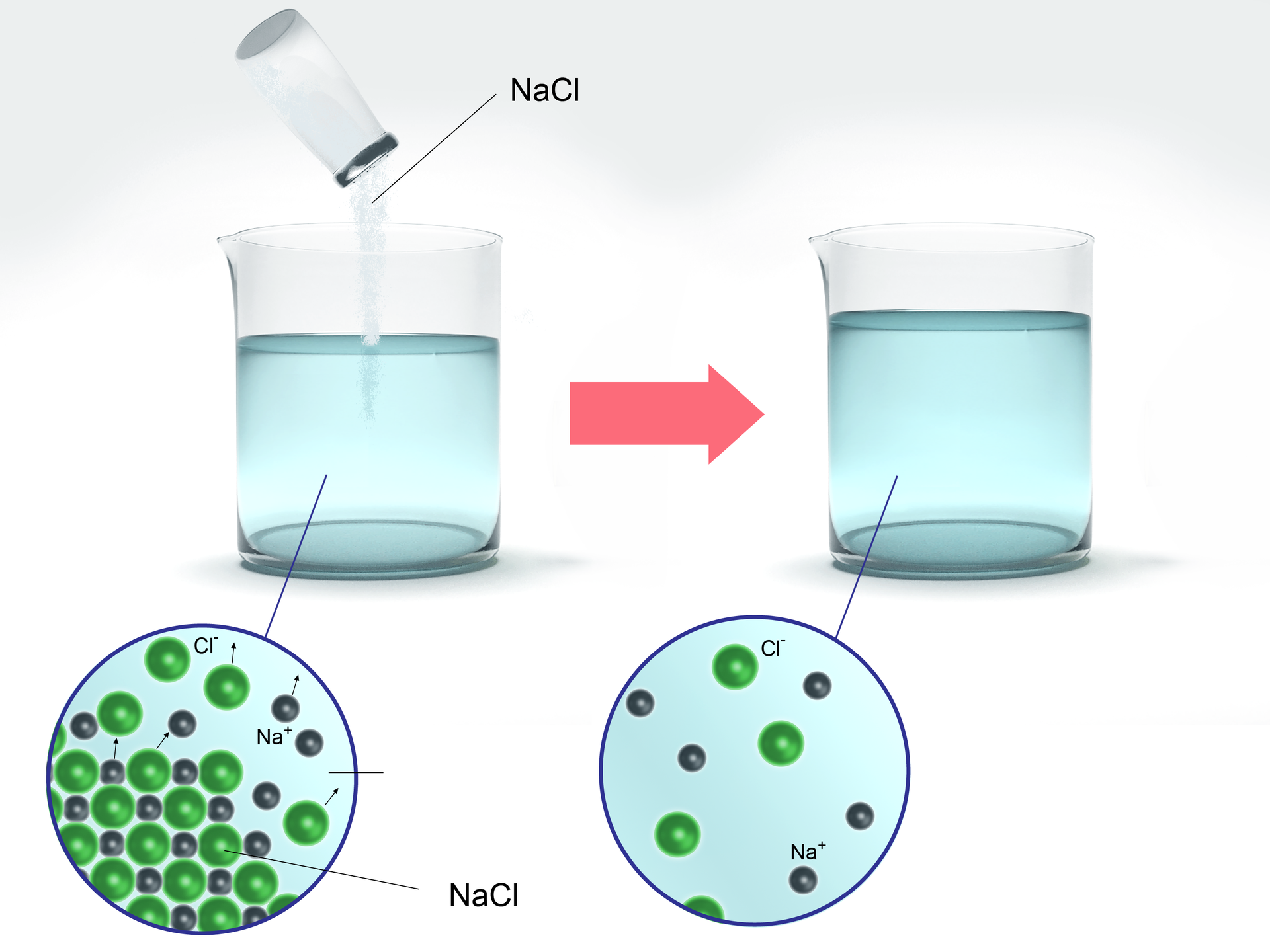
Roztwory właściwe można otrzymać np. poprzez rozpuszczenie substancji stałej w wodzie. Przykładem popularnego roztworu rzeczywistego jest wodny roztwór chlorku sodu.
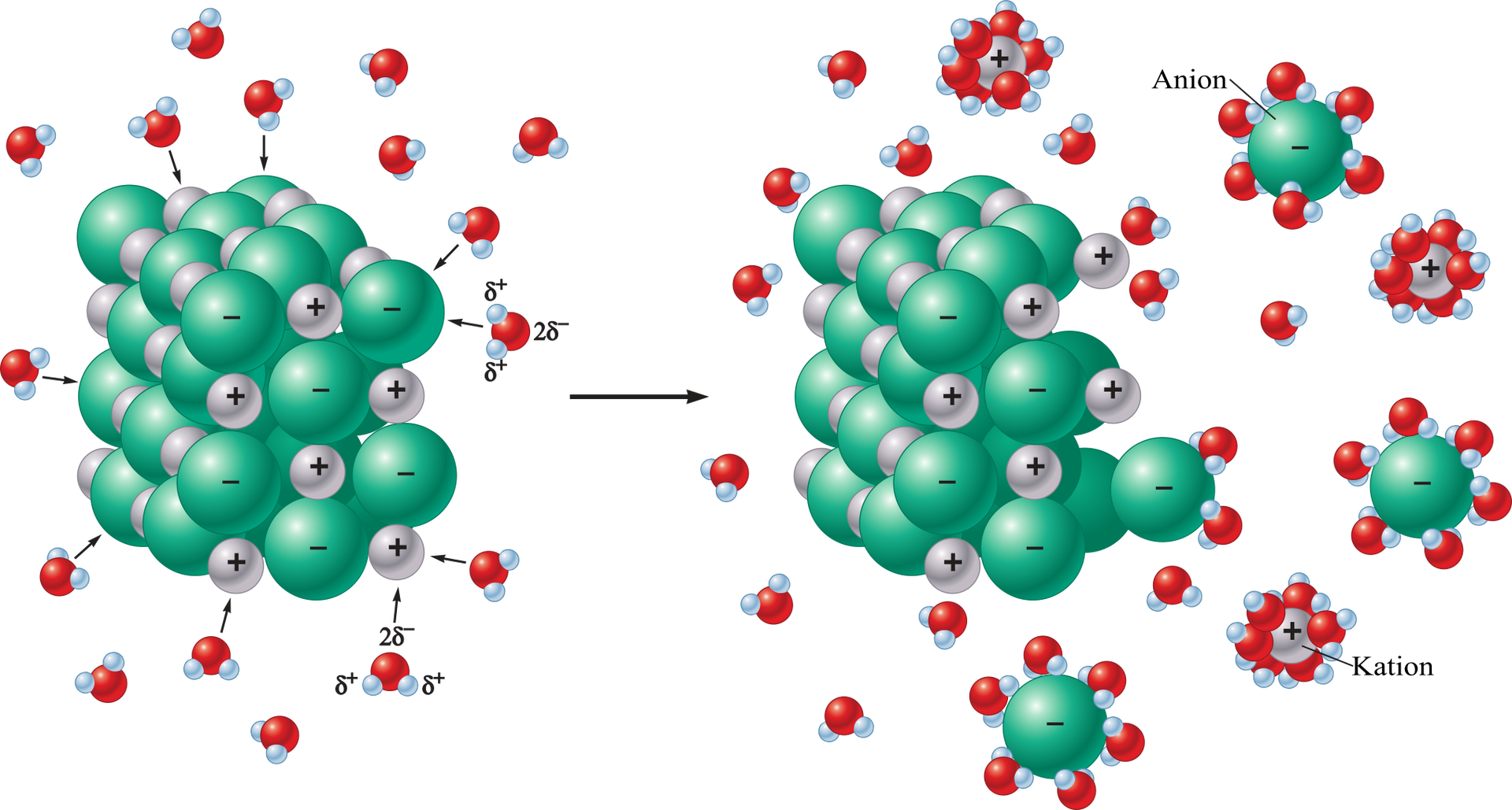
Chlorek sodu () jest związkiem jonowym. Po rozpuszczeniu tej substancji w rozpuszczalniku, np. wodzie, w ilości równej lub mniejszej, która wynika z wartości rozpuszczalności w danych warunkach, swobodne jony soli, pierwotnie tworzące sieć krystaliczną, są otaczane przez polarne cząsteczki rozpuszczalnika i rozproszone w roztworze:
Jony w roztworze – chociaż są cięższe niż cząsteczki wody – nie opadają na dno, lecz pozostają rozproszone i są hydratowane przez cząsteczki wody. Taka sama sytuacja ma miejsce podczas rozpuszczenia cukru. Wówczas cięższe od cząsteczek wody cząsteczki sacharozy () są również równomiernie rozmieszczone między cząsteczkami wody.
Roztwór koloidalny
Roztwory koloidalne to niejednorodne mieszaniny dwóch lub więcej substancji (układ heterogeniczny). W koloidach substancja, będąca w większej objętości w mieszaninie, nazywana jest ośrodkiem dyspersyjnym. Natomiast ta, która stanowi mniejszą część objętościowo, to faza rozproszona. Przykładem roztworu koloidalnego jest m.in. żelatyna rozpuszczona w wodzie. Drobiny w roztworze koloidalnym można zobaczyć za pomocą ultramikroskopu lub mikroskopu elektronowego.
Właściwości
W roztworach koloidalnych drobiny mogą być naładowane elektrycznie (zdyspergowane cząstki noszą ładunki). Poza tym roztwory koloidalne nie mogą przenikać przez błony półprzepuszczalne. Ich cechą charakterystyczną jest zjawisko rozpraszania wiązki światła, tzw. efekt Tyndalla, co wyróżnia je od roztworów właściwych oraz zawiesin. Koloidów również nie można rozdzielić metodą filtracji.
Elektryczne własności roztworów koloidalnych wykorzystuje się do osadzania naładowanych cząstek pyłów w celu oczyszczenia powietrza.
Otrzymywanie
Układy koloidalne można otrzymać na drodze dwóch rodzajów metod:
Zawiesina
Zawiesina jest wieloskładnikowym układem heterogenicznym (wielofazowym) o tzw. rozdrobnieniu makroskopowym. Rozmiar cząstek jest na tyle duży, że jest widoczny gołym okiem. Popularną zawiesiną, spotykaną w życiu codziennym, jest mąka zawieszona w wodzie lub zupa. Innym przykładem może być też zawiesina piasku w wodzie morskiej, a także mleko wapienne.
Właściwości
Zawiesina jest układem nietrwałym. Jej składnik (składniki), w miarę upływu czasu oraz pod wpływem sił grawitacyjnych, opada na dno naczynia. Następuje proces sedymentacji. Składniki zawiesiny można rozdzielić metodą filtracji, w odróżnieniu od układów koloidalnych. Innymi metodami rozdziału tego typu mieszanin są sedymentacjasedymentacja i dekantacjadekantacja.
Otrzymywanie
Zawiesiny można otrzymać metodą dyspersyjną, która polega na zastosowaniu odpowiedniego rozdrobnienia cząstek. W przypadku zawiesin stosowanych jako leki, oczekiwane rozdrobnienie cząstek można uzyskać przy zastosowaniu specjalnych młynków.
Słownik
jednorodna mieszanina dwóch lub więcej substancji (układ homogeniczny), tj. składająca się z substancji rozpuszczonej i rozpuszczalnika
(gr. kólla „klej”, eídos „postać”) układ koloidalny, układ koloidowy; układ dyspersyjny (rozproszony), tj. składający się z fazy rozpraszającej (zwanej fazą ciągłą lub ośrodkiem dyspersyjnym) i fazy rozproszonej (zwanej fazą zdyspergowaną)
niejednorodna mieszanina wieloskładnikowa (układ heterogeniczny) o tzw. rozdrobnieniu makroskopowym
układ rozproszony; układ wielofazowy (zwykle dwufazowy), w którym cząstki jednej z faz (zwanej fazą rozproszoną) są równomiernie rozproszone w drugiej fazie (zwanej fazą rozpraszającą)
(gr. nanos „karzeł”); przedrostek jednostki miary, oznaczający mnożnik ; np.
rozpraszanie światła przez drobne cząstki zawiesiny w ośrodkach mętnych lub zagęszczenia cząsteczek (atomów) czystej substancji, w której, wskutek ruchu cieplnego, zachodzą fluktuacje gęstości
(łac. sedimentum „osad”) metoda rozdziału mieszanin niejednorodnych, która wykorzystuje opadanie na dno naczynia ciała stałego w cieczy na skutek siły ciężkości
metoda rozdzielania mieszaniny niejednorodnej ciała stałego i cieczy, która polega na zlaniu cieczy znad osadu
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2004.
Encyklopedia PWN
Cysewski P., Wykład z chemii ogólnej: Koloidy i roztwory właściwe, Uniwersytet Mikołaja Kopernika w Toruniu.
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.
Kaznowski K., Pazdro K. M., Chemia. Podręcznik do liceów i techników, cz. 1, Warszawa 2019.