Przeczytaj
Reakcje wodorków z wodą
Czy wiesz, jaka jest chemiczna nazwa związku o wzorze ?

Jest to związek wodoru z pierwiastkiem z grupy 16., co oznacza, że można analogicznie zaproponować nazwę, jak w przypadku chociażby siarkowodoru , czyli tlenowodór.
Jest to związek tlenu z pierwiastkiem położonym w 1. grupie, w którym atom tlenu występuje na -II stopniu utlenienia, czyli możemy go nazwać albo tlenkiem wodoru, albo tlenkiem diwodoru, albo oksydanem.
Żadna z tych nazw nie jest adekwatna do wyjątkowych właściwości związku, jakim jest woda.
Nie ma ona właściwości typowych dla wodorków niemetali, jak np. lotny siarkowodór czy chlorowodór, ani typowych dla tlenków litowców – bezpośrednich sąsiadów wodoru w układzie okresowym. Woda wyróżnia się chociażby temperaturami wrzenia i topnienia. Jest bardzo dobrym rozpuszczalnikiem wielu substancji i z wieloma wchodzi w reakcje.
Wodorki metali grupy I i II, oprócz wodorku berylu, reagują gwałtownie z wodą, dzięki czemu powstają wodorotlenki, a przy tym jeszcze wydziela się wodór, np:
Wodorki tlenowców i fluorowców rozpuszczają się w wodzie, a wodne roztwory tych wodorków noszą nazwę kwasów beztlenowych – np. wodny roztwór chlorowodoru HCl: kwas chlorowodorowy (lub solny), wodny roztwór siarkowodoru : kwas siarkowodorowy. W wodzie ulegają reakcji dysocjacji:
Z kolei amoniak (azan) jest wodorkiem niemetalu, który, reagując z wodą, tworzy zasadę amonową:
Wodorki, takie jak np. i , nie reagują z wodą.
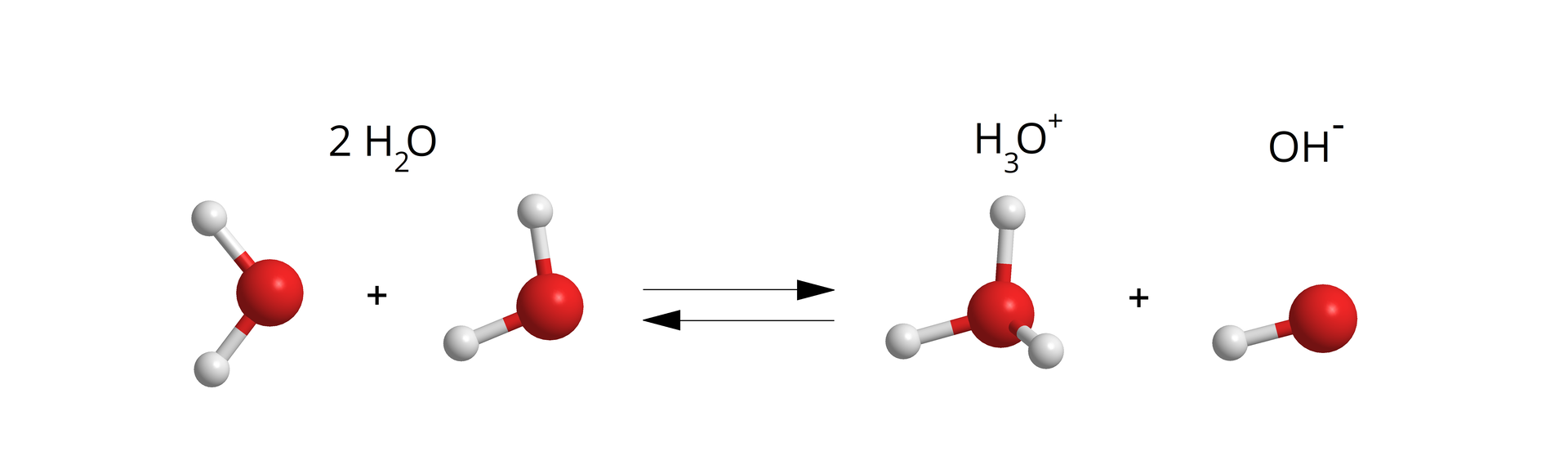
Czy woda może reagować z wodą?
Woda, podobnie jak większość znanych w codzienności szkolnej związków chemicznych, może ulegać procesowi autodysocjacji. Proces ten jednak zachodzi w bardzo małym stopniu i jest ściśle zależny od temperatury i obecności w wodzie innych substancji.
Inne reakcje wodorków niemetali
Wodorki, w których występuje wiązanie kowalencyjnekowalencyjne bądź kowalencyjne spolaryzowane mogą mieć różne właściwości, dlatego też niektóre z nich reagują ze sobą.
Wodorki o charakterze kwasowym, czyli wodorki pierwiastków grupy 16. i 17., mogą reagować z amoniakiem, np:
jest najprostszym przedstawicielem krzemowodorów. Reaguje z fluorowcowodorami, tworząc liczne pochodne, np. monochloromonosilan:
Kwasy beztlenowe reagują bardzo łatwo z wodorkami litowców i berylowców o budowie jonowej, czemu towarzyszy wydzielenie wodoru. Wyjątkiem jest kwas fluorowodorowy, który ulega autodysocjacji i tworzy między sobą silne wiązania wodorowe. Reakcje te są wykorzystywane do uwolnienia wodoru w postaci gazowej z wodorków typu soli pełniących rolę rezerwuarów wodoru, np:
Słownik
związki pierwiastków I i II grupy układu okresowego (z wyjątkiem berylu) z wodorem, zawierające anion wodorkowy , np. wodorek sodu
produkty reakcji syntezy wodoru z niemetalami, mogą mieć różny charakter, np: – obojętny, – amfoteryczny, – kwasowy
teoria protolityczna, teoria protonowa; teoria, wg której kwasami są cząstki (cząsteczki, jony) będące donorami protonów (oddają jony wodoru) w reakcji z akceptorami protonów (cząstkami przyjmującymi jony wodoru), będącymi w tym przypadku zasadami
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 890‑895.
Bielański A., Podstawy chemii nieorganicznej. Część 2, Warszawa 2020.
Czerwiński A, Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik, Warszawa 2002, s. 243‑345.
Sołoniewicz R., Pierwiastki chemiczne grup głównych, Warszawa 1989.
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2019.