Przeczytaj
Czym są molekularne orbitale? Jak można je utworzyć?
W celu opisu budowy elektronowej cząsteczek lub jonów stosujemy wzory kreskowe Lewisa. Jest to pewien uproszczony sposób prezentacji rozmieszczenia par elektronowych, tworzących daną cząsteczkę lub jon.
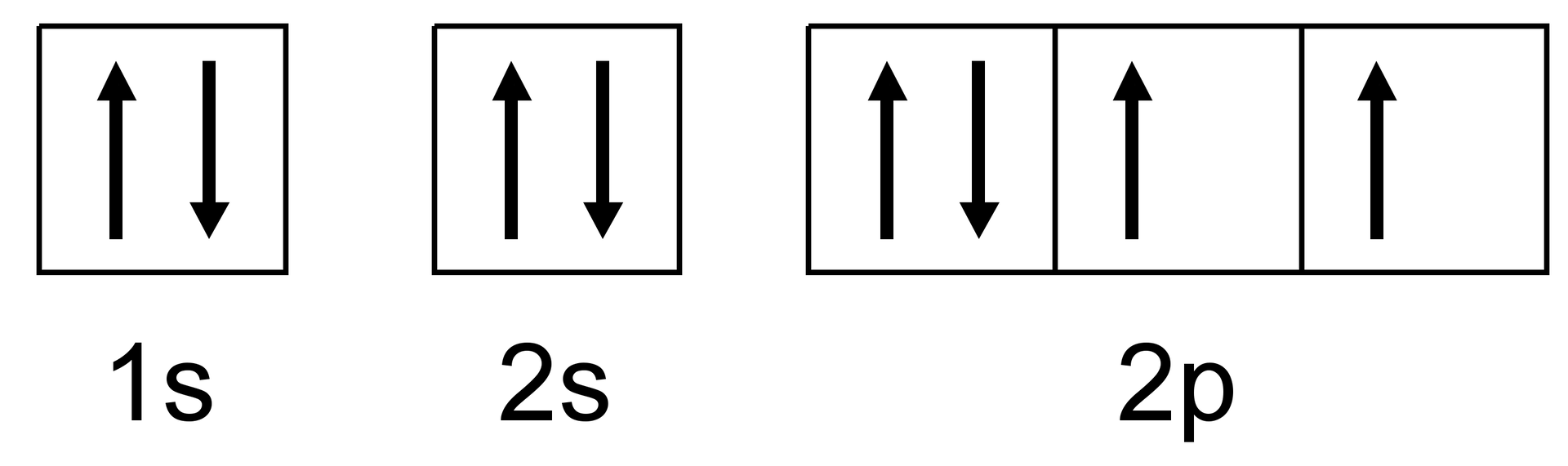
Dokładniejszy opis wymaga uwzględnienia orbitali molekularnychorbitali molekularnych, czyli cząsteczkowych. Można je utworzyć poprzez odpowiednie kombinacje liniowe orbitali atomowychorbitali atomowych powłoki walencyjnej atomów uczestniczących w wiązaniu. Orbitale atomowe, które można użyć do tworzenia orbitali molekularnych, muszą spełniać następujące warunki:
muszą mieć zbliżone wartości energii;
muszą się efektywnie nakładać;
muszą posiadać identyczną symetrię względem osi powstającego wiązania.
Podział orbitali molekularnych
Istnieją różne kryteria podziału orbitali molekularnych. Ze względu na sposób nakładania wyróżniamy nakładanie czołowe () oraz boczne (). Ze względu na energię orbitali można wyróżnić orbitale wiążąceorbitale wiążące, które mają energię niższą od orbitali atomowych, z których zostały utworzone, oraz orbitale antywiążąceorbitale antywiążące – posiadają energię wyższą od “macierzystych” orbitali atomowych. Generalnie, im więcej elektronów znajduje się na orbitalach wiążących, a mniej na antywiążących, tym wiązanie jest silniejsze (co za tym idzie – krótsze), a także wzrasta jego krotność, czyli rząd wiązania.
Niektóre orbitale atomowe nie ulegają nałożeniu w trakcie tworzenia kombinacji liniowych. Przyczynami tego mogą być: brak orbitalu o odpowiedniej symetrii, zbyt duża różnica energii lub zbyt duża odległość między atomami. Takie orbitale „przechodzą” praktycznie niezmienione do cząsteczki, w której posiadają taką samą energię, jaką miały w izolowanym atomie. Innymi słowy nie wnoszą one żadnego przyczynku do wiązania – ani stabilizującego, ani destabilizującego. Takie orbitale określa się jako niewiążąceniewiążące. W zależności od rodzaju orbitalu molekularnego ( czy ), powstający orbital określa się odpowiednio jako lub .
Konstrukcja diagramów
Cząsteczki i jony homoatomowe
Konstrukcja diagramów cząsteczek/jonów homoatomowych wykorzystuje nakładanie orbitali atomowych spełniających następujące warunki:
Mają zbliżoną energię
Im mniejsza różnica energii między orbitalami atomowymi, tym nakładanie jest bardziej efektywne.
Mają taką samą symetrię względem osi wiązania
Jeżeli oś wiązania określimy jako y, wówczas orbitale typu oraz będą posiadać płaty orbitalne w osi wiązania. Stąd nakładanie , , da orbitale . Z kolei posiadają płaszczyzny węzłowe. Tutaj, ze względu na symetrię, możliwe są tylko kombinacje oraz , tworzące w rezultacie orbitale .
Mogą się efektywnie nakładać
Przykładem są wiązania , tworzone przez pierwiastki okresu drugiego. Pierwiastki okresu trzeciego i kolejnych posiadają wyraźnie większe promienie atomowe w stosunku do pierwiastków okresu drugiego. Wskutek większej odległości między atomami, nakładanie boczne orbitali atomowych jest dużo słabsze, co jest widoczne w mniejszej tendencji do tworzenia wiązań przez atomy pierwiastków okresu 3. i kolejnych.
Cząsteczki i jony heteroatomowe
W przypadku diagramów dla cząsteczek/jonów heteroatomowych sytuacja się komplikuje z powodu konieczności uwzględnienia różnic energii orbitali atomowych poszczególnych atomów. Zasadniczą regułą jest, że orbitale walencyjne atomu pierwiastka o wyższej elektroujemności mają energię niższą od orbitali walencyjnych atomu pierwiastka o niższej elektroujemności. Wskutek nakładania tych orbitali atomowych powstają dwa orbitale molekularne (cząsteczkowe). Orbital o niższej energii (czyli wiążący) posiada dominujący udział orbitalu atomowego pierwiastka bardziej elektroujemnego. Na tym orbitalu będzie znajdować się para elektronowa (wiążąca), co jest zgodne z polaryzacją wiązania. Orbital o wyższej energii (antywiążący) będzie nieobsadzony.
Krańcowym przypadkiem będzie sytuacja, gdy różnica elektroujemności będzie tak duża, że nakładanie nie będzie praktycznie możliwe. Oczywiście można zaproponować orbitale molekularne pełniące funkcje wiążące i antywiążące, ale będą one praktycznie tożsame z orbitalami atomowymi atomów: odpowiednio bardziej elektroujemnego („wiążący”) i mniej elektroujemnego („antywiążący”). Elektrony będą preferować orbitale o jak najniższej energii, lokując się na atomie pierwiastka o wyższej elektroujemności, co odpowiada sytuacji wiązania jonowego. Diagramy energetyczne dla cząsteczek/jonów dwuatomowych posiadających wiązania są bardziej skomplikowane, a ich konstrukcja wymaga uwzględnienia danych doświadczalnych. Z kolei diagramy energetyczne dla cząsteczek wieloatomowych przedstawiają jeszcze wyższy stopień skomplikowania, z powodu konieczności uwzględnienia bardziej subtelnych efektów, które prowadzą do konstrukcji orbitali wielocentrowych, tj. złożonych z więcej niż dwóch orbitali atomowych.
Słownik
funkcja falowa charakteryzująca zachowanie elektronu w oparciu o zestaw liczb kwantowych; prawdopodobieństwo znalezienia elektronu w danym punkcie jest proporcjonalne do kwadratu z bezwzględnej wartości tej funkcji w tym punkcie
orbital utworzony poprzez kombinacje liniowe orbitali atomowych; liczba orbitali molekularnych musi równać się liczbie orbitali atomowych; jeżeli do kombinacji wzięto dwa orbitale atomowe o takiej samej bądź zbliżonej energii, wówczas otrzymuje się dwa orbitale molekularne różniące się energią: wiążący i antywiążący
orbital molekularny otrzymany poprzez nałożenie czołowe orbitali atomowych; posiada maksymalną gęstość elektronową na osi wiązania
orbital molekularny otrzymany poprzez nałożenie boczne orbitali atomowych; posiada płaszczyznę węzłową na osi wiązania – prawdopodobieństwo znalezienia elektronu na osi wiązania wynosi zero
orbital molekularny o energii niższej od orbitali atomowych, z których został utworzony; posiada płaty orbitalne w przestrzeni pomiędzy atomami; obsadzenie elektronami powoduje obniżenie energii całego układu, czyli stabilizację cząsteczki
orbital molekularny o energii wyższej od orbitali atomowych, z których został utworzony; posiada płaty orbitalne umiejscowione z dala od wiązania pomiędzy atomami; obsadzenie elektronami powoduje podwyższenie energii całego układu, czyli destabilizację cząsteczki
orbital molekularny o energii zbliżonej do orbitali atomowych, z których został utworzony; nie wywołuje efektu stabilizującego ani destabilizującego wiązanie; typowym przykładem orbitali niewiążących są wolne pary elektronowe znajdujące się na niektórych atomach w cząsteczce
przestrzeń zawierająca punkty, w których prawdopodobieństwo znalezienia elektronu jest duże, np. większe od ; kształt płatów, ich liczba oraz rozmieszczenie w przestrzeni jest charakterystyczną cechą poszczególnych orbitali i pozwala na ich łatwe odróżnienie, np. wszystkie orbitale atomowe posiadają sferyczne płaty orbitalne
płaszczyzna, w której prawdopodobieństwo znalezienia elektronu wynosi zero
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1997 i wyd. następne.

