Przeczytaj
Wzór na stężenie procentowe
StężenieStężenie procentowe wyraża liczbę gramów substancji rozpuszczonej, która znajduje się w 100 g roztworu.
gdzie:
– masa substancji rozpuszczonej [g];
– masa roztworu [g];
W 100 g 23% roztworu glukozy w wodzie znajdują się 23 g glukozy i 77 g wody.
Wzór na stężenie molowe
Stężenie molowe określa liczbę molimoli substancji rozpuszczonej w 1 (1000 ) roztworuroztworu. Jednostką stężenia molowego jest .
gdzie:
– liczba moli substancji rozpuszczonej [mol];
– objętość roztworu [dmIndeks górny 33];
– masa molowa substancji rozpuszczonej .
W 1 rozworu o stężeniu 0,7 znajduje się 0,7 mola .
Stężenie procentowe można łatwo przeliczyć na stężenie molowe (i odwrotnie), jeśli zna się wartość gęstościgęstości () roztworu.
Jak przeliczyć stężenie procentowe na stęzenie molowe, i odwrotnie?
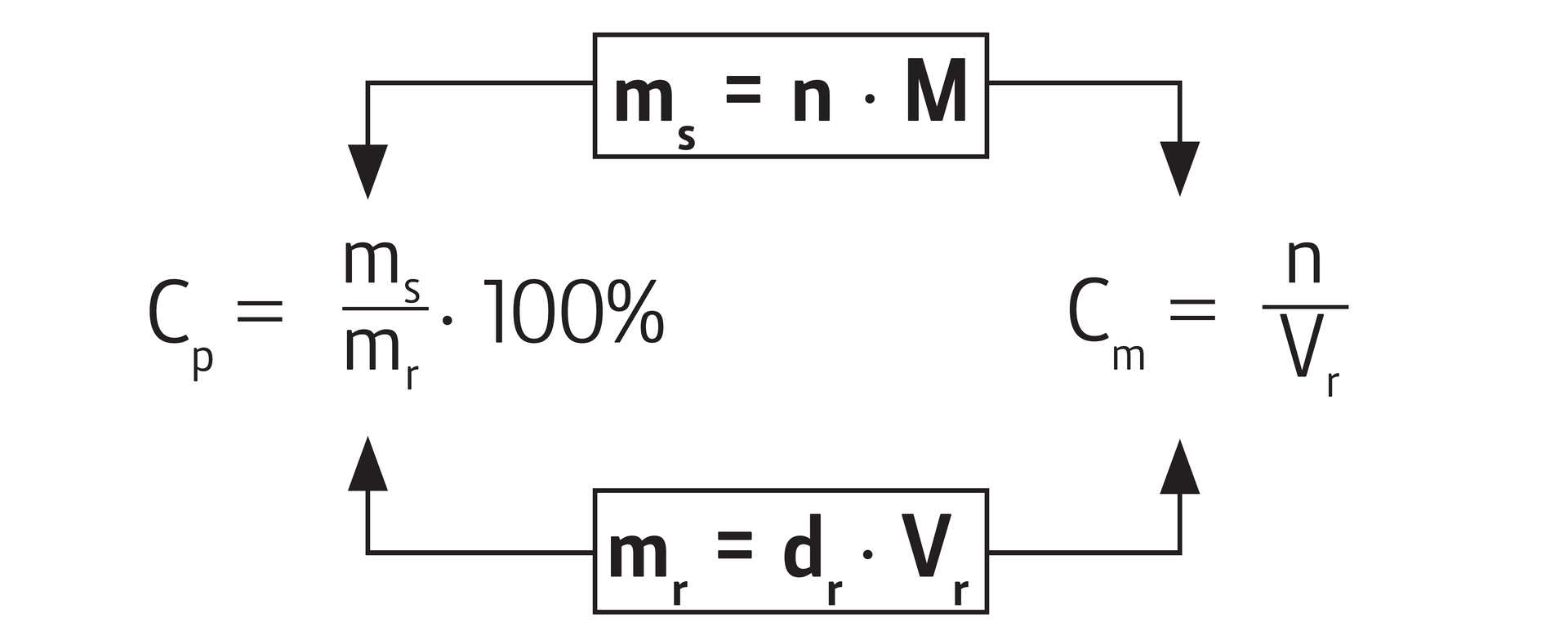
Stężenie procentowe wyraża skład masowo () – masowy (), natomiast stężenie molowe, skład ilościowo () – objętościowy ().
Jeśli chcemy przeliczyć masę substancji rozpuszczonej () na ilość substancji rozpuszczonej (), to musimy znać masę molową substancji rozpuszczonej :
Gęstość roztworu jest potrzebna do przeliczenia masy roztworu na objętość roztworu:
Do wzoru na podstawiamy wyrażenia na masę substancji rozpuszczonej oraz na masę roztworu (jak na schemacie) i otrzymujemy:

Wzór na stężenie molowe otrzymamy po przekształceniu wzoru na :
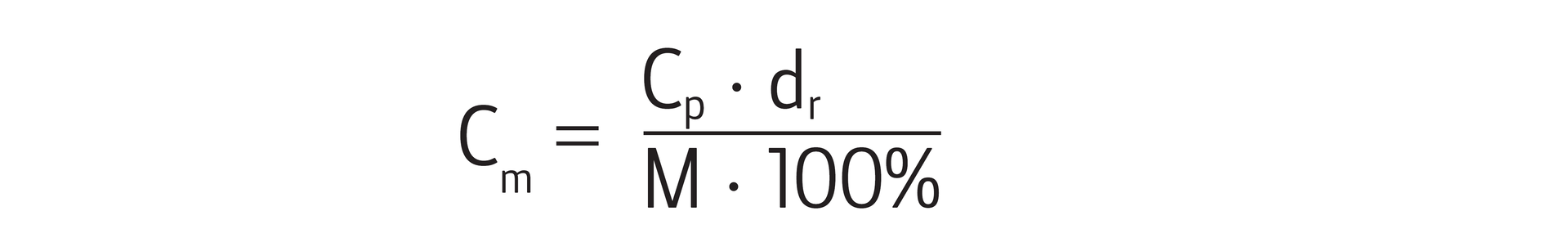
Poniżej zamieszczono sposób obliczania stężenia procentowego, przy wykorzystaniu w tym celu stężenia molowego, oraz sposób obliczania stężenia molowego, przy wykorzystaniu podanego stężenia procentowego. Postaraj się wykonać poniższe zadania samodzielnie.
Stężenie procentowe roztworu wynosi 98%, a jego gęstość 1,84 . Oblicz stężenie molowe tego kwasu.
Dane:
Szukane:
Gęstość kwasu solnego o stężeniu 12,4 wynosi 1,19 . Oblicz stężenie procentowe tego kwasu.
Dane:
Szukane:
Słownik
jednostka liczności (ilości) materii, podstawowa jednostka w układzie SI; liczność materii układu równą 6,022 · 10Indeks górny 2323
jednorodna mieszanina substancji, tj. mieszanina stanowiąca jedną fazę; mogą występować w różnych stanach skupienia: gazowym (mieszaniny gazów), ciekłym (gaz, ciało stałe lub ciecz, rozpuszczone w cieczy), stałym (gaz okludowany w metalu, roztwór stały); najczęściej termin ten stosuje się do roztworów ciekłych, rzadziej stałych
wielkość fizyczna, charakteryzująca rozkład przestrzenny rozważanej wielkości fizycznej, np. masy, siły, pędu, energii, ładunku elektrycznego; w chemii gęstość roztworu wyrażamy wzorem:
- masa roztworu [g], - objętość roztworu
koncentracja; sposób określania zawartości składnika (B) w danym układzie (w danej substancji)
Bibliografia
Encyklopedia PWN
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum. Poziom podstawowy i rozszerzony, Warszawa - Bielsko‑Biała 2010.