Przeczytaj
Kinetyka chemiczna
Dziedzina chemii, związana z tematem lekcji, to kinetyka chemiczna. Ten dział zajmuje się analizą przebiegu reakcji chemicznej pod wieloma względami. Zagadnienie, które wyjaśnia, w jaki sposób zachodzi reakcja pomiędzy cząsteczkami reagentów, to teoria zderzeń aktywnych. Polega ona na tym, że cząsteczki mogą reagować ze sobą, jeśli dojdzie pomiędzy nimi do zderzenia, a ich energia będzie odpowiednio wysoka. Takie zjawisko nazywa się zderzeniem efektywnymzderzeniem efektywnym, a energia posiadana wówczas przez substraty nazywa się energią aktywacjienergią aktywacji. Teoria ta pozwala na wyjaśnienie, w jaki sposób oddziałują ze sobą cząsteczki substratów, jednak nie precyzuje, co dokładnie dzieje się w trakcie takiego zderzenia z atomami i wiązaniami w cząsteczkach. Tę kwestię tłumaczy teoria kompleksu aktywnegokompleksu aktywnego, czyli stanu przejściowego, występującego pomiędzy substratami a produktem.
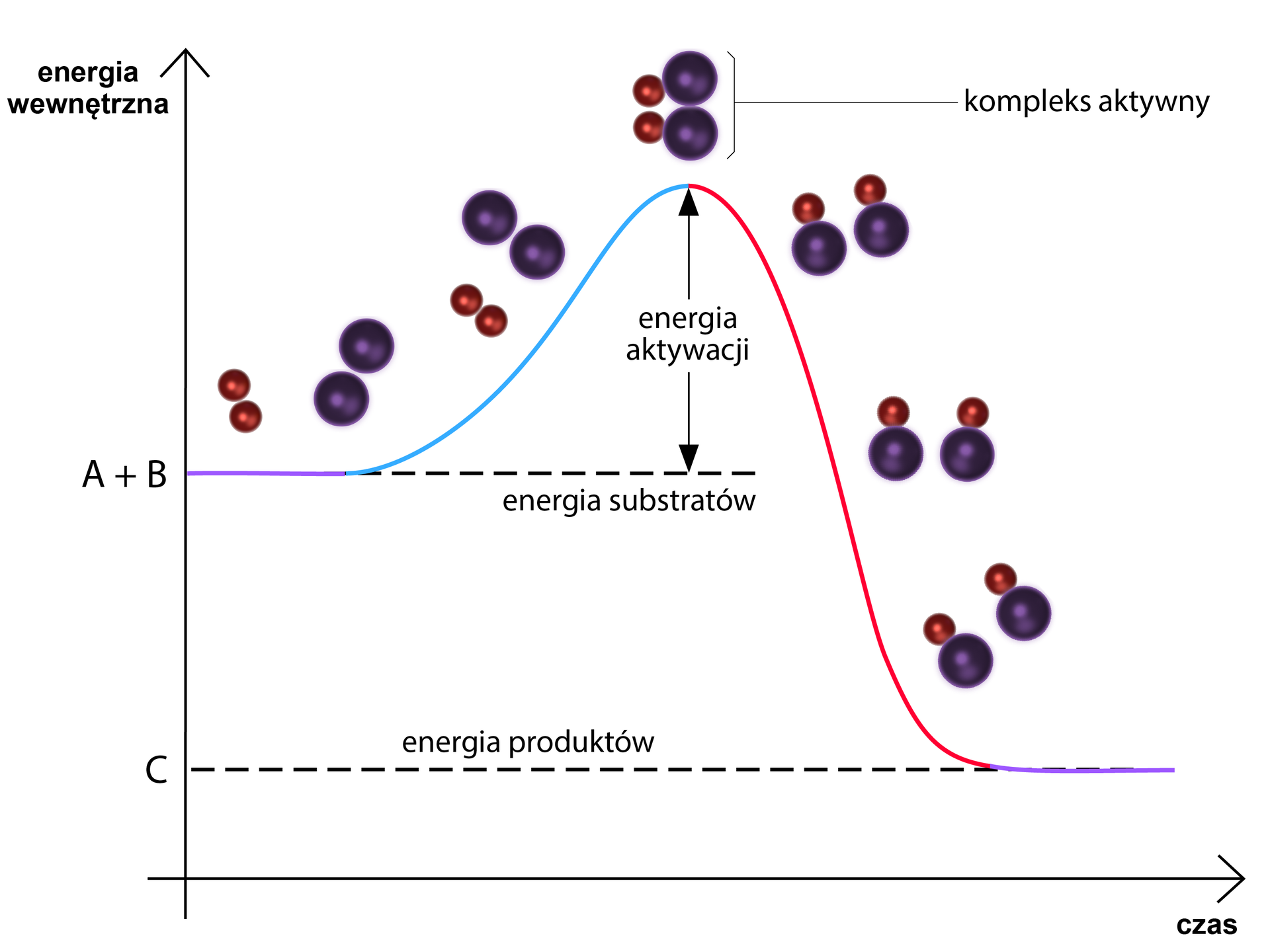
Powyższy wykres ilustruje zmiany energii wewnętrznejenergii wewnętrznej reagentów w czasie przebiegu reakcji chemicznej. Dzięki niemu obserwujemy, że energia kompleksu aktywnego jest wyższa niż energia cząsteczek substratów, dzięki czemu możliwe jest powstanie docelowych produktów. To, czy reakcja zajdzie, determinuje powstanie kompleksu aktywnego. Ten stan przejściowy charakteryzuje się częściowymi zmianami wiązań i przegrupowaniami. Posiada również wysoką energię wewnętrzną (wyższą od tej dla sumy substratów i dla sumy produktów). Aby reakcja chemiczna mogła zajść, substraty muszą tę energię osiągnąć. Decyduje więc ona o powodzeniu danej reakcji i o jej szybkości. Pokonanie tej „bariery energetycznej”, wynikającej z energii aktywacji, jest możliwe m.in. poprzez zastosowanie katalizatorówkatalizatorów.
Katalizatory
Katalizator jest substancją, która ułatwia przeprowadzenie reakcji chemicznej. Łączy się z substratami i tworzy zmodyfikowany kompleks aktywny, do którego utworzenia potrzebna jest znacznie mniejsza energia, niż do utworzenia kompleksu aktywnego wyłącznie między samymi substratami. Katalizator zatem obniża energię aktywacji danej reakcji chemicznej, ponieważ wytworzenie kompleksu aktywnego z jego udziałem dla cząsteczek substratów jest łatwiejsze – wymaga użycia mniejszej energii. Po jej zakończeniu, katalizator całkowicie się odtwarza, a więc jego ilość jest taka sama na początku, jak i po zakończeniu reakcji. Jego działanie polega na stworzeniu alternatywnej drogi reakcji – energie aktywacji reakcji, które biegną z udziałem katalizatora, są niższe od odpowiednich energii aktywacji bez jego udziału. Jeżeli reakcja bez katalizatora wymaga , to w jego obecności dwie reakcje wykazują i , przy czym każda z nich jest mniejsza od . Zjawisko przyspieszenia reakcji chemicznej przez katalizator nazywa się katalizą.
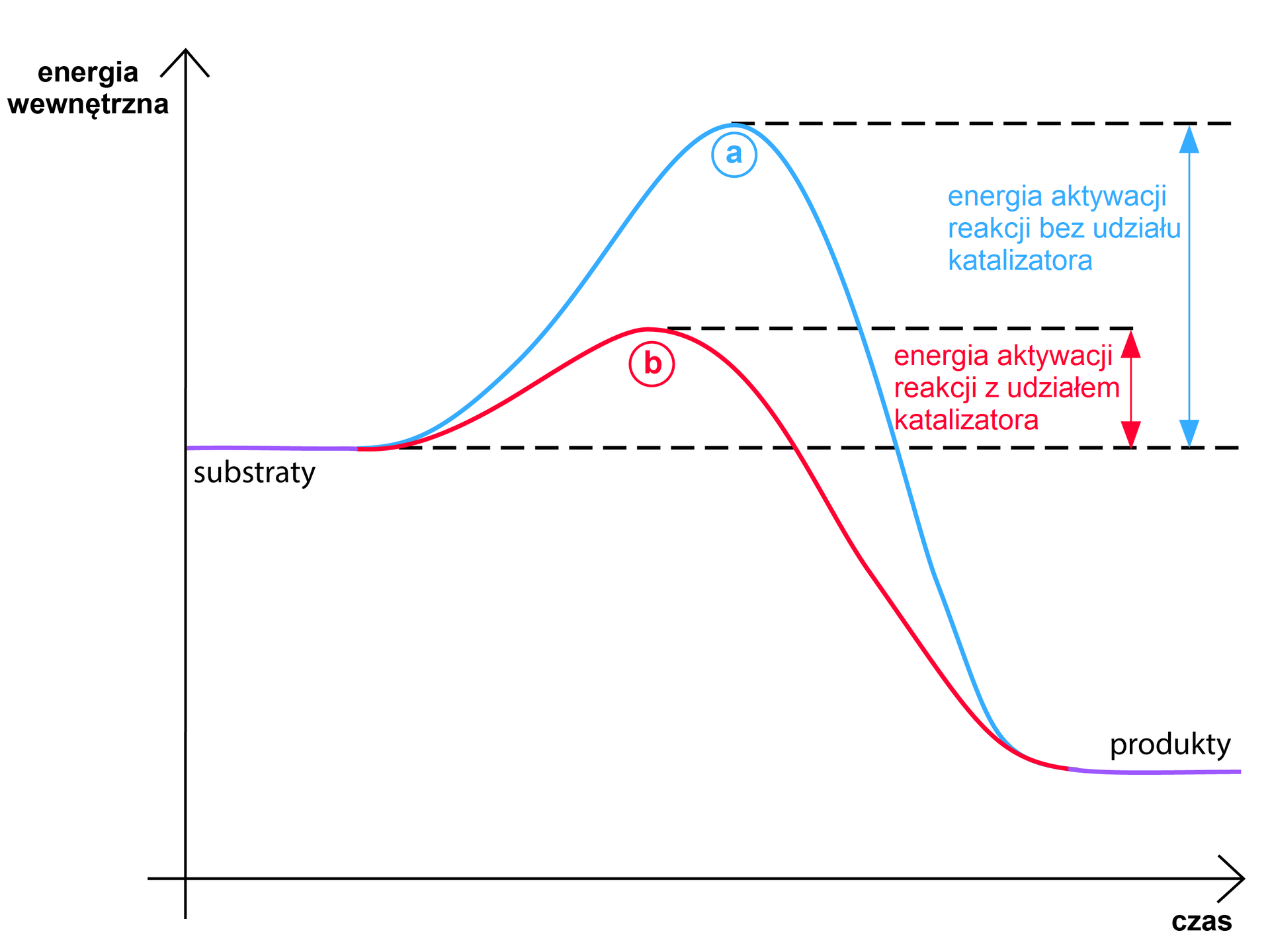
a) z udziałem katalizatora
b) bez udziału katalizatora
Przeciwieństwem katalizatorów są inhibitoryinhibitory – stosuje się je do reakcji przebiegających zbyt gwałtownie, aby zwolnić ich przebieg i uzyskać nad nimi kontrolę. Wyróżniamy katalizatory/inhibitory homogeniczne, czyli będące w takiej samej fazie, co substraty (stan skupienia katalizatorów/inhibitorów jest taki sam), oraz heterogeniczne, które są w innej fazie niż substraty (stan skupienia katalizatorów/inhibitorów jest różny). Kataliza jest bardzo ważnym procesem chemicznym, mającym wręcz strategiczne znaczenie na skalę międzynarodową. Odkrycie noblistów z – Richarda F. Hecka, Ei–Ichi Negishi, Akiry Suzukiego, dotyczące katalizowanych przez pallad reakcji sprzęgania krzyżowego (reakcja, w której następuje tworzenie wiązania węgiel‑węgiel), stosowanych w syntezie organicznej, pozwoliło na rozwinięcie wielu dziedzin, w tym przemysłu chemicznego, elektroniki, rolnictwa. Jednak najbardziej cennym okazało się zastosowanie reakcji sprzęgania w przemyśle farmaceutycznym do produkcji laboratoryjnej substancji, która hamuje rozwój komórek nowotworowych. Naturalnie występuje ona w gąbce Discodermia dissoluta (odkryta została w latach na Karaibach).
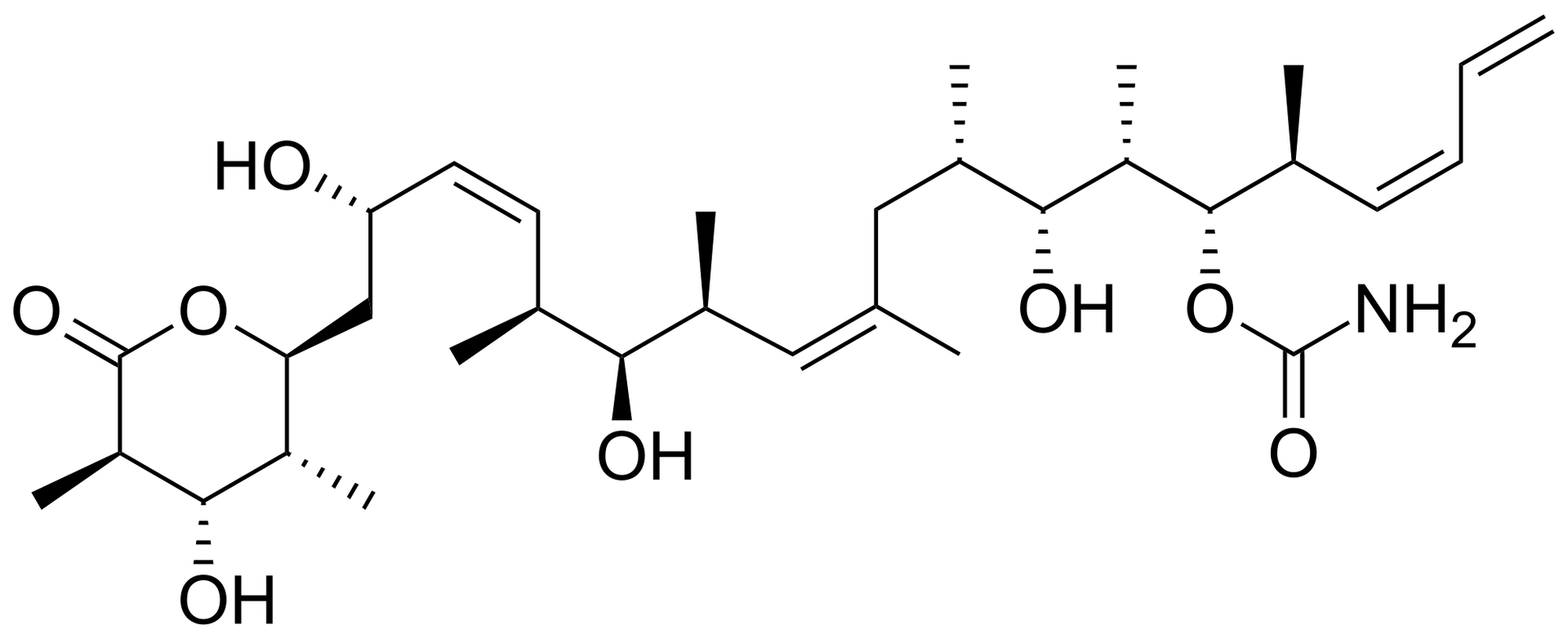
Biokataliza enzymatyczna jest to proces biochemiczny, w którym jako katalizatory stosowane są enzymy. Wykazują one silną selektywność w stosunku do katalizowanych reakcji, będąc aktywne tylko wobec np. związków o konfiguracji , a nieaktywne wobec związków o konfiguracji D lub odwrotnie. Taka cecha pozwala na prowadzenie skomplikowanych procesów biochemicznych i – w sposób szczególny – odróżnia katalizatory enzymowe od katalizatorów organicznych i nieorganicznych.
Słownik
substancja chemiczna, której dodatek do układu reakcyjnego powoduje przyspieszenie reakcji chemicznej, a po zakończeniu reakcji jest w całości odzyskiwana; wyróżniamy katalizatory homogeniczne, czyli będące w takiej samej fazie, co substraty, oraz heterogeniczne, które są w innej fazie niż substraty
substancja chemiczna, której dodatek do układu reakcyjnego powoduje spowolnienie lub zatrzymanie reakcji chemicznej, a po zakończeniu reakcji jest w całości odzyskiwana; wyróżniamy inhibitory homogeniczne, czyli będące w takiej samej fazie, co substraty, oraz heterogeniczne, które są w innej fazie niż substraty
energia danego układu termodynamicznego, na którą składa się energia potencjalna i energia kinetyczna
takie zderzenie, w wyniku którego tworzone są bądź rozrywane wiązania chemiczne
najmniejsza ilość energii, jaką muszą mieć cząsteczki substratów do utworzenia kompleksu aktywnego
powstałe w wyniku zderzenia takie ułożenie jader i elektronów (pochodzących od substratów), które w czasie reakcji pozwala na osiągnięcie maks. energii i przez który przebiega reakcja chemiczna
Bibliografia
Encyklopedia PWN
Bełtowska–Brzezinska M., Podstawy kinetyki chemicznej. Skrypt do wykładów, Poznań 2009.
Bielański A., Podstawy Chemii nieorganicznej, Warszawa 1994.
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.