Przeczytaj
Reakcja chloru z sodem
Jaki będzie efekt umieszczenia w cylindrze z chlorem kawałka sodu?
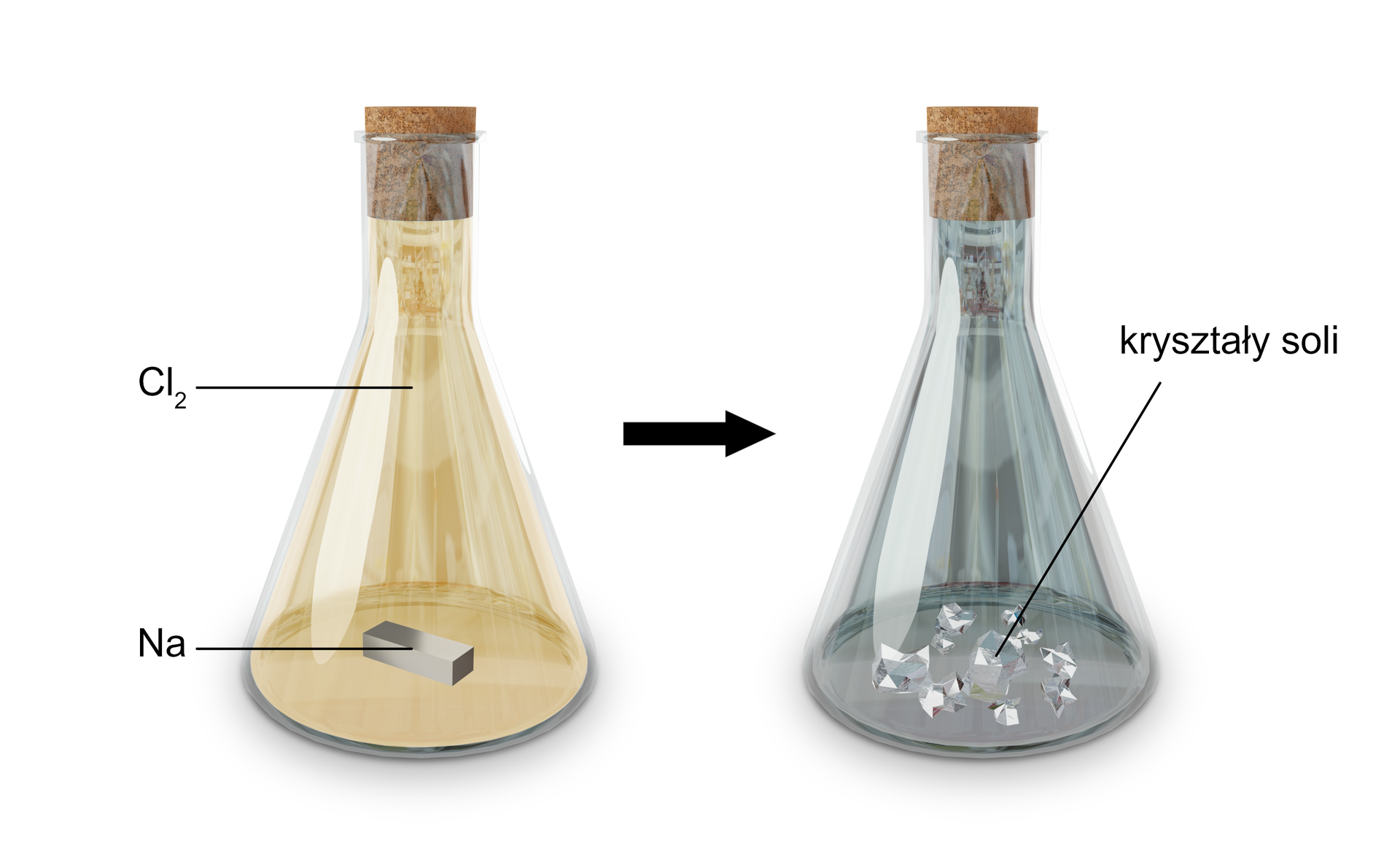
Umieszczony w zamkniętym naczyniu z chlorem kawałek sodu, po jakimś czasie pokrywa się białym nalotem, a następnie rozpada się i powstaje biała, krystaliczna substancja.
Skorzystaj z układu okresowego i zapisz skróconą podpowłokową (zawierającą rdzeń odpowiedniego gazu szlachetnego) konfigurację elektronową atomów chloru i sodu.
Co się dzieje z atomami, gdy sód i chlor reagują ze sobą?
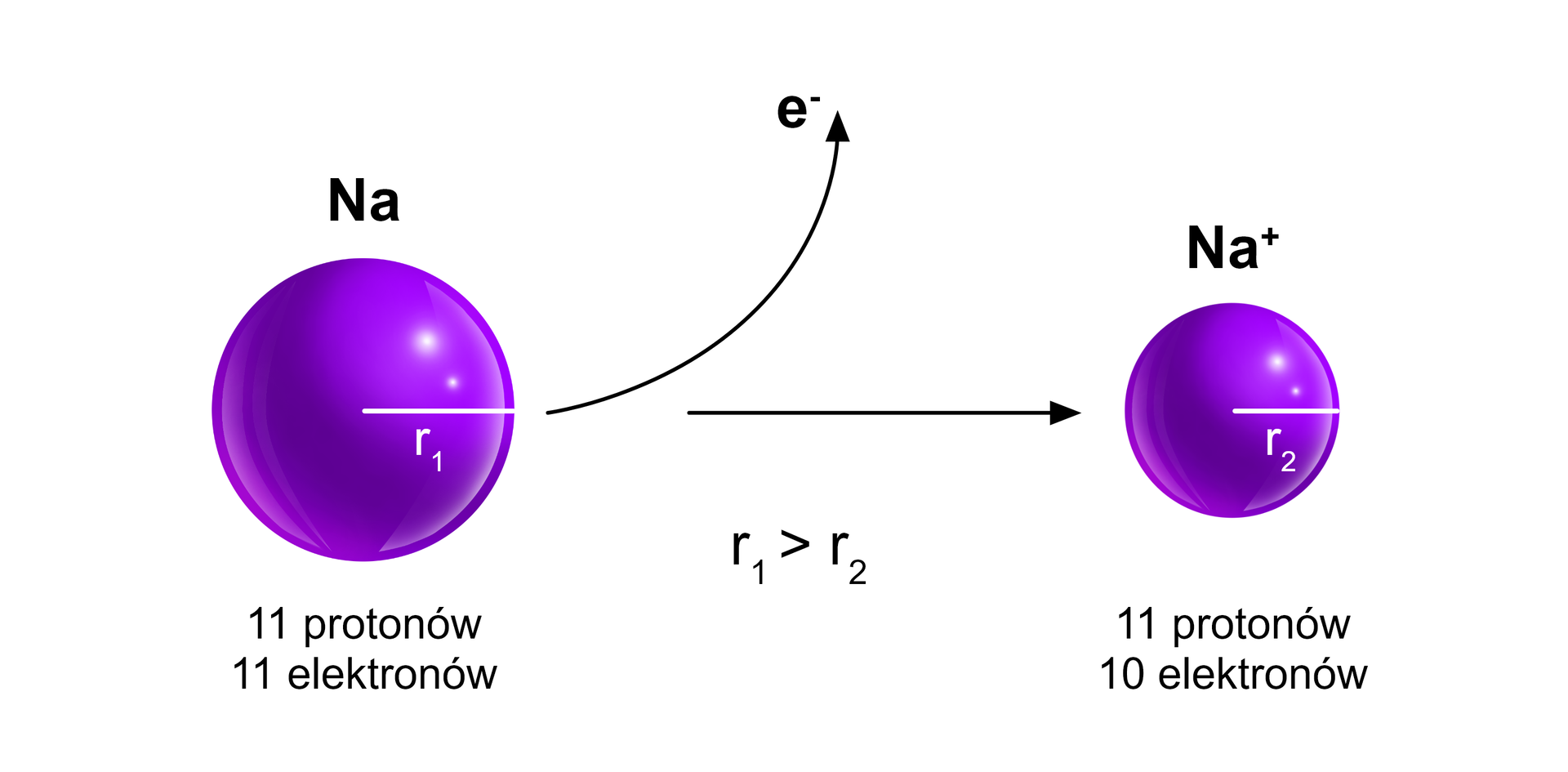
Atom sodu oddaje elektron i powstaje kation , o konfiguracji elektronowej identycznej jak atom neonu. Kation ma mniejszy promień niż atom, z którego powstał.
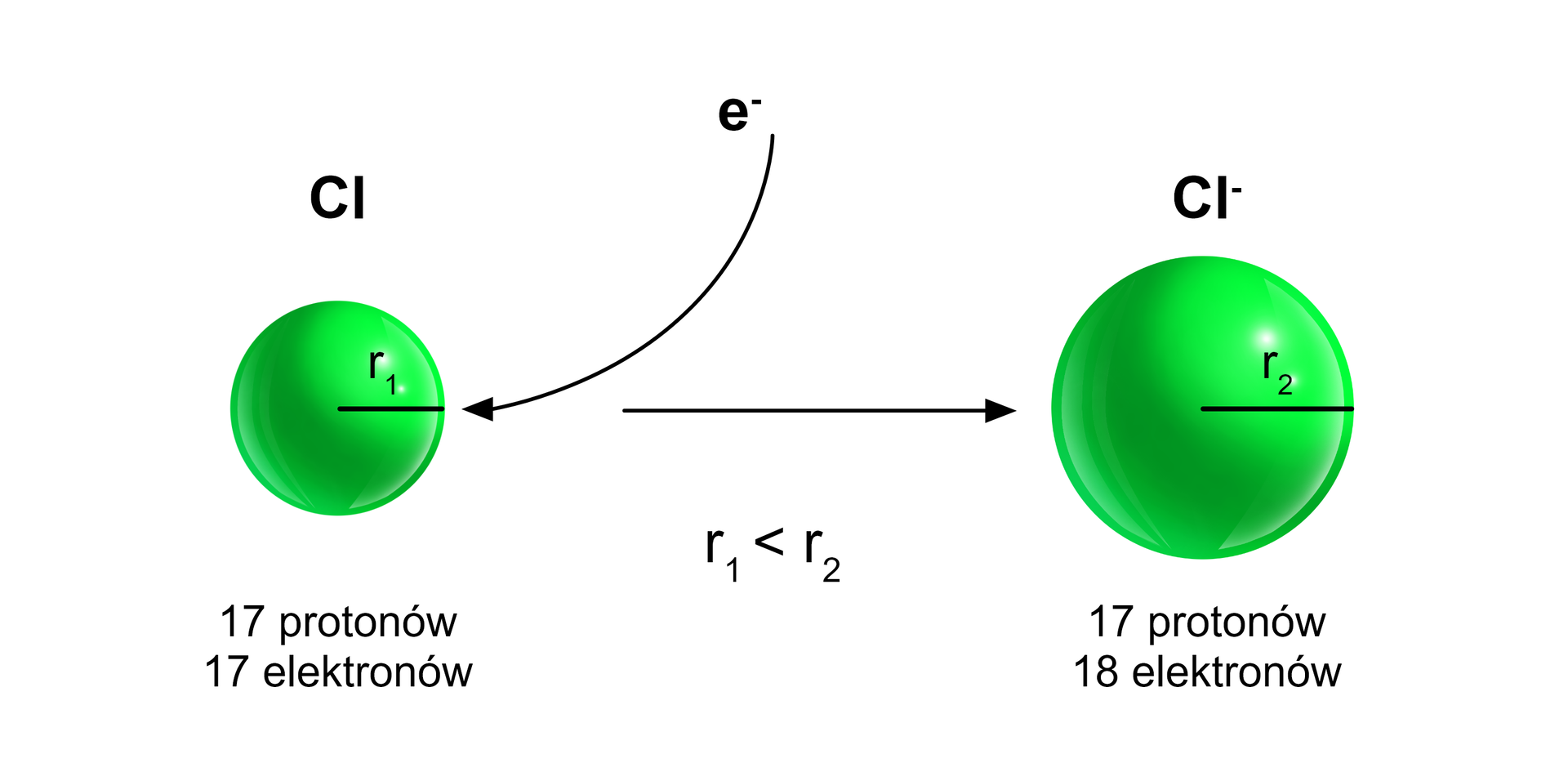
Atom chloru przechwytuje elektron i powstaje anion , o konfiguracji identycznej jak atom argonu. Anion ma większy promień niż atom, z którego powstał.
Kation sodu i anion chlorkowychlorkowy oddziałują na siebie siłami elektrostatycznymi – tworzy się wiązanie jonowewiązanie jonowe.
Procesy zachodzące podczas reakcji sodu i chloru można zapisać następującymi równaniami:
tworzenie się kationu sodu:
powstawanie anionu chlorkowego:
reakcja sumaryczna:

Do wyjaśnienia mechanizmu tworzenia się wiązania pomiędzy atomami, można także posłużyć się stosowanymi w modelu kwantowo‑mechanicznym diagramami poziomów energetycznych. Pomiędzy atomami następuje przeniesienie elektronu z poziomu w atomie sodu, na poziom atomu chloru i tworzą się jony i . W ten sposób i , i osiągają stabilny stan, w którym zewnętrzna powłoka jest zapełniona. Przeciwne ładunki i przyciągają się, tworząc związek chemiczny .
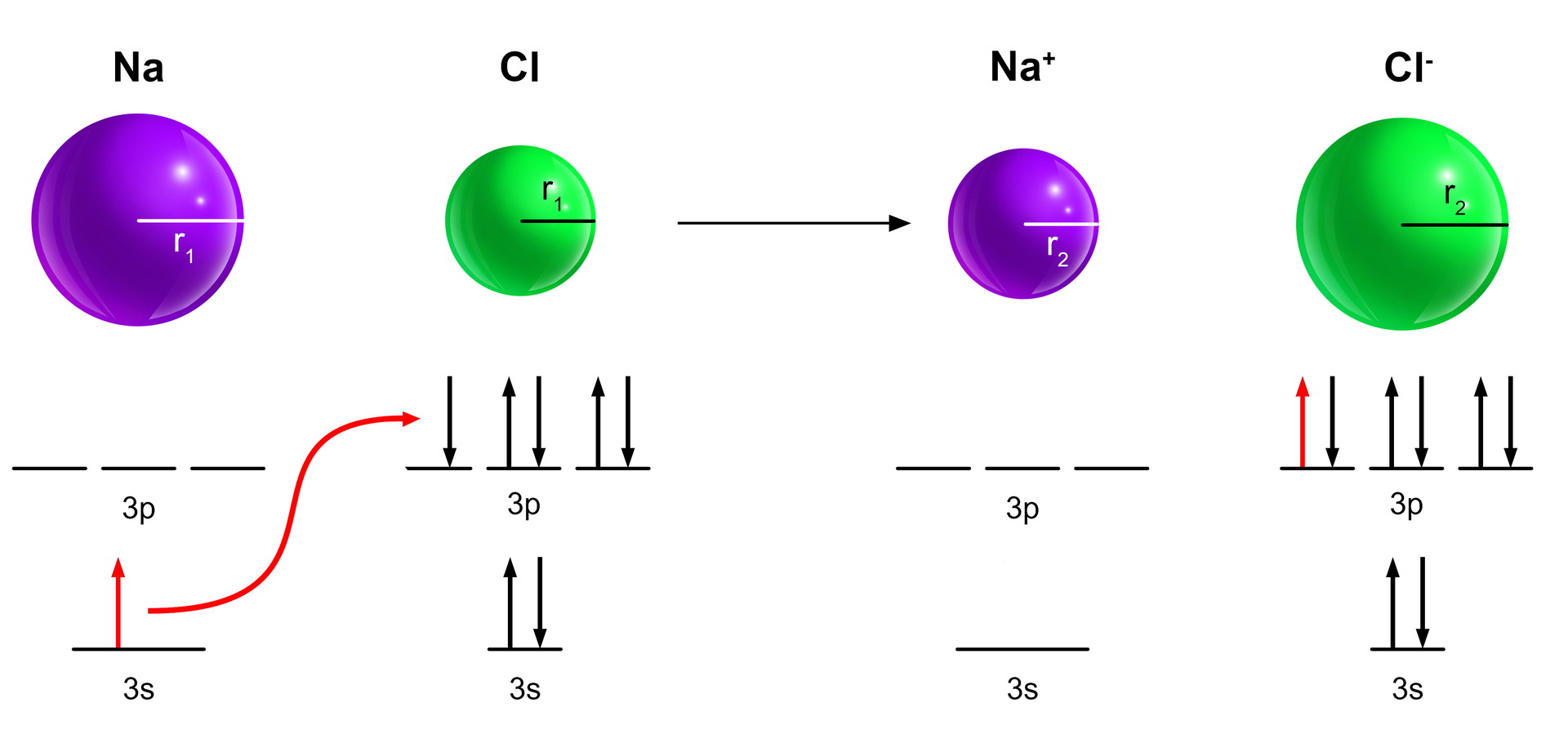
Indeks dolny Źródło: Moore J. T., Chemia dla bystrzaków, Gliwice 2015, s. 197. Indeks dolny koniecŹródło: Moore J. T., Chemia dla bystrzaków, Gliwice 2015, s. 197.
Reakcja chloru z potasem
Jaki będzie efekt umieszczenia w cylindrze z chlorem kawałka potasu?

Reakcja glinu i żelaza z chlorem
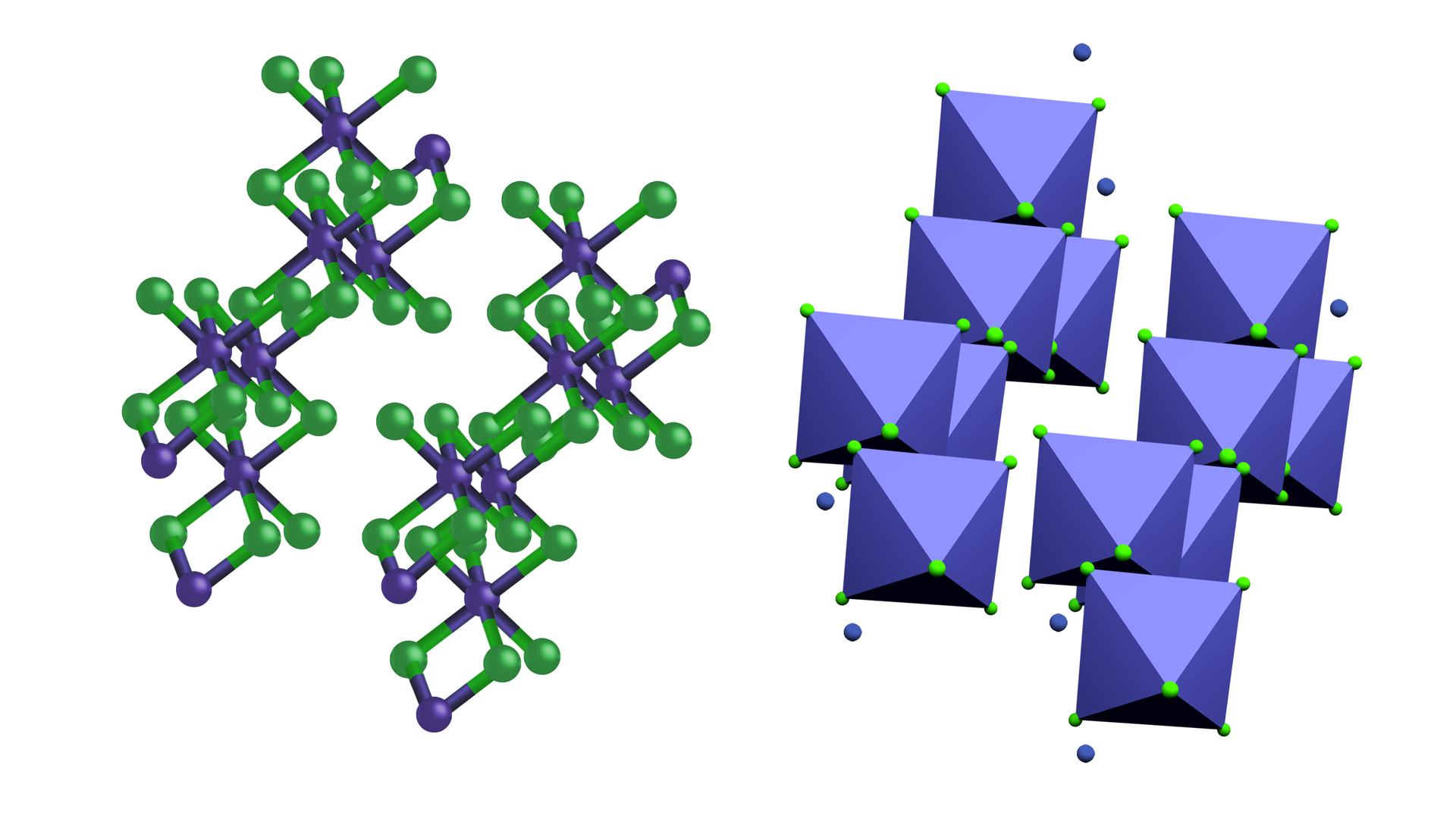
Chlor reaguje bezpośrednio także z glinem, tworząc chlorek glinu , a właściwie . Chlorek glinu dimeryzuje, ponieważ wolny atom glinu posiada 3 elektrony walencyjne: , które oddaje, tworząc kation o konfiguracji atomu neonu. Inną możliwością jest uzyskanie konfiguracji atomu argonu poprzez utworzenie trzech wiązań przez uwspólnienie trzech elektronów walencyjnych. Do uzyskania oktetu wykorzystana zostaje jedna z wolnych par elektronów atomu chloru. W efekcie powstają dwa mostki chlorkowe .
Gdy do naczynia z chlorem wsypiemy rozgrzane opiłki żelaza, nastąpi gwałtowna reakcja, której produktem jest chlorek żelaza().
Chlorki metali są podstawowymi surowcami przemysłu chemicznego (m.in. produkcja sody, kwasu solnego, chloru), stosowane są również szeroko w przemyśle spożywczym, farmaceutycznym oraz optoelektronicznym. Niektóre z nich można znaleźć w przyrodzie w postaci złóż (np. jako sól kamienna), a nawet roztworów (np. w wodzie morskiej). Najważniejsze z nich to: chlorki cynku, rtęci(), sodu, srebra, wapnia, żelaza().

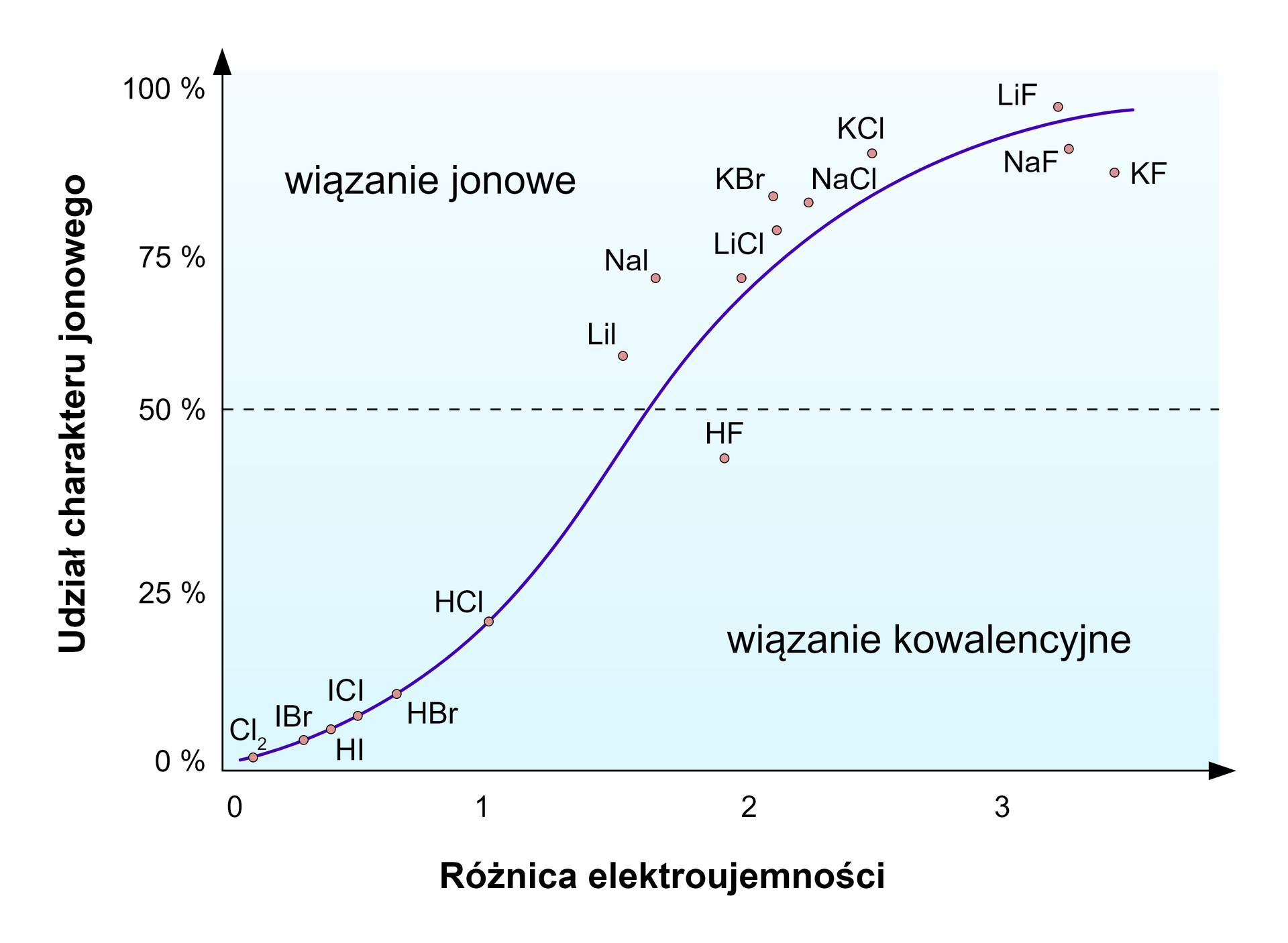
Udział wiązania jonowegowiązania jonowego dla wybranych chlorków metali.
Wzór | Różnica elektroujemności | Udział wiązania jonowego w % |
|---|---|---|
2,1 | 67 | |
1,8 | 55 | |
1,5 | 43 | |
1,1 | 26 |
Źródło: Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik. Zakres rozszerzony, Warszawa 2019, s. 59.
W rzeczywistości czyste wiązanie jonowe () nie istnieje. Udział charakteru jonowego wiązania zależy od różnicy elektroujemności pierwiastków, które je tworzą. Im większa różnica elektroujemności, tym większy udział wiązania jonowego. Im mniejsza, tym większy udział wiązania kowalencyjnegowiązania kowalencyjnego. W praktyce przyjmuje się, że wiązanie w chlorku glinu czy chlorku żelaza() jest wiązaniem bardziej kowalencyjnym niż jonowym, ale w przypadku przyjmujemy, że sól ta ma charakter jonowy.
Reakcja miedzi i złota z chlorem
Suchy chlor jest aktywny chemicznie, a jego aktywność wzrasta w obecności wilgoci (wody) i wykazuje tak silne właściwości utleniające, że może utleniać miedź i złoto.
Chlorek glinu jest ważnym katalizatorem przemysłowym. Na skalę przemysłową reakcję syntezy przeprowadza się w obecności węgla.
Chlorek glinu stosowany jest w syntezach organicznych jako katalizator.
Słownik
wiązanie chemiczne, które powstaje w wyniku przeniesienia elektronu
wiązanie chemiczne, które powstaje przez uwspólnianie elektronów (pary elektronowej) przez atomy tworzące wiązanie
nazwa zwyczajowa związków pierwiastków grupy układu okresowego – związki zawierające atomy fluorowców często określane są mianem halogenków, np. , , itd. to halogenki litowców; , , itd. to halogenki berylowców; , to halogenki alkilowe, czyli pochodne węglowodorów
sole zawierające resztę kwasu chlorowodorowego w swojej strukturze
Bibliografia
Atkins P. Jones L., Chemia ogólna, Warszawa 2004.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987, s. 571‑574.
Litwin M., Styka‑Wlazła Sz., Szymońska J., Chemia ogólna i nieorganiczna. Podręcznik dla liceum, cz. 1, Warszawa 2004, s. 59.
Piosik R., Karawajczyk B. Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Gdańsk 2004, s. 790‑81.