Przeczytaj
Stała równowagi reakcji
Wraz ze zmianą temperatury obserwuje się zmianę stałej równowagi . W zależności od tego, jakiego typu jest reakcja, endotermicznaendotermiczna czy egzotermicznaegzotermiczna, obserwuje się odpowiednie zmiany wartości .
Należy pamiętać, że stała równowagi jest wartością bezwymiarową.
Zależność stałej równowagi od temperatury określa równanie:
gdzie:
– stała równowagi;
– stała charakterystyczna dla danej reakcji;
– ciepło reakcji ;
- stała gazowastała gazowa odpowiadająca wartości 8,314510 ;
- temperatura [K].
Reakcje egzotermiczne
W reakcjach egzotermicznych obserwujemy wydzielenie ciepła w trakcie reakcji. Schematycznie możemy to zapisać jako:
gdzie jako oznaczamy ciepło.
Wydzielanie ciepła z układu oznacza jego utratę. W tym wypadku wartość przyjmuje wartości ujemne. Po podstawieniu ujemnej wartości do równania:
zaobserwujemy wzrost wartości lnK wraz ze spadkiem temperatury.
W reakcjach egzotermicznych podwyższenie temperatury doprowadza do obniżenia wartości stałej . W przypadku obniżenia temperatury – wartość stałej rośnie. Taką zależność prezentuje poniższy wykres.
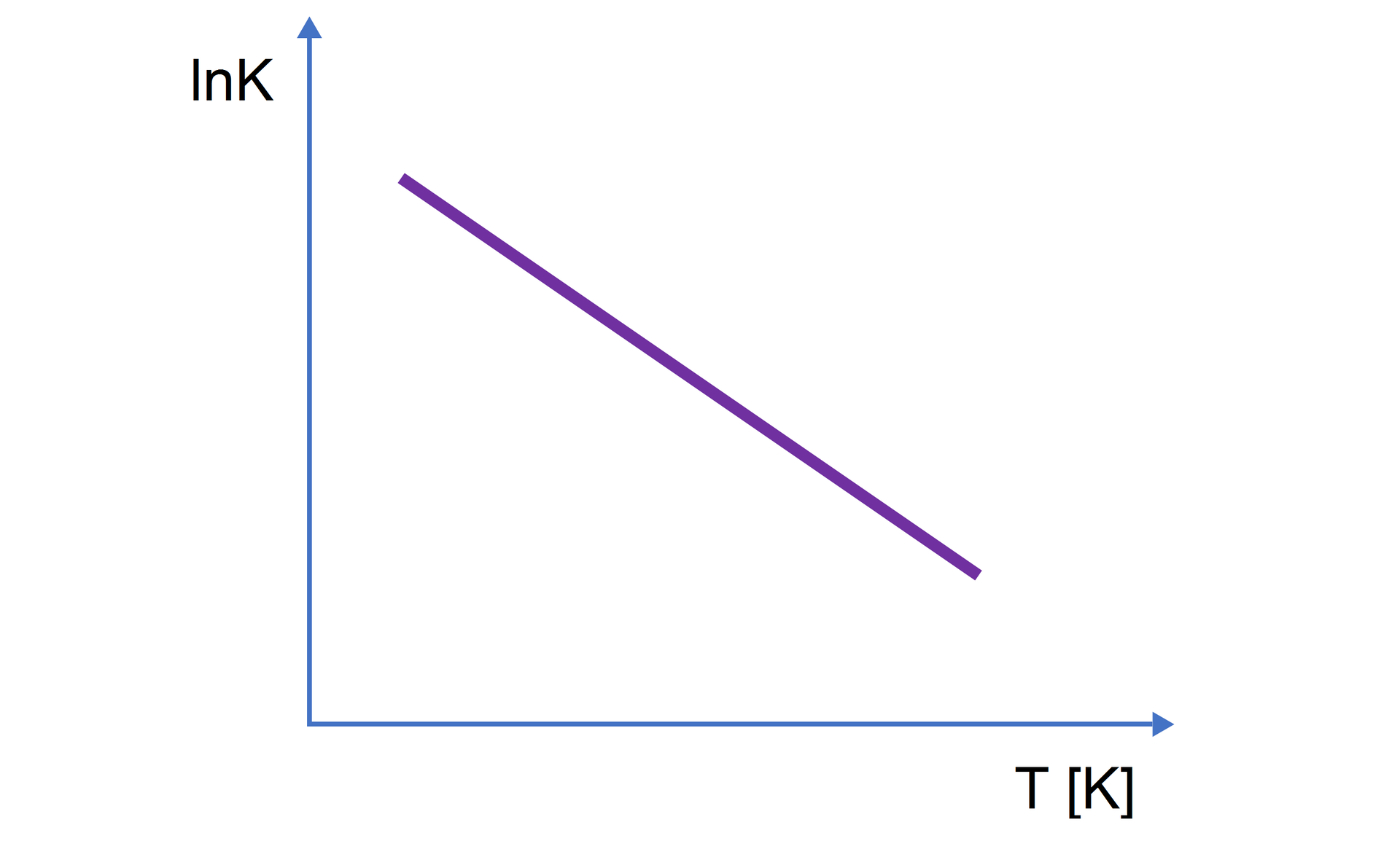
Wraz ze wzrostem temperatury obserwujemy obniżenie wartości logarytmu ze stałej równowagi .
Reakcje endotermiczne
W reakcjach endotermicznych, aby zaszła reakcja, należy dostarczyć ciepła. Schematycznie możemy to zapisać jako:
gdzie jako oznaczamy ciepło.
Pobieranie ciepła do układu oznacza jego przyrost. W tym wypadku wartość przyjmuje wartości dodatnie. Po podstawieniu dodatniej wartości do równania:
zaobserwujemy wzrost wartości lnK wraz ze wzrostem temperatury.
W reakcjach endotermicznych podwyższenie temperatury doprowadza do podwyższenia wartości stałej . W przypadku obniżenia temperatury wartość stałej maleje. Zależność taką prezentuje poniższy wykres.
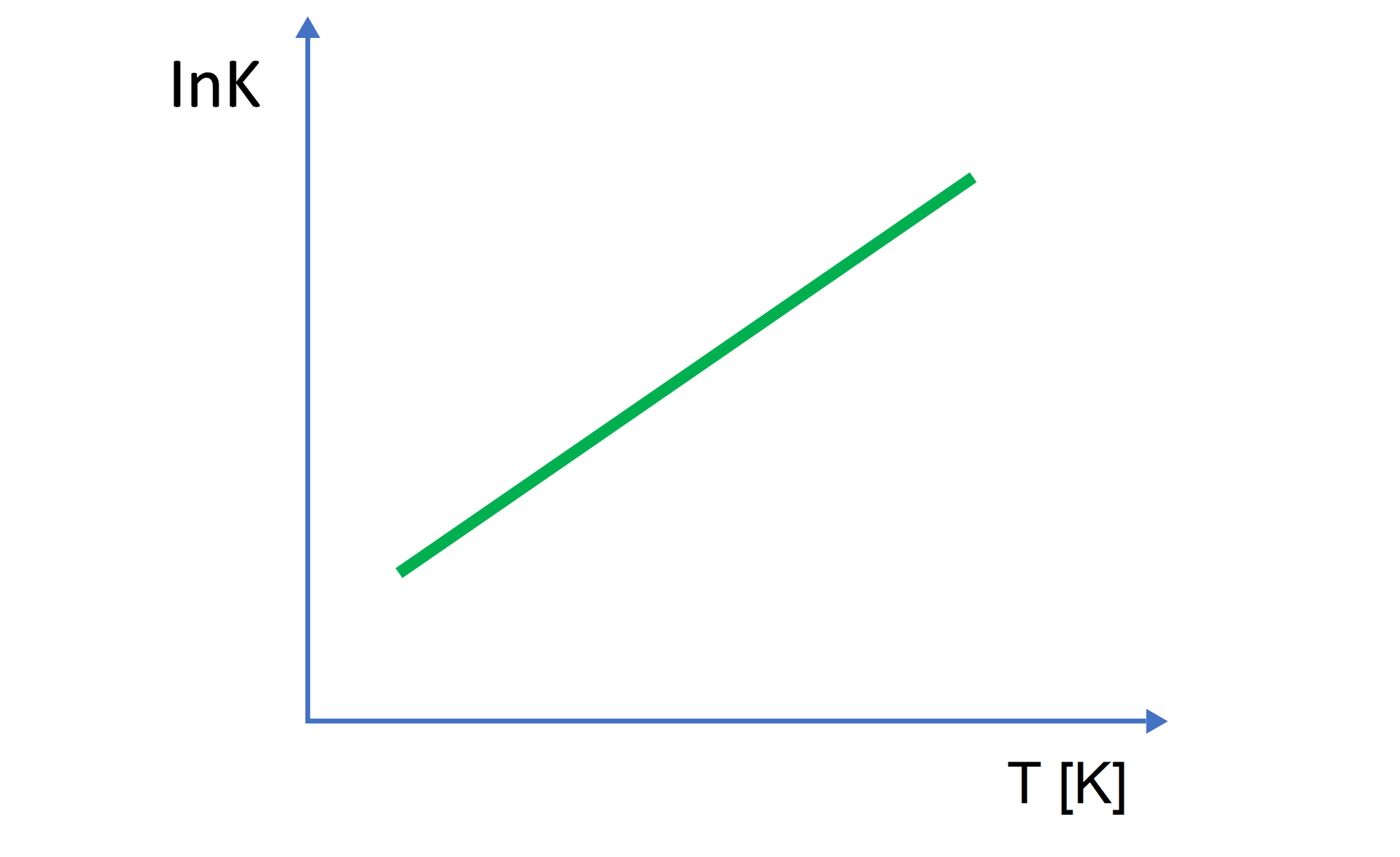
Wraz ze wzrostem temperatury obserwujemy podwyższenie wartości logarytmu ze stałej równowagi .
Podsumowanie
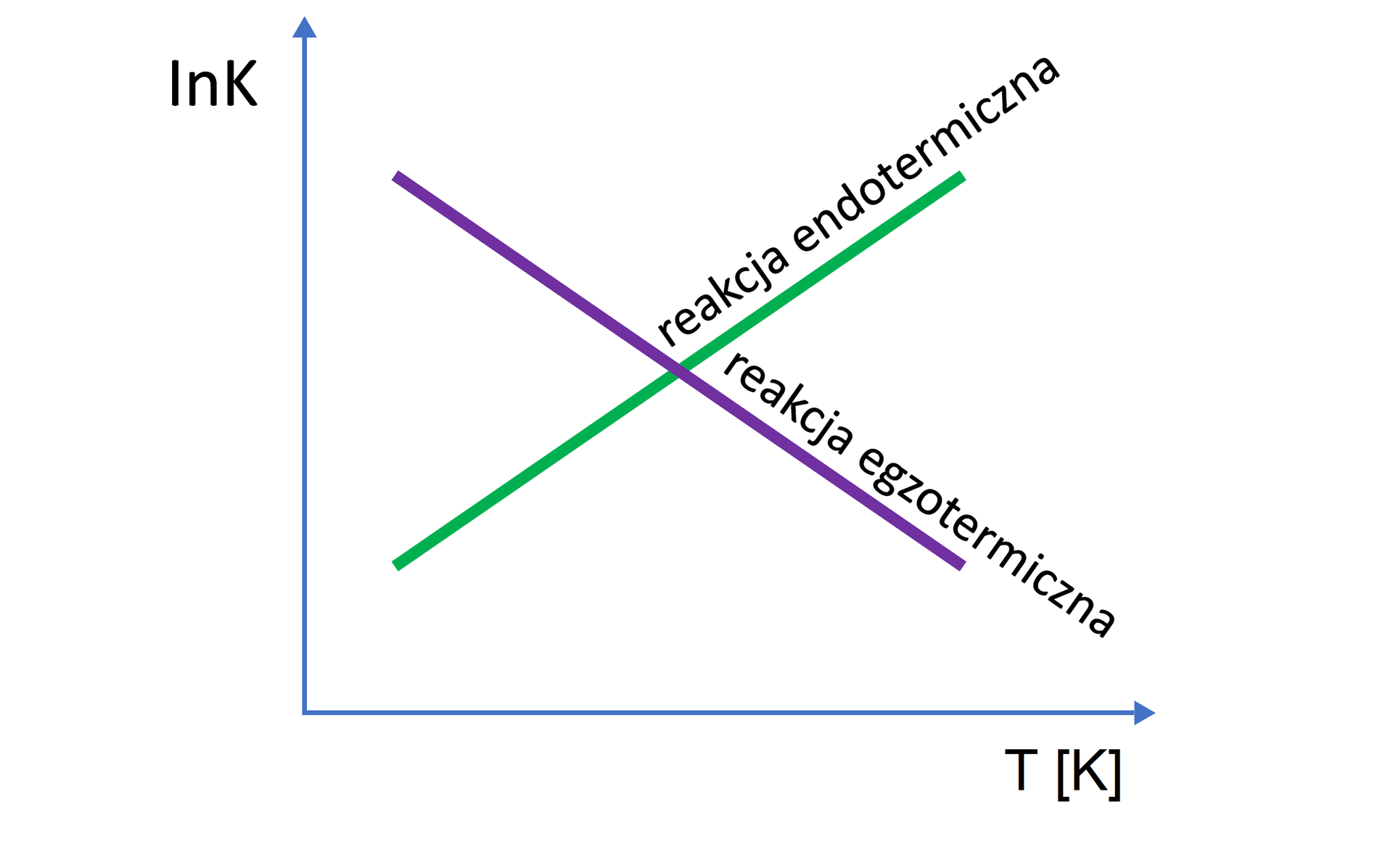
Temperatura wpływa na stan równowagi reakcji chemicznych. W przypadku reakcji egzotermicznych, wzrost temperatury powoduje obniżenie wartości stałej, a obniżenie temperatury powoduje wzrost wartości stałej . W reakcjach endotermicznych zmiana temperatury wywołuje efekt odwrotny, tzn. podwyższenie temperatury zwiększa wartość stałej , a obniżenie temperatury zmniejsza wartość .
Słownik
równa pracy wykonywanej przez 1 mol gazu, ogrzewany o 1 K, w procesie izobarycznym: ; dla gazu doskonałego stała gazowa równa się różnicy ciepeł molowych przy stałym ciśnieniu () i stałej objętości ():
reakcja chemiczna przebiegająca w warunkach izobaryczno‑izotermicznych (pod stałym ciśnieniem i w stałej temperaturze) z wydzielaniem ciepła do otoczenia
reakcja chemiczna przebiegająca w warunkach izobaryczno‑izotermicznych (pod stałym ciśnieniem i w stałej temperaturze) z pochłanianiem ciepła z otoczenia
Bibliografia
Bana J., Solarski W., Reguła Le Chateliera i Browna (Reguła przekory), Kraków 2010. [dostęp 11.11.2019 r.] https://zasoby1.open.agh.edu.pl/dydaktyka/chemia/a_e_chemia/4_kinetyka_statyka/ii_04_00_00.htm
Encyklopedia PWN
Pigoń K., Ruziewicz Z., Chemia fizyczna Tom 1, 2007.