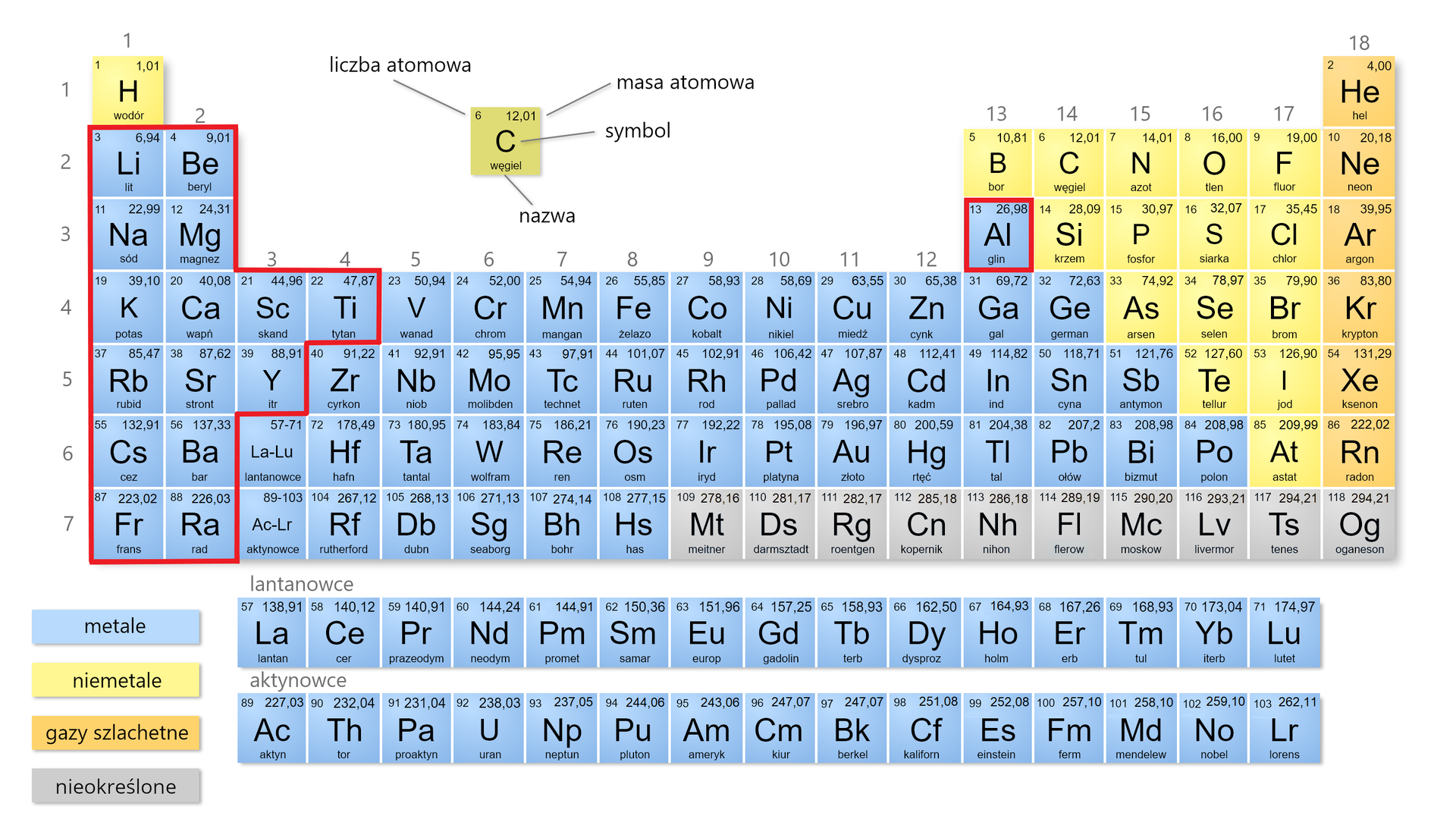
Przeczytaj
Klasyfikacja metali
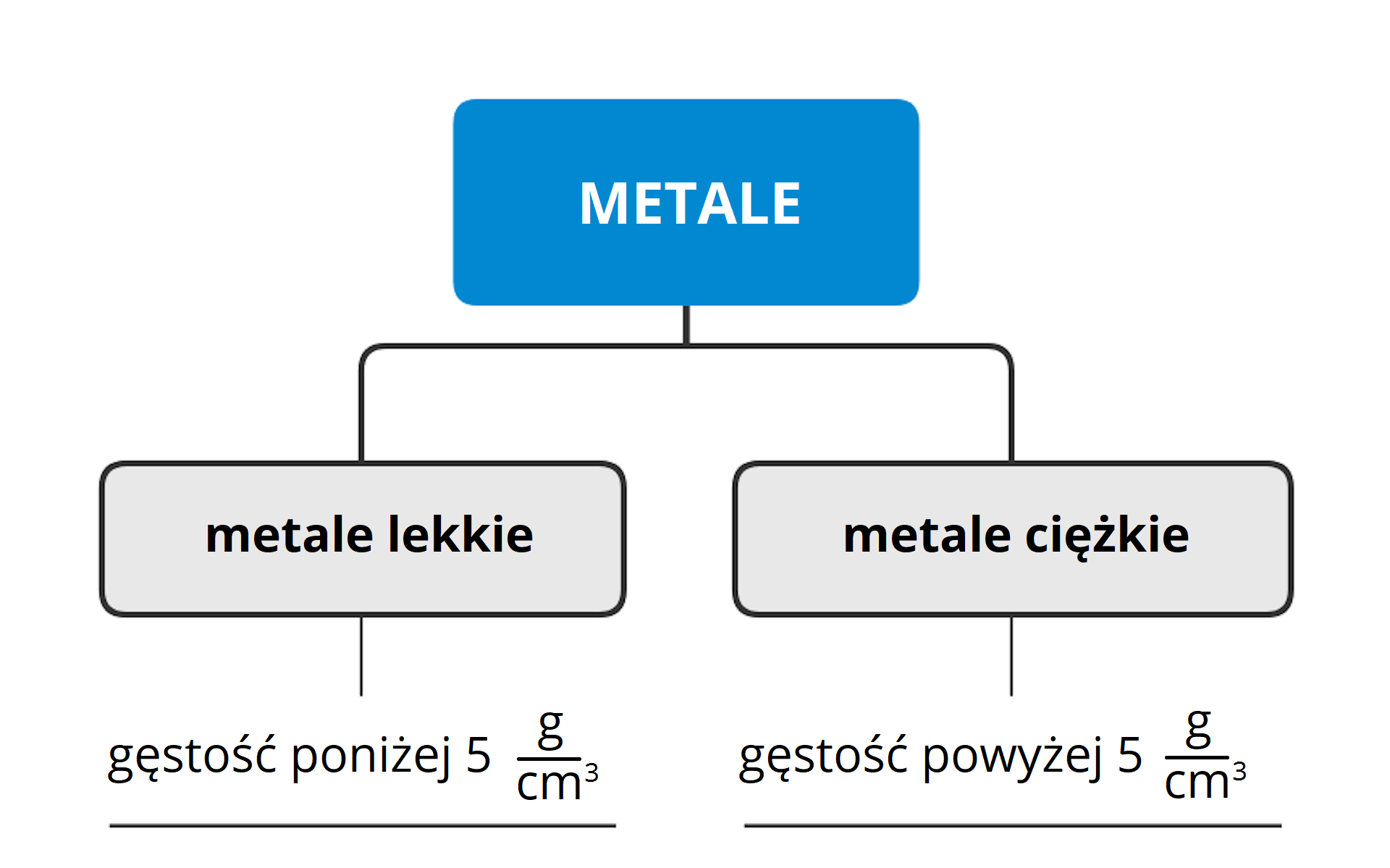
Pierwiastki metaliczne (metale) można podzielić, biorąc pod uwagę wartość ich gęstościgęstości wyznaczoną w warunkach normalnych (temperatura , ciśnienie ).
Czy wiesz, które pierwiastki zaliczamy do metali lekkich, a które do ciężkich?
Metale lekkie
Wśród metali lekkichmetali lekkich wyróżnić można łącznie pierwiastków.
Metale bloku – litowce i berylowce
litowce
Do litowców należą metale: lit (), sód (), potas (), rubid (), cez () oraz frans (). Ich gęstość rośnie wraz ze wzrostem liczby atomowej. Do najlżejszych metali należy lit, sód oraz potas, które są lżejsze od wody i pływają po jej powierzchni. Największa różnica gęstości oraz innych właściwości (temperatura topnienia i wrzenia) występuje pomiędzy litem a sodem. Gęstość pozostałych litowców nie przekracza .
- 1. zestaw danych:
- Metal: lit
- : 0,53; Podpis osi wartości: Gęstość [[g·cm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 2. zestaw danych:
- Metal: sód
- : 0,97; Podpis osi wartości: Gęstość [[g·cm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 3. zestaw danych:
- Metal: potas
- : 0,86; Podpis osi wartości: Gęstość [[g·cm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 4. zestaw danych:
- Metal: rubid
- : 1,53; Podpis osi wartości: Gęstość [[g·cm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 5. zestaw danych:
- Metal: cez
- : 1,87; Podpis osi wartości: Gęstość [[g·cm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 6. zestaw danych:
- Metal: frans
- : 1,87; Podpis osi wartości: Gęstość [[g·cm[baseline-shift: super; font-size: smaller;]-3[/]]]
berylowce
Do berylowców należą metale: beryl (), magnez (), wapń (), stront (), bar () oraz rad (). Gęstość berylowców w przeciwieństwie do litowców nie ulega regularnym zmianom wraz ze wzrostem liczby atomowej. Wśród berylowców wapń, podobnie jak potas i sód, powinien być przechowywany w nafcie, ponieważ szybko pokrywa się warstwą tlenku wapnia . Wysoka reaktywność chemiczna berylowców sprawia, że metale te występują w przyrodzie wyłącznie w postaci skał i minerałów.
Glin
Jedynym metalem lekkim bloku jest glin o gęstości (w temp. ). Glin jest kowalny i ciągliwy. W temperaturze pokojowej i atmosferze powietrza metal ten nie utlenia się, stąd też nie wymaga specjalnych warunków przechowywania. Na powierzchni glinu, w obecności tlenu wytrza się cienka wartwa tlenku glinu, która chroni metal przed dalszym utlenieniem. Zjawisko to znane jest jako pasywacja. Glin jest metalem użytkowym. Stopy glinu jako tworzywa o małej gęstości wykorzystywane są m.in. w przemyśle lotniczym.
Metale bloku : skand, tytan, itr
Skand – srebrzystobiały, miękki metal o gęstości . Skand matowieje pod wpływem powietrza i zmienia wówczas barwę na żółtą lub różową. Z uwagi na podobieństwo właściwości do lantanowców często zalicza sie go do ziem rzadkich. W stanie naturalnym występuje w kilku minerałach na terenach Skandynawii.
Tytan – srebrzystobiały, plastyczny metal, łatwy do obrabiania, a przy tym o dużej wytrzymałości mechanicznej. Zaletą tytanu jako tworzywa w porównaniu ze stalą jest jego mała gęstość ( w warunkach normalnych) i większa odporność na korozję.
Itr – srebrzystobiały, błyszczący metal o gęstości (w warunkach normalnych). W przyrodzie występuje wyłącznie w połączeniu z lantanowcami w minerałach ziem rzadkich. Czysty pierwiastek ulega pasywacji na powietrzu, a pod wpływem światła ciemnieje. Itr w postaci izotopu promieniotwórczego znalazł zastosowanie w lekach przeciwnowotworowych.
Metale ciężkie
Wśród metali ciężkichmetali ciężkich, których wartość gęstości przekracza , wyróżnić można:
Metale bloku (wszystkie z wyjątkiem skandu, itru oraz tytanu)
Metale ciężkie to zarówno metale pospolite – żelazo, miedź i cyna – jak również metale szlachetne – srebro, złoto, platyna. Metalem bloku o największej znanej gęstości jest osm. Jego gęstość została wyznaczona przy użyciu krystalografii rentgenowskiej i wynosi około .

Wśród metali ciężkich znajdują się również pierwiastki, które są silnymi truciznami. Należą do nich kadm () oraz rtęć () z bloku , a także ołów () z bloku . Toksyczne działanie wymienionych metali ciężkich wynika z faktu, że tworzą one trwałe połączenia z białkami, a także blokują czynność niektórych enzymów w organizmie.
Metale bloku
grupa – gal, ind, tal;
grupa – cyna, ołów;
grupa – bizmut;
grupa – polon.
Do najbardziej popularnych metali ciężkich, pod względem wykorzystania, należy cyna i ołów. Stosuje się je m.in. w stopach metali. Co ciekawe, cyna, z uwagi na występowania w dwóch odmianach alotropowych, przyjmuje różne wartości gęstości. Odmiana beta () ma gęstość , natomiast odmiana alfa () .

Metale bloku
lantanowce
Określane dawniej jako metale ziem rzadkich, z uwagi na nieczęste występowanie w przyrodzie. Posiadają gęstość w granicach -. Obecnie chemia lantanowców jest bogata w związki o potencjalnych zastosowaniach w nowoczesnych technologiach. Związki lantanowców stosowane są głównie jako katalizatory, leki przeciwnowotworowe czy elementy laserów.
Zaznacz na poniższym układzie okresowym pierwiastków metale lekkie.
Słownik
stosunek masy do objętości próbki wyrażona w jednostce (w przypadku gazów gęstość podaje się w )
metale, których wartość gęstości jest większa od w warunkach normalnych (temperatura , ciśnienie )
metale, których wartość gęstości jest mniejsza od w warunkach normalnych (temperatura , ciśnienie )
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2004.
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Cox P. A., Krótkie wykłady. Chemia nieorganiczna, Warszawa 2012.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002.
Encyklopedia PWN
Gorczyca M., Zejc A., Chemia leków. Podręcznik dla studentów farmacji i farmaceutów, Warszawa 2019.
Greenwood N. N., Earnshaw A., Chemistry of the elements, 2nd Edition, Oksford 1997.
Litwin M., Styka‑Wlazło Sz., Szymońska J., Chemia Ogólna i nieorganiczna, Warszawa 2005.