Przeczytaj
Wiązania chemiczne w cząsteczkach wodorków fluorowców to wiązania kowalencyjne spolaryzowane. Wraz z malejącymi wartościami elektroujemności fluorowców maleje polaryzacja wiązania H‑X.
Wszystkie cztery omawiane wodorki fluorowców bardzo dobrze rozpuszczają się w wodzie. Fluorowodór miesza się z wodą bez ograniczeń. Chlorowodór, bromowodór oraz jodowodór rozpuszczają się w wodzie w określonym stosunku (tabela).
Związek | ||||
Rozpuszczalność gazu w wodzie | Bez ograniczeń | 430 | 579 | 405 |
Maksymalne stężenie procentowe roztworu wodnego w temp. 25°C | - | 41 | 67 | 70 |
Tabela przedstawia rozpuszczalności wybranych wodorków oraz ich maksymalne stężenia procentowe w temperaturze pokojowej.
Rozpuszczalność wodorków 17. grupy układu okresowego w wodzie wynika z ich budowy. Związki typu H‑X wykazują budowę biegunową, tworząc dipoledipole, przez co są polarne. Zgodnie z zasadą: podobne rozpuszcza się w podobnym, wodorki te rozpuszczają się w polarnych rozpuszczalnikach, takich jak woda. Ponadto w środowisku wodnym ulegają reakcji dysocjacji - czyli rozpadowi na jony.
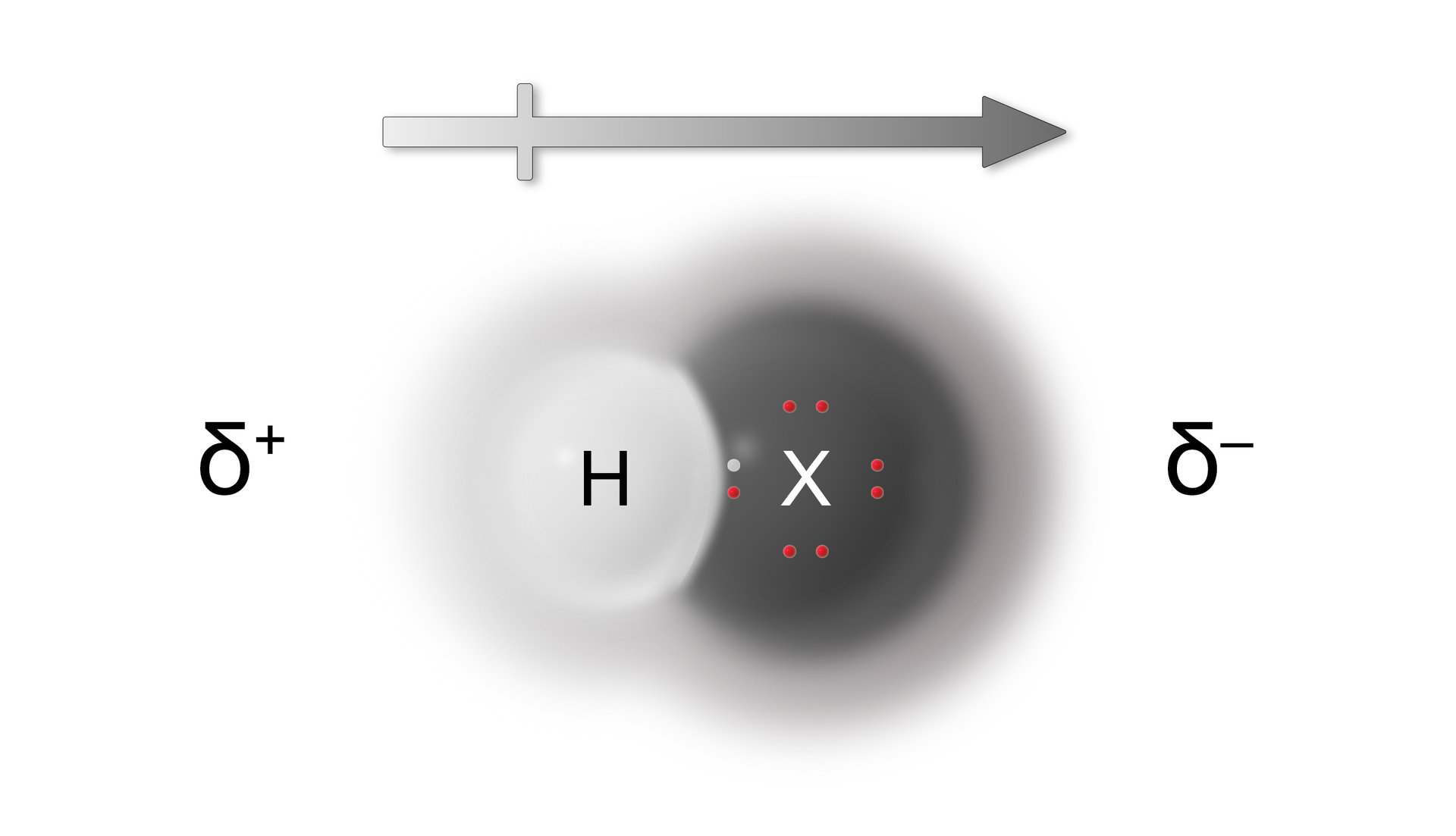
Jak przedstawiono na powyższej grafice, ładunek ujemny skupiony jest przy atomie fluorowca ze względu na obecność dużej gęstości elektronowej. Dodatni ładunek skupiony jest przy ubogim w elektrony atomie wodoru.
Dysocjacja wodorków
W roztworze wodnym fluorowodory ulegają reakcji dysocjacjidysocjacji zgodnie z równaniem:
gdzie jest atomem fluorowca (dla fluoru ).
W wyniku reakcji dysocjacji powstaje jon oksoniowy oraz anion fluorowca. Powyższe równanie pokazuje kwasowy charakter wodorków fluorowców.
Zgodnie z powyższym możemy zapisać wyrażenie na stałą dysocjacjistałą dysocjacji K:
Wartości stałych dysocjacji są stabelaryzowane i niezmienne w określonych warunkach ciśnienia i temperatury. Wartości stałych dysocjacji K dla wodorków fluorowców przedstawia tabela:
Związek | ||||
Stała dysocjacji | 6,3 · 10Indeks górny ‑4‑4 | 1,0 · 10Indeks górny 77 | 3,0 · 10Indeks górny 99 | 1,0 · 10Indeks górny 1010 |
Łatwo zauważyć, że moc kwasu rośnie w dół grupy. Wraz ze wzrostem promienia atomowego fluorowca oraz masy atomowej fluorowca wzrasta moc kwasu. Wraz ze wzrostem liczby atomowej fluorowca rośnie promień atomowy, co skutkuje zwiększeniem się długość wiązania X‑H, a co za tym idzie ułatwia oddysocjowanie protonu. Fluor o najmniejszym promieniu i najmniejszej masie atomowej w grupie tworzy najsłabszy kwas, kolejne natomiast należą już do mocnych kwasów.
Na przykładzie fluorowodoru zapiszmy równanie procesu dysocjacji oraz wyrażenie na stałą dysocjacji.
Zapisz równanie dysocjacji oraz równanie na stałą dysocjacji wodnego roztworu fluorowodoru.
Rozwiązanie:
Zgodnie ze schematem dysocjacji wodorków 17. grupy układu okresowego:
zapiszmy równanie dysocjacji:
Następnie zapiszmy wyrażenie na stałą dysocjacji K:
Czy wiesz, że fluorowodór służy do trawienia szkła? Fluorowodór reaguje ze szkłem zgodnie z równaniem:
przez co jego roztwory przechowywane są w butelkach z tworzyw sztucznych.
Eksperyment
Aby eksperymentalnie określić odczyn wodnego roztworu wodorków pierwiastków 17. grupy, wykonaj poniższy eksperyment. Postaw odpowiednią hipotezę, problem badawczy oraz zapisz obserwacje i wnioski.
Słownik
jest to cząsteczka zbudowana z pierwiastków o różnej elektroujemności, w której obecne jest rozdzielenie ładunku dodatniego i ujemnego
stosunek stężeń jonów powstających w wyniku dysocjacji elektrolitycznej do stężenia cząstek niezdysocjowanych pozostających w równowadze
rozpad cząsteczek na jony pod wpływem czynnika zewnętrznego
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Greenwood N. N., Earnshaw A., Chemistry of the Elements, 2nd Editon, Oksford 1997, s. 730, 806‑808, 900.
Trzebiatowski W., Chemia nieorganiczna, Warszawa 1978, wyd. 8.
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2019.