Przeczytaj
Jaki wkład w układ okresowy pierwiastków miał Dmitrij Mendelejew?
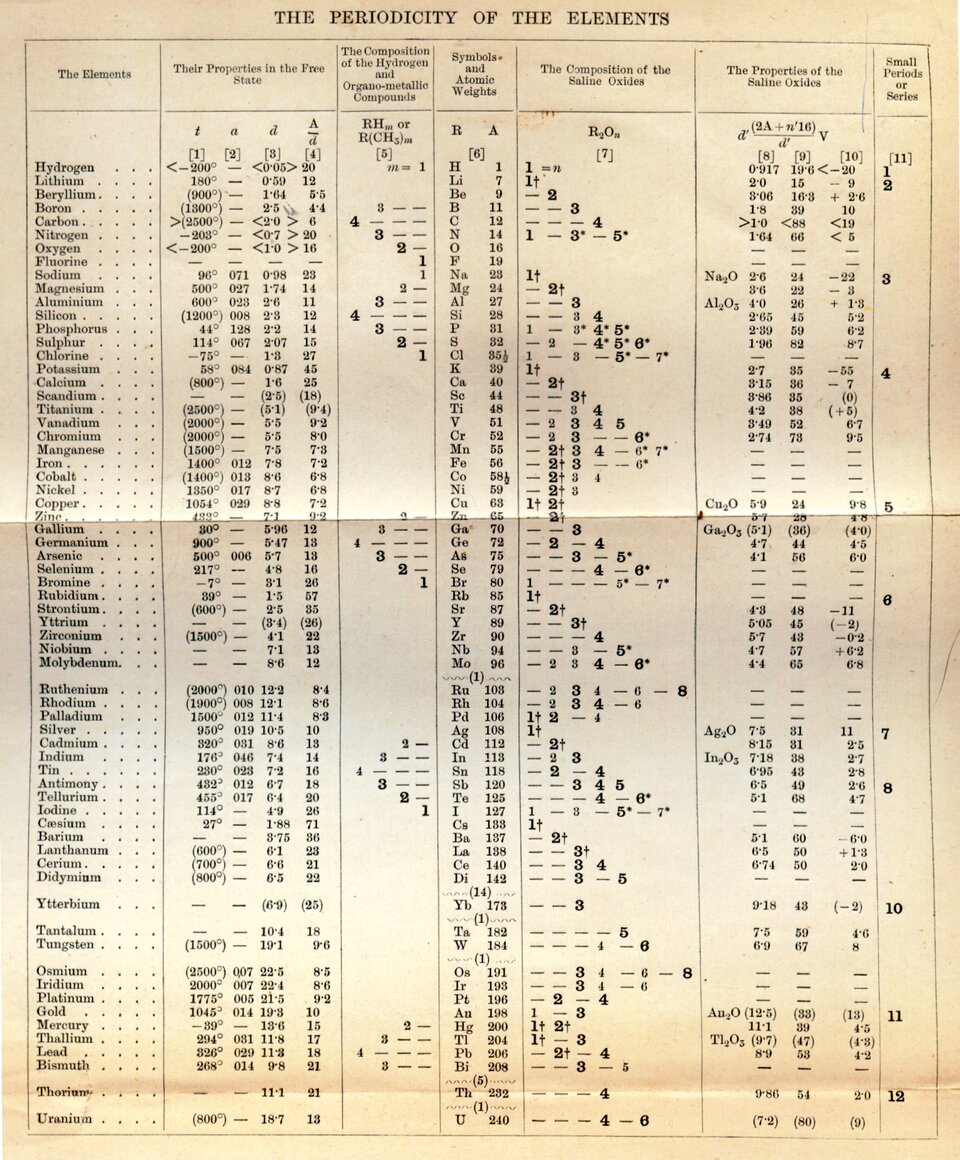
Ułożenie pierwiastków chemicznych w logiczny ciąg było celem wielu naukowców. Za czasów Mendelejewa znane było nieco ponad pierwiastków chemicznych. Mendelejew próbował je ułożyć zgodnie z rosnącą masą atomową oraz w oparciu o zmieniające się właściwości. Jeśli pomiędzy pierwiastkami następowały znaczące zmiany tych właściwości, to wówczas pozostawiał wolne miejsce w skonstruowanym przez siebie układzie. Przewidział w ten sposób istnienie jeszcze ośmiu pierwiastków chemicznych, które z czasem zostały odkryte i zajęły te puste miejsca. To właśnie Mendelejew zauważył jako pierwszy, że pewne właściwości pierwiastków regularnie się powtarzają, co dało początek tzw. prawu okresowości, które obecnie przyjmuje następującą postać: właściwości pierwiastków chemicznych, uporządkowanych zgodnie ze wzrastającą liczbą atomową, powtarzają się okresowo
.
W czasach Mendelejewa nie było logicznego uzasadnienia dla prawa okresowości. Dopiero takie odkrycia, jak budowa wewnętrzna atomu, wyznaczenie liczb atomowych, które określają liczbę elektronów tworzących chmurę elektronową i protonów w jądrze atomowym, oraz zastosowanie teorii kwantowej, wyjaśniającej budowę powłok elektronowych, wpłynęły na wyjaśnienie prawa okresowości.
Jak jest zbudowany obecnie używany układ okresowy pierwiastków?
Obecnie stosowany układ okresowy pierwiastków zbudowany jest z czterech bloków energetycznychbloków energetycznych: , , oraz , a pierwiastki uszeregowane są zgodnie ze swoimi konfiguracjami elektronowymikonfiguracjami elektronowymi.

Analizując wygląd układu okresowego, w okresach i grupach, można zauważyć, że liczby atomowe pierwiastków rosną w okresie od lewej do prawej oraz w dół grup.

O czym mówi nam pozycja danego pierwiastka w układzie okresowym?
Z położenia pierwiastków w układzie okresowym można dowiedzieć się wiele na temat właściwości chemicznych oraz budowy atomu pierwiastków. Przeanalizuj samodzielnie właściwości, które ulegają zmianom w grupach , oraz od do układu okresowego. Następnie porównaj swoje wnioski z poniższym opisem.
elektroujemnośćelektroujemność;
promień atomowypromień atomowy;
pierwsza energia jonizacjipierwsza energia jonizacji;
charakter metaliczny;
charakter niemetaliczny.
Wymienione właściwości zmieniają się wraz z kierunkiem wskazanym przez strzałki na układzie okresowym, w sposób następujący:
promień atomowy – maleje;
energia jonizacji – rośnie;
charakter metaliczny – maleje;
charakter niemetaliczny – rośnie;
elektroujemność – rośnie, z wyjątkiem anomalii elektroujemności obserwowanej w grupie układu okresowego.
Początkowo tablica zaproponowana przez Mendelejewa nie miała wielu zwolenników wśród naukowców. Słynny spór wokół masy atomowej telluru wywołał wątpliwości nawet u samego twórcy – Mendelejewa. Otóż tellur ( grupa, okres) zaprzecza prawu okresowości. W układzie, ze względu na wyższą masę atomową () niż jod (), powinien znajdować się dalej lub, wnioskując z jego właściwości, powinien mieć niższą masę atomową. Jednak tak nie jest, co ma związek ze składem izotopowym tego pierwiastka.
Konfiguracje elektronowe
W każdej z tzw. grup głównych konfiguracje powłoki walencyjnej są skonstruowane w ten sam sposób.
W bloku s powłoki walencyjne atomów pierwiastków przyjmują postać (grupa ) oraz (grupa ), gdzie „” to numer okresu, w którym leży dany pierwiastek. W bloku elektrony walencyjne atomów pierwiastków są rozmieszczone na podpowłokach, zgodnie ze schematem („” oznacza numer grupy pomniejszony o ). Blok zawiera pierwiastki, których atomy mają elektrony walencyjne, rozmieszczone zazwyczaj na podpowłokach i . Jednak w tym bloku pojawiają się już pewne anomalie w rozmieszczeniu elektronów – tzn. elektrony zajmują nie te orbitale, które, zgodnie z przyjętymi już informacjami, powinny zajmować (np. promocja elektronowa dla czy ). Pojawienie się nieprawidłowości wynika z bardzo zbliżonej energii poziomów i . Odchylenia od przyjętego schematu stają się jeszcze bardziej widoczne w przypadku konfiguracji elektronowej atomów pierwiastków bloku .

Odczytując po kolei konfiguracje elektronowe dla wybranych atomów pierwiastków grup , , i od do , można zauważyć korelację między rozkładem elektronów w atomach a budową układu okresowego pierwiastków. Ta zbieżność występuje i w grupach, i w okresach. W przypadku grup, tyczy się to ostatniej powłoki (zwanej powłoką walencyjną), a w okresach jest to zazwyczaj ta sama liczba powłok elektronowych. Przykładowo: atomy pierwiastków okresu rozmieszczają elektrony tylko na jednej powłoce, atomy pierwiastków okresu na dwóch powłokach, a atomy pierwiastków okresu na trzech powłokach itd.

Ta prawidłowość jest również widoczna dla pierwiastków w bloku energetycznym d. Należy jednak pamiętać, że występuje tam szereg wyjątków, które obraz ten mogą nieco zniekształcić.
Wyjątki te to m.in. chrom, miedź, srebro oraz molibden. Ich konfiguracja elektronowa nie wynika z kolejności tych pierwiastków w układzie okresowym, lecz wiąże się z konfiguracją orbitali, która jest korzystniejsza energetycznie, trwalsza i posiada dużą symetrię przestrzenną.
Słownik
opis atomu; polega na rozkładzie elektronów na podstawie prawdopodobieństwa ich położenia w atomie w funkcji odległości od jądra
elektrony, które występują na zewnętrznych powłokach elektronowych atomu (wyjątki blok i ); zajmują orbitale o największej energii (dla danego pierwiastka), biorą udział w tworzeniu wiązań chemicznych i decydują o właściwościach chemicznych pierwiastka
prawo sformułowane po raz pierwszy przez Dmitrija Mendelejewa (), w obecnej formie mówiące, że właściwości pierwiastków chemicznych, uporządkowanych zgodnie ze wzrastającą liczbą atomową, powtarzają się okresowo; na podstawie tego prawa powstała tzw. tablica Mendelejewa – układ okresowy pierwiastków chemicznych
grupa pierwiastków o podobnym schemacie rozmieszczenia elektronów walencyjnych na orbitalach atomowych
regularnie powtarzający się
miara zdolności atomów do przyciągania elektronów
liczba, która określa wielkość atomu; dla cząsteczek dwuatomowych jest to połowa długości pojedynczego wiązania kowalencyjnego w tej cząsteczce; dla metali to połowa odległości między sąsiadującymi jonami metalu w sieci krystalicznej
energia potrzebna do oderwania elektronu od atomu i przekształcenia go w jednododatni jon prosty
energia potrzebna do oderwania elektronu od jednododatniego jonu prostego i przekształcenia go w jon dwudodatni
pionowa kolumna w układzie okresowym pierwiastków chemicznych; w obecnym układzie okresowym są to grupy , oraz od do .
Bibliografia
Encyklopedia PWN
Benfey O. T., Benfey's Spiral Periodic Table or Periodic Snail, online: https://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=33, dostęp: 01.02.2021.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.